不同盐度下半滑舌鳎幼鱼非特异性免疫酶活力分析*
2014-04-17房子恒田相利董双林王国栋
房子恒,田相利,董双林,戴 超,王国栋
(中国海洋大学海水养殖教育部重点实验室,山东 青岛266003)
盐度对于鱼类的生长及非特异性免疫有显著影响[1-5]。多数广盐性的硬骨鱼类可以通过调节体内的离子含量来适应盐度大范围的变化,普遍认为鱼类存在一个等渗点,当盐度超出等渗点时会让机体消耗更多的能量来维持机体的水盐平衡[6-7]。有研究表明鱼类最多可消耗20%~50%的能量来用于渗透压的调节,也有文献报道消耗的能量可能只有10%[8]。当水生水生物长期处于高盐或低盐胁迫的条件下,往往会引起生物体体质下降,并可能导致死亡[9]。通常鱼类具有完善的非特异性免疫系统来抵御外界的环境胁迫,盐度的变化会对相应的免疫因子产生影响,例如,当鱼类长期受到高盐或低盐的胁迫时,机体内会产生大量的氧自由基并可能导致氧化性的损伤,而抗氧化酶可以有效的清除这些自由基[10]。因此,鱼体各组织器官中非特异性免疫酶活力的变化一定程度上可以作为反映鱼体对不同盐度胁迫适应能力的生理指标。
鱼类的渗透调节是身体各个组织器官包括消化系统、排泄系统、皮肤、鳃等组织器官协同作用的结果[11]。其中,鳃及肾脏是鱼体中要的渗透压调节器官,当鱼体长期处于高于自身等渗点的水体中时,鱼体不断失水同时会摄入大量的盐分,此时鳃会通过氯细胞向体外排出离子,肾的滤过作用增强,水的重吸收作用也增强,以维持机体细胞内的低渗环境,相反,当鱼体进入低渗甚至淡水环境后,则主要依靠肾脏降低对水分的通透性,排出低渗尿液来维持渗入体内水分与排除水分的平衡,同时鳃也可少量的吸收环境中的离子来维持细胞内高渗的环境[12-13]。而肝脏是鱼体重要的新陈代谢器官,参与鱼体中抗氧化、糖原合成、分泌胆汁等重要生理过程。因此,当鱼体进入非等渗点的环境时,长期的胁迫必然会导致组织器官的代谢功能发生改变,导致更多氧自由基及代谢废物的产生。
半滑舌鳎(Cynoglossussemilaevis)主要分布在我国黄海和渤海,是一种典型的海水广盐性鱼类[14]。由于其味道鲜美、经济价值较高,近几年来半滑舌鳎逐渐成为我国重要的养殖种类之一。尽管在广东地区有低盐度养殖半滑舌鳎的实践(盐度5左右),但一般认为其最适生长盐度范围为20~32[15]。目前,有关盐度对半滑舌鳎生长及生理生态学的影响已有相关报道[16-17],不过有关盐度对半滑舌鳎非特异性免疫能力的研究还未见报道。在目前研究的基础上,本研究进一步扩大了实验盐度的范围,将半滑舌鳎幼鱼生存水体盐度最低降低至淡水,并延长了半滑舌鳎幼鱼在不同盐度条件下适应的时间,进一步对不同组织中的非特异性免疫酶活力进行了研究,以期丰富半滑舌鳎的生物学资料,为提高半滑舌鳎的海水养殖效率以及开发淡水养殖提供更多的理论依据。
1 材料与方法
1.1 实验鱼的来源、暂养和驯化
实验所用半滑舌鳎幼鱼购自莱州明波水产有限责任公司,挑选规格较大且个体强壮,活力较强的幼鱼。实验用鱼运至中国海洋大学岙山卫实验基地后,暂养于多个水族箱中。暂养期间温度控制在(21±0.5)℃,24h充气泵充氧,日换水量100%,光照周期14L∶10D。稳定7d后,待其适应实验室环境条件后,进一步筛选相近规格的半滑舌鳎幼鱼,开始缓慢驯化至实验所需盐度。先以每天盐度5的速度由盐度30驯化至盐度25、20、15,之后以每天盐度2的速度驯化至盐度10和淡水,然后在各盐度下对半滑舌鳎驯养7d,以使其适应新的水环境条件。低盐度海水由天然海水(盐度30左右)与曝气自来水调配而成。
1.2 实验设计和管理
本实验设置淡水、盐度5、10、20和30共5个盐度处理,每个处理设置5个重复,每个重复放置7尾规格相似、无病健康的半滑舌鳎幼鱼。每天7∶00和19∶00投喂配合饲料(广东越群海洋生物研究开发有限公司,广东揭东),30min后收集残饵,日投喂量为鱼体重的3%~5%,其它控制条件同暂养条件。整个实验于2011年9月28日开始,11月27日结束,实验时间为60d。
1.3 样品的采集及酶活的测定
实验结束后所有幼鱼经24h饥饿处理后全部称重取样,取样前对幼鱼进行MS-222麻醉处理,取其肝脏、肌肉、鳃和肾脏组织放入离心管中,迅速投入液氮冷冻,再转移到-80℃冰箱保存,以上操作在冰盘中进行。所有样品带回实验室后分别测定各组织(肝脏、肌肉、鳃、肾脏)内超氧化物歧化酶(SOD)活力,过氧化氢酶(CAT)活力、碱性磷酸酶(AKP)活力及酸性磷酸酶(ACP)活力。组织样品先用剪刀剪碎,准确称取0.2g于玻璃匀浆管中,加入9倍体积的生理盐水后匀浆机匀浆,后于 Allegra X-22R 型冷冻离心机3 000r/min离心10min,然后分别稀释至所需浓度后进行酶活的测定。所有酶活力及蛋白含量(蛋白的测定采用考马斯亮蓝法)的测定均采用南京建成生物研究所提供的试剂盒。
SOD活力采用的是黄嘌呤氧化酶法,1个酶活力单位(U)定义为在37℃水浴下每毫克组织蛋白质在1mL反应液中超氧化物歧化酶抑制率达50%时的超氧化物歧化酶量。CAT活力的测定采用紫外比色法,定义在37℃水浴下每毫克组织蛋白每秒分解1mmol的H2O2的量为1个活力单位(U)。AKP活力单位的定义:在37℃水浴下每克组织蛋白与基质作用15min产生1mg酚为1个酶活力单位(U)。ACP活力单位的定义:在37℃水浴下每克组织蛋白与基质作用15 min产生1mg酚为1个酶活力单位(U)。
1.4 数据处理
所得数据采用SPSS13.0软件的方差分析(ANOVA)及Duncan多重比较进行分析处理,以P<0.05作为差异显著。
2 结果
2.1 盐度对半滑舌鳎幼鱼生长及存活的影响
不同盐度下半滑舌鳎幼鱼的生长情况见表1。可以看出,淡水组中半滑舌鳎幼鱼的生长受到了明显的抑制(P<0.05)。到实验进行到20d时,淡水条件下生长的半滑舌鳎幼鱼体重已显著低于其它处理(P<0.05);实验进行到40d,盐度10和20下半滑舌鳎幼鱼的体重显著高于其它处理(P<0.05),以淡水条件下为最低;实验结束时,半滑舌鳎幼鱼末体重在盐度10和20时较高,显著高于淡水、盐度5和30处理(P<0.05),但盐度5和30未见显著差异(P>0.05)。在整个实验周期当中无半滑舌鳎幼鱼死亡。
2.2 盐度对半滑舌鳎幼鱼不同组织SOD活力的影响

表1 不同盐度下半滑舌鳎幼鱼的生长情况(平均值±标准误)Table 1 Growth performance of Cynoglossussemiliaevis at different salinities(mean±SE) /g
不同盐度条件下半滑舌鳎幼鱼组织中SOD活力见图1。可以看出,肝脏中的SOD在盐度20时活力显著高于淡水组(P<0.05);而淡水组肌肉中SOD的活力显著性升高(P<0.05),其余盐度条件下活力未见显著差异(P>0.05);在鳃中,盐度20和30下SOD活力显著高于淡水、盐度5和10;肾脏中的SOD活力随着盐度的升高总体呈现先下降后升高的趋势,在盐度5和10时活力最低,显著低于淡水及盐度30处理(P<0.05)。
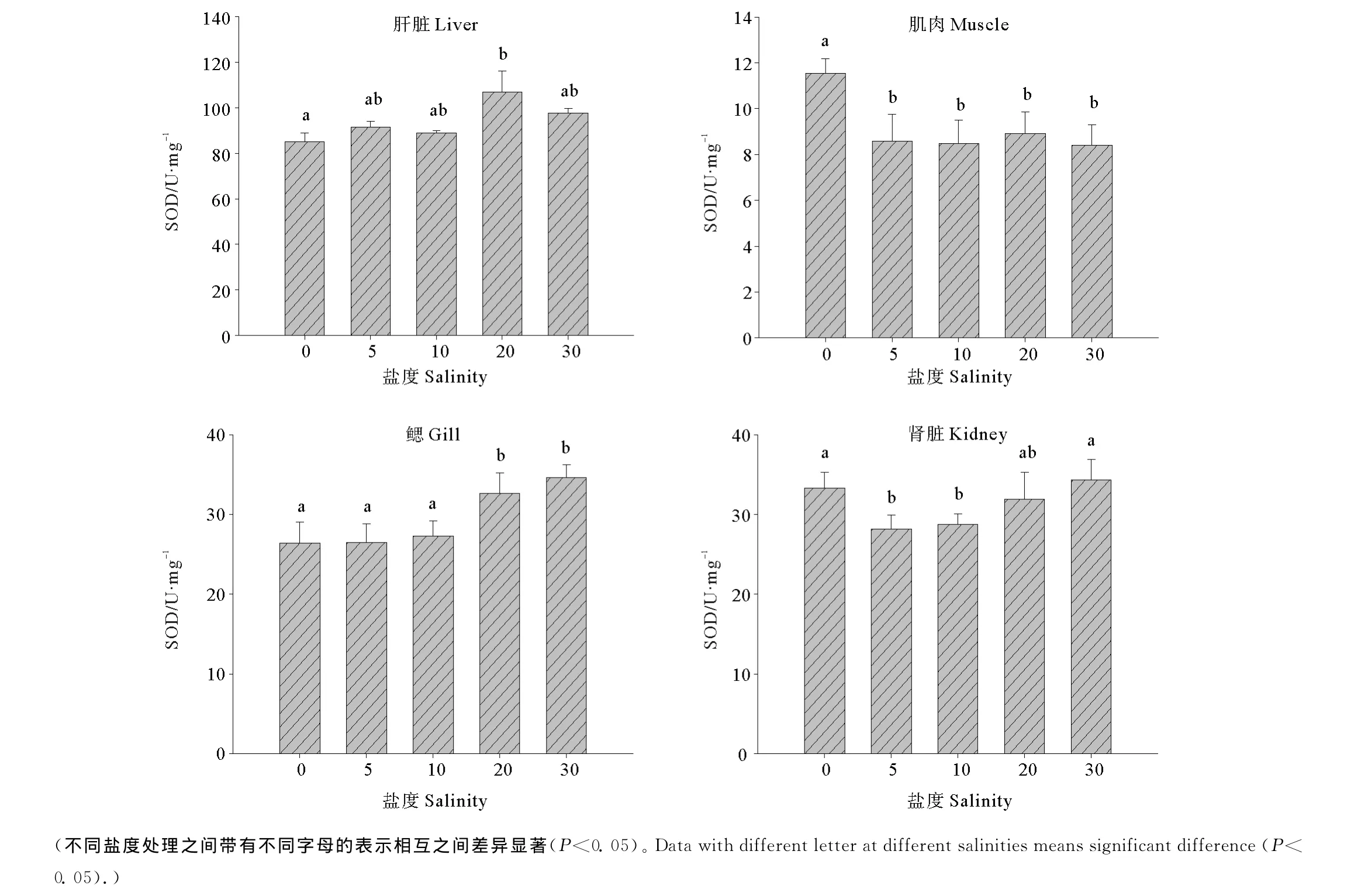
图1 不同盐度条件下半滑舌鳎幼鱼不同组织SOD活力Fig.1 Effect of salinities on the activities of SOD in different tissues of Tongue Sole(mean±SE)
2.3 盐度对半滑舌鳎幼鱼不同组织中CAT活力的影响
不同盐度条件下半滑舌鳎幼鱼组织中CAT活力见图2。可以看出,淡水组肝脏中CAT的活力显著高于其它各组(P<0.05),盐度5明显高于盐度10,20和30(P<0.05),盐度5时显著高于盐度10,20和30(P<0.05),其余处理之间则未见显著性差异(P>0.05);鳃中的CAT活力在盐度20时最低,显著低于盐度30(P<0.05),其余各处理之间无显著性差异(P>0.05);盐度对肾脏中的CAT活力影响不显著(P>0.05);在肌肉中未能检测到CAT活力。
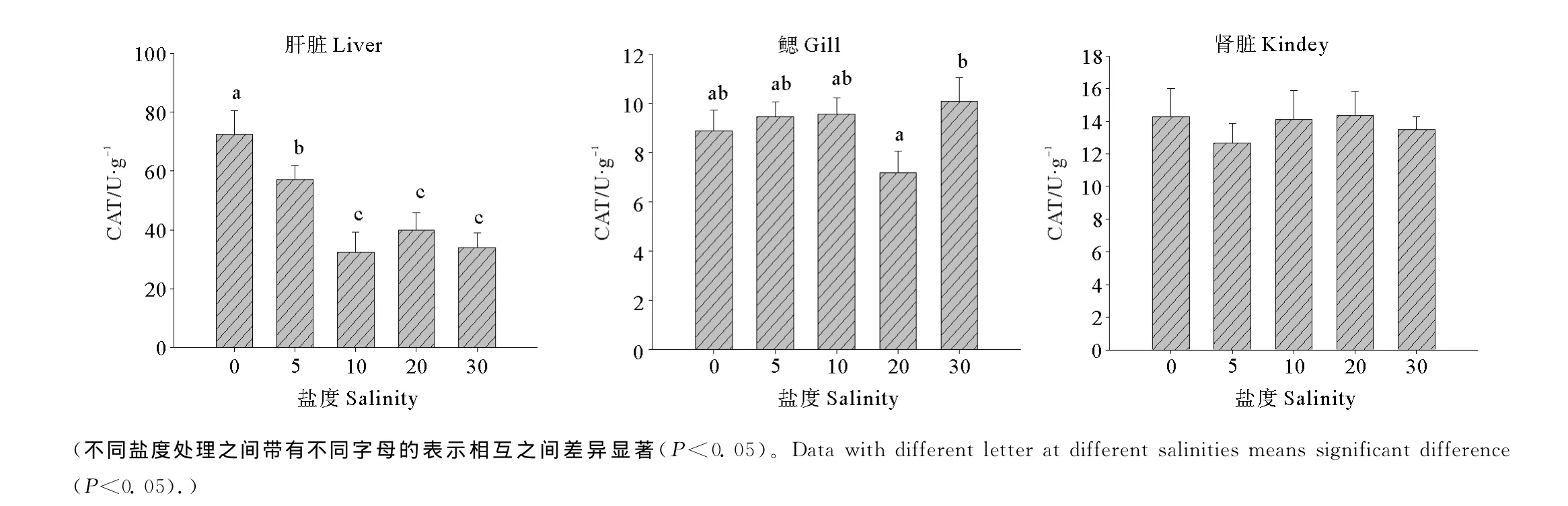
图2 不同盐度条件下半滑舌鳎幼鱼不同组织CAT活力Fig.2 Effect of salinities on the activities of CAT in different tissues of Tongue Sole(mean±SE)
2.4 盐度对半滑舌鳎幼鱼不同组织中AKP活力的影响
不同盐度条件下半滑舌鳎幼鱼组织中AKP活力见图3。可以看出,肝脏中AKP的活力随着盐度的升高呈现先升高后降低的趋势,盐度20时活力显著高于淡水及盐度5和盐度30(P<0.05);肌肉中AKP的活力随着盐度的升高逐渐升高,其中,淡水组中AKP的活力显著低于盐度20和盐度30(P<0.05);低盐度对鳃中AKP的活力有显著的促进作用,盐度5和10时鳃中的AKP活力显著高于盐度20和30两个处理(P<0.05);肾脏中的AKP活力在淡水和盐度5时最低(P<0.05),其余各组之间未见显著差异(P>0.05)。
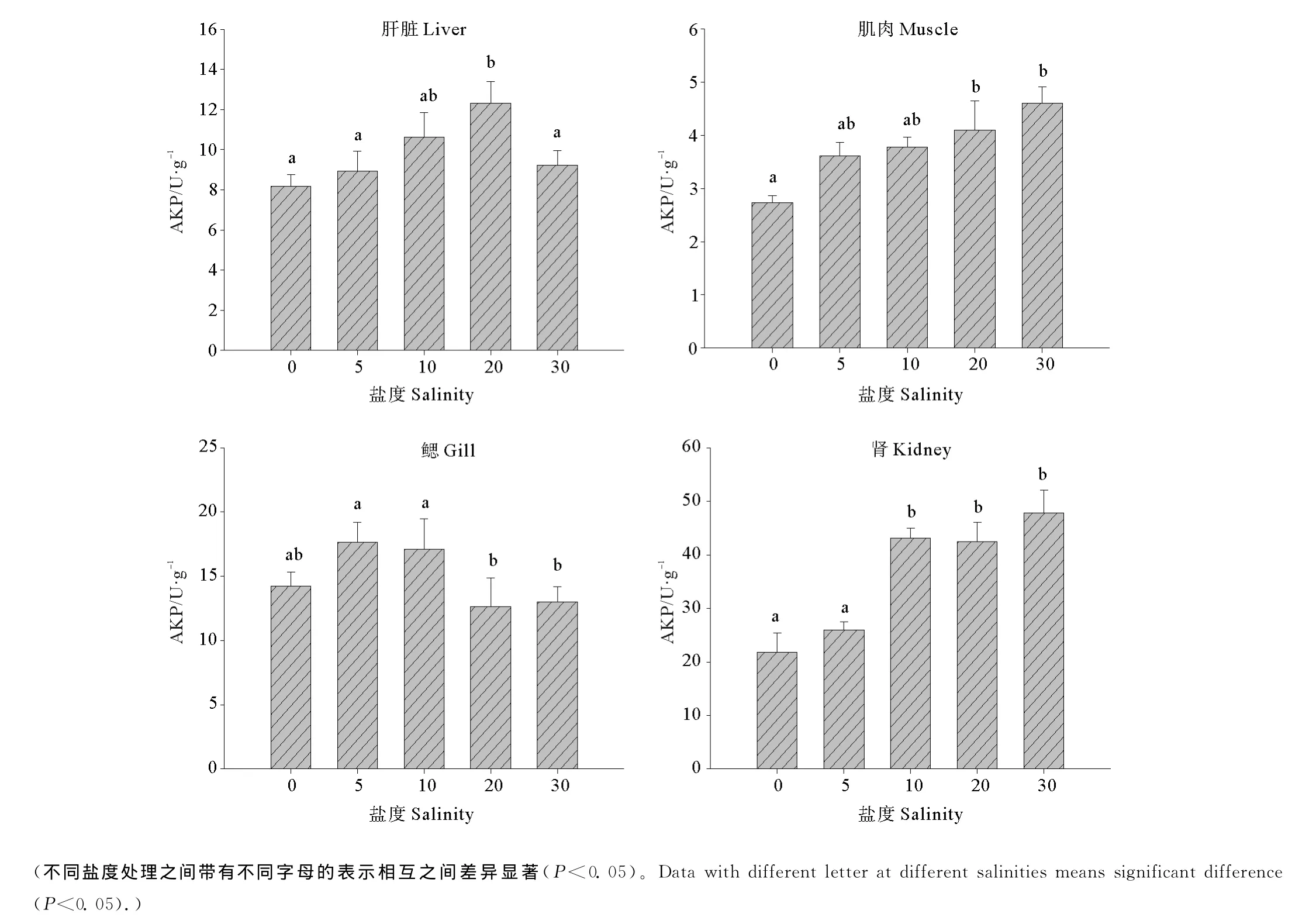
图3 不同盐度条件下半滑舌鳎幼鱼不同组织AKP活力Fig.3 Effect of salinities on the activities of AKP in different tissues of Tongue Sole(mean±SE)
2.5 盐度对半滑舌鳎幼鱼不同组织中ACP活力的影响
不同盐度条件下半滑舌鳎幼鱼组织中ACP活力见图4。可以看出,肝脏中的ACP活力随着盐度的升高呈现出逐渐降低的趋势,其中,以淡水条件下活力最高,显著高于盐度20和盐度30处理(P<0.05);盐度对肌肉中ACP活力影响不显著(P>0.05);鳃中ACP的活力随实验盐度的升高呈降低-升高-降低的变化趋势,其中盐度5条件下的ACP活力显著低于淡水和盐度20条件下的ACP活力(P<0.05);肾脏组织在盐度5时的ACP活力显著低于淡水和盐度20、30(P<0.05)。
3 讨论
3.1 不同盐度对半滑舌鳎幼鱼生长的影响
已有研究表明,半滑舌鳎对低盐度环境具有极强的耐受性。在盐度5时半滑舌鳎幼鱼仍可以正常的生长,这一结果与本研究相似[18]。半滑舌鳎幼鱼对淡水也具有一定的耐受能力。不过,本研究发现,尽管在淡水条件下半滑舌鳎幼鱼没有出现死亡现象,但其活力却显著降低。驯化至淡水的半滑舌鳎幼鱼出现了活动减少、对食物的敏感程度下降、易生病等不良反应,其生长也要显著低于其它盐度处理。而在盐度10和20时,半滑舌鳎幼鱼的生长率则显著高于天然海水(盐度30左右)。相比较,作为广盐性种类,大西洋鳕(Gadus morhua)[19]、金头鲷(Sparussarba)[20]和大菱鲆(Scophthalmusmaximus)[21]等的相关研究也得出了与本研究类似的结果。本研究表明,半滑舌鳎更适宜在10~20盐度范围内养殖,在此盐度范围内半滑舌鳎可能更利于其将更多的能量用于生长。
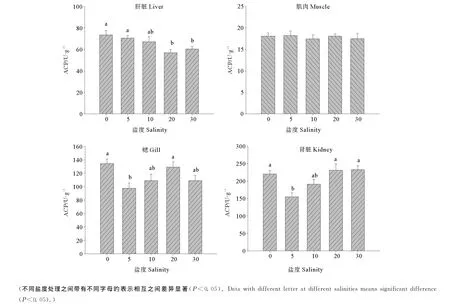
图4 不同盐度条件下半滑舌鳎幼鱼不同组织ACP活力Fig.4 Effect of salinities on the activities of ACP in different tissues of Tongue Sole(mean±SE)
3.2 不同盐度对半滑舌鳎幼鱼抗氧化酶活力的影响
超氧化物歧化酶(SOD)和过氧化氢酶(CAT)是机体内重要的抗氧化酶。其中,超氧化物歧化酶的功能是将机体内O-歧化成H2O2和O2,而过氧化氢酶可以将H2O2分解为H2O和O2。细胞内氧自由基过高,会对细胞内生物大分子如蛋白质、脂质、核酸等造成损伤,导致DNA分子突变,诱发细胞的衰老死亡,而SOD和CAT二者的协同作用,可以清除细胞内产生的过量的氧自由基,具有重要保护功能[22]。研究发现,环境条件的变动如水温、盐度、溶解氧等均可引起鱼体抗氧化酶活性的变化[23]。例如,赵峰等发现,施氏鲟(Acipenserschrenckiii)心脏、肝脏、脾脏和肌肉组织中的SOD和CAT活力会随着盐度的升高表现出不同的变化趋势[24]。而王晓杰等将许氏平鲉(Sebastesschlegeli)分别驯化至盐度5和10时,发现30d后其血液中SOD和CAT活力均出现了明显的升高[25]。Yin等的研究也发现银鲳幼鱼(Pampusargenteus)在用低盐度的海水处理后,其肾脏和肌肉中的SOD和CAT活力大幅度升高[26]。
本研究表明,长期的淡水胁迫对半滑舌鳎幼鱼肌肉中SOD和肝脏中CAT的活力具有显著的促进作用。其中,肝脏中CAT的活力要显著高于其它组织器官,这可能与肝脏细胞内富含过氧化物酶体,是参与体内H2O2清除代谢的主要器官有关。长期的淡水胁迫可能会使鱼体肝脏内产生大量的自由基,而CAT活力的大幅度提高则可以保护肝脏免受损伤。一般来讲,肌肉组织在清除活性氧自由基的过程中SOD通常会先发挥作用[27],因此在淡水条件下,肌肉中SOD活力大幅度升高。而肌肉中由SOD分解生成的H2O2可能会被最终运送至肝脏内分解。这样,肌肉中SOD和肝脏中CAT活力的提高可以帮助清除鱼体中因淡水胁迫而产生的自由基,进而避免机体遭受损伤[28-29]。本研究未在肌肉中检出CAT活力,表明肌肉中CAT含量可能较低。
鳃和肾脏是鱼体重要的渗透调节器官。本研究表明,在盐度5~30范围内鳃SOD活力随着盐度的升高逐渐升高,而肾脏在盐度5和10下则显著降低。这一结果与点带石斑鱼(Epinephelusmalabaricus)幼鱼的相关研究不尽相同。余燕等发现点带石斑鱼幼鱼肌肉和肾脏SOD活力在一定盐度范围内随盐度梯度下降呈上升趋势[30]。这说明由于种类存在的差异,不同鱼类抗氧化酶活性对盐度适应也存在较大的差异。通常,鱼类的鳃组织在渗透压调节过程中起到排出体内多余离子的作用,而肾脏则主要起到排除多余水分的作用,当鱼类由海水进入淡水后,适应于低渗环境的生理机制启动,肾脏的代谢压力会逐渐增大[31-32]。
3.3 不同盐度对半滑舌鳎幼鱼磷酸酶活力的影响
根据pH特性,磷酸酶有碱性磷酸酶和酸性磷酸酶之分。它们通过调节蛋白(酶)的去磷酸化过程,参与一些营养物质的消化、吸收、运输过程,同时也构成了生物体内重要的解毒体系[26]。本研究结果显示,在淡水至盐度20范围内,半滑舌鳎幼鱼肝脏、肌肉和肾脏中AKP活力也随盐度的升高而逐渐升高,而鳃中则以盐度5和10下为最高。与此比较,冯娟等对军曹鱼(RachycentroncanadumLinnaeus)在盐度5~37时血清中AKP活性的变化时则发现血清中的AKP活力随盐度的升高不断升高[34],而刘存岐、白秀娟等的研究则表明,海水中的金属离子含量的升高对于磷酸酶活性具有显著的促进作用[35-36],这些结果与本研究相似。推测可能在一定盐度范围内,盐离子浓度的增加对于半滑舌鳎部分组织AKP活力可能具有一定的促进作用。在淡水条件下,半滑舌鳎肝脏中的ACP活力始终处于较高的水平,显著高于对照盐度30下水平,但肌肉、鳃和肾脏中ACP活力水平与对照盐度30下水平差异不大,表明淡水驯化对于上述3个组织中ACP活力影响不大。一般来讲,淡水组中肝脏ACP活力较高,一方面可能在于由于幼鱼受到长期胁迫肝脏增强代谢提高机体能量供应有关,另一方面,鱼类ACP一般在机体感染初期的非特异性免疫保护中起重要作用[37],可能长期的淡水胁迫导致鱼体免疫力降低,导致机体应对病原菌入侵而产生相应的反应。值得注意的是,与其它盐度比较,作为渗透调节器官,半滑舌鳎鳃和肾脏组织在盐度5下呈现出了较低的ACP活力,与其SOD活力反应相似,这一现象目前尚难以解释,其中的机制尚需进一步研究。
3.4 关于半滑舌鳎幼鱼对不同盐度的适应性
本研究结果表明,半滑舌鳎幼鱼对于低盐度具有很强的适应能力,生产中可适当的降低海水的盐度以促进半滑舌鳎的生长,其最适的生长盐度范围可能在10~20之间。盐度对于半滑舌鳎幼鱼不同组织非特异性免疫酶的影响存在明显的组织特异性,这可能与半滑舌鳎幼鱼不同器官组织生理功能的不同有关。例如,肝脏作为鱼体重要的代谢器官,主要参与鱼体的生长及能量代谢。可以看出,肝脏内SOD在盐度20时活力最高,可能与盐度20时肝脏生长及合成代谢最为旺盛有关。代谢旺盛的鱼类肝脏可以储存和合成大量的脂肪,而脂肪酸的氧化则会导致自由基的生成[38-40]。肝脏中AKP的活力也在盐度20时活力最高,这可能与AKP参与肝脏中营养物质的消化运输有关。总体上看,在盐度5以上时半滑舌鳎幼鱼的非特异性免疫能力与对照相比基本维持在正常的水平,而淡水条件下半滑舌鳎的多项生理指标则出现了异常,表明淡水条件对半滑舌鳎幼鱼可能产生了较强的胁迫作用,影响了其正常的生理过程,进而对其生长产生了负面影响。本研究过程中也观察到,淡水组半滑舌鳎幼鱼活动减少,对食物的敏感程度下降,生长速度显著下降。不过,通常个体较大的鱼对盐度的适应能力会较强[41],鉴于本研究使用的鱼规格较小,因此今后还需要采用较大规格的半滑舌鳎进行相关试验,以进一步确认不同规格的半滑舌鳎对盐度的适应能力。
[1]Resley M J,Webb K A Jr,Holt G J.Growth and survival of juvenile cobia,Rachycentroncanadum,at different salinities in a recirculating aquaculture system [J].Aquaculture,2006,253:398-407.
[2]Imsland A K,G stavsson A,Gunnarsson S,et a1.Effects of reduced salinities on growth,feed conversion efficiency and blood physiology of juvenile Atlantic halibutHippoglossushippoglossus L[J].Aquaculture,2008,274:254-259.
[3]Helene R,Grerard B.Fish blood parameters as a potential tool for identification of stress caused by environmental factors and chemical intoxication[J].Marine Environ Res,1996,41(1):27-43.
[4]胡利华,闫茂仓,郑金和,等.盐度对日本鳗鲡生长及非特异性免疫酶活性的影响 [J].台湾海峡,2011,4(5):528-532.
[5]强俊,任洪涛,徐跑,等.温度与盐度对吉富品系尼罗罗非鱼幼鱼生长和肝脏抗氧化酶活力的协同影响 [J].应用生态学报,2012,23(1):255-263.
[6]Evans D H,Piermarini P M,Choe K.The multifunctional fish gill:dominant site of gas exchange,osmoregulation,acid-base regulation,and excretion of nitrogenous waste[J].Physiological Reviews,2005,85:97-177.
[7]Febry R,Lutz P.Energy Partitioning in Fish:The Activity related Cost of Osmoregulation in a Euryhaline Cichlid[J].Journal of Experimental Biology,1987,128:63-65.
[8]Gilles B,Patrick P.How should salinity influence fish growth?[J].Comp Biochem Physiol C,2001,130:411-423.
[9]Atwood H L,Young S P,Tomasso J R,et al.Resistance of cobia,Rachycentroncanadum,juveniles to low salinity,low temperature,and high environmental nutrition concentrations[J].Appl Aquac,2004,15:191-195.
[10]Winston G W,Digiulio R T.Prooxidant and antioxidant mechanisms in aquatic organisms [J].Aquat Toxicol,1991,19(2):137-161.
[11]温海深.水产动物生理学 [M].青岛:中国海洋大学出版社,2009:250-284.
[12]林浩然.鱼类生理学 [M].广州:广东教育出版社,1999:109-145.
[13]Miyazk H,Kaneke T,Hasegawa S,et al.Development changes in drinking rate and ion and water permeability during early stage of euryhaline,Oreochromismossambicus,reared in fresh water and sea water[J].Fish Physiol Biochem,1988,18(3):277-284.
[14]Fang J H,Tian X L,Dong S L.The influence of water temperature and ration on the growth,body composition and energy budget of tongue soleCynoglossussemilaevis[J].Aquaculture,2010,299:106-114.
[15]牛化欣,常杰,马甡,等.半滑舌鳎生物学及养殖生态学研究进展 [J].水产科学,2007,26(7):1003-1111.
[16]田相利,王国栋,董双林,等.盐度和温度对半滑舌鳎生长、渗透生理及能量收支的影响 [J].中国水产科学,2010,17(4):771-778.
[17]田相利,任晓伟,董双林,等.温度和盐度对半滑舌鳎幼鱼消化酶活性的影响 [J].中国海洋大学学报:自然科学版,2008,38(6):895-901.
[18]张志勇,张曹进,张志伟,等.半滑舌鳎苗种对温度和盐度耐受性试验 [J].水产养殖,2008(3):20-21.
[19]Lambert Y,Dutil J D,Munro J.Effects of intermediate and low salinity conditions on growth rate and food conversion of Atlantic codGadusmorhua[J].Fish Aquat Sci,1994,51:1569-1576.
[20]Woo N Y S,Kelly S P.Effects of salinity and nutritional status on growth and metabolism ofSparussarbain a closed seawater system [J].Aquaculture,1995,135:229-238.
[21]Imsland A K,Foss A,Gunnarsson S,et al.The interaction of temperature and salinity on growth and food conversion in juvenile turbotScophthalmusmaximus[J].Aquaculture,2001,198:353-367.
[22]Livingstone D R.Contaminant-stimulated reactive oxygen species production and oxidative damage in aquatic organisms[J].Mari Pollut Bull,2001,42(8):656-666.
[23]Viarengo A,Canesi L,Pertica M,et al.Seasonal variations in the antioxidant defense systems and lipid peroxidation of the digestive gland of mussels [J].Comp Biochem Physio1,1991,100C:187-190.
[24]赵峰,庄平,章龙珍,等.施氏鲟不同组织抗氧化酶对水体盐度升高的响应 [J].海洋水产研究,2008,25(5):65-69.
[25]王晓杰,张秀梅,李文涛.盐度胁迫对许氏平鲇血液免疫酶活力的影响 [J].海洋水产研究,2005,26(6):17-21.
[26]Yin F,Peng S M,Sun P,et al.Effects of low salinity on antioxidant enzymes activities in kidney and muscle of juvenile silver pomfretPampusargenteus[J].Acta Ecologica Sinica,2011,31:55-60.
[27]张克烽,张子平,陈芸,等.动物抗氧化系统中主要抗氧化酶基因的研究进展 [J].动物学杂志,2007,42(2):153-160.
[28]Andersen F,Lygren B,Maage A,et al.Interaction between two dietary levels of iron and two forms of ascorbic acid and the effect on growth,antioxidant status and some non-specific immune parameters in Atlantic salmon(Salmosalar)smolts[J].Aquaculture,1998,161(1-4):437-451.
[29]Ross S W,Dalton D A,Kramer S,et al.Physiological(antioxidant)responses of estuarine fishes to variability in dissolved oxygen[J].Comp Biochem Physiol C,2001,130(3):289-303.
[30]余燕,徐维娜,刘兆普,等.低盐度胁迫对点带石斑鱼幼鱼消化酶、抗应激酶和存活率的影响 [J].渔业科学进展,2001(4):21-66.
[31]Brett J R.Environmental factors and growth[M]//Hoar W S,Randall J R,Breet J R.Fish Physiology Vol 8Bioenergetics and Growth.New York:Academic Press,1979:599-675.
[32]Holmes W N,Donaldson F M.The Body Compartments and the Distribution of Electrolytes[M]//Hoar W S,Randall D J.Fish Physiology Vol 1Excretion,Ionic Regulation,and Metabolism.New York:Academic Press,1969:1-89.
[33]何海琪,孙凤.中国对虾酸性和碱性磷酸酶的特性研究 [J].海洋与湖沼,2001,23(5):555-560.
[34]冯娟,徐力文,林黑着,等.盐度变化对军曹鱼稚鱼相关免疫因子及其生长的影响 [J].中国水产科学,2007,14(1):120-125.
[35]刘存岐,王安利,王维娜,等.海水中几种金属离子对中国对虾幼体体内碱性磷酸酶和ATPase的影响[J].水产学报,2001,25(4):298-303.
[36]白秀娟,卢伙胜,唐峰华.Cu2+、Zn2+和Cd2+对茂名海域文昌鱼酸、碱性磷酸酶的影响 [J].水产科学,2009,28(9):513-517.
[37]Sunyer J O,Tort L.Natural hemolytic and bactericidal activities of seabreamSparusaurataserum are effected by the alternative complement pathway[J].Veterinary Immunology and Immunopathology,1995,45:333-345.
[38]De Kok T,Vaarwerk F T,Zwingman I,et al.Peroxidation of linoleic,arachidonic and oleic acid in relation to the induction of oxidative DNA damage and cytogenetic effects[J].Carcinogenesis,1994,15:1399-1404.
[39]Fang X,Watanabe Y,Adachi S,et al.Microencapsulation of linoleic acid with low-and high-molecular-weight components of soluble soybean polysaccharide and its oxidation process[J].Biosci Biotech Bioch,2003,67(9):1864-1869.
[40]Garcia G M,Sanz A,Domezain A,et al.Age-size influences on tissue-lipid quality of the sturgeonAcipensernaccariifrom intensive culture[J].J App Ichthyol,1999,15:261-264.
[41]Altinok I,Galli S M,Chapman F A.Ionic and osmotic regulation capabilities of juvenile Gulf of Mexico sturgeon,Acipenseroxyriinchusdesotoi[J].Comp Biochem Physiol A,1998,120(4):609-616.
