牦牛β-防御素5基因的原核表达及表达产物的抑菌活性
2014-03-26熊显荣兰道亮
符 梅,熊显荣,兰道亮,李 键
(西南民族大学 生命科学与技术学院,动物遗传育种重点实验室,四川 成都 610041)
牦牛生活在青藏高原3 000~5 000 m海拔的高寒地带,是高原地区牧民的主要经济来源,其对低温、低氧、低压的高原环境有较强的适应能力,能充分利用其他家畜难以利用的高山草原环境[1]。良好的高原生态环境保障了牦牛奶天然、绿色的品质,纯净的奶源环境造就了绿色的牦牛奶。哺乳类动物防御素是一类广泛存在于哺乳类动物体中的内源性抗微生物肽,在宿主天然免疫过程中发挥着重要的作用,当机体受外源病原体入侵时,可以激活机体的第一道防御屏障,启动机体先天性免疫反应和获得性免疫反应。防御素除具有广谱的抗细菌活性外,还对真菌、病毒等具有一定的抗性,且与一些传统抗生素等具有协同抗微生物的作用。因其对机体无毒副作用,所以研究哺乳类动物防御素在体内、外的抗菌作用及其机理具有重要意义。防御素(Defensin)最早是由美国科学家Lehrer等[2]于1993年发现并命名的,并从人的嗜中性白细胞中分离纯化得到3种阳离子小肽,发现其具有特殊的生物学活性及功能。依据其半胱氨酸残基位置及二硫键连接方式的不同,防御素可分为α、β和θ 3大类[3]。β-防御素(β-defensins)是肽抗生素中较为重要的一种,是具有广谱抗菌活性的多功能肽,其抗菌谱包括革兰氏阴性、阳性菌,病毒和真菌[4-5]。 Diamond等[6]于1991年首次在牛的气管黏膜上皮细胞中发现β-防御素,并将其命名为TAP,之后又在牛的舌黏膜上皮中发现了舌抗菌肽LAP。1993年,Selsted等[7]从牛的中性粒细胞中分离了13种β-防御素(BNBD1~BNBD13)。研究表明,TAP、LAP、BNBD1~BNBD13等β-防御素对金黄色葡萄球菌、大肠杆菌、克雷伯肺炎杆菌、绿脓杆菌和念珠菌属等乳房炎病原菌有抗菌活性[8]。Goldammer等[9]研究发现,在患乳房炎奶牛的乳腺组织中,β-防御素5的表达量是平时的4~13倍;原位杂交显示,病原微生物可诱导局部感染区的乳腺上皮细胞内的β-防御素5的表达上升,进一步证明β-防御素5在奶牛乳房炎的发生、预防过程中具有重要作用[10]。到目前为止,尚未见到关于牦牛β-防御素5方面的报道。本研究构建了牦牛β-防御素5(BNBD5)基因的原核表达载体pET32-BNBD5,诱导BNBD5融合蛋白在大肠杆菌中表达,并对其表达产物的抗菌生物活性进行评价,以期为防御素替代抗生素成为新型的抗菌药物提供理论基础。
1 材料与方法
1.1 材 料
大肠杆菌DH5α和BL21(DE3)购自天根(北京)公司。金黄色葡萄球菌(S.aureus)、大肠杆菌(E.coli)由西南民族大学动物遗传育种重点实验室保存。pMD19-T克隆载体购自TaKaRa(大连)公司,pET-32a(+)表达载体购自Novagen公司。RNA提取Trizol试剂盒购自Invitrogen公司,凝胶回收试剂盒购自Axygen(北京)公司,反转录试剂盒购自Promega公司。IPTG购自天根(北京)公司,HisTrapTMFF蛋白纯化柱购自GE公司,限制性内切酶BamHⅠ、XhoⅠ和T4 DNA ligase连接酶均购自NEB公司,其他试剂均为国产分析纯。
1.2 PCR扩增引物的设计与合成
根据NCBI已公布的黄牛BNBD5基因序列(登录号:AJ278799),利用Primer 5设计1对引物P1/P2。上游引物P1:5′-CGGGATCCGGATTTACTCAAGTAGTAAGAAATC-3′,下游引物P2:5′-CCCTCGAGTTACCACCTCCTGCAGCAT-3′,分别在上、下游引物5′端添加BamHⅠ和XhoⅠ的酶切位点(划线部分),并在其前端添加保护性碱基。引物由Invitrogen(上海)公司合成。
1.3 BNBD5基因的克隆与序列分析
取牦牛肺组织100 mg,加入1 mL Trizol液氮研磨提取总RNA,按照Promega试剂盒反转录获得cDNA。以牦牛肺组织的cDNA为模板,PCR扩增BNBD5基因,扩增体系为:ExTaq12.5 μL,上下游引物(10 μmol/L)各1 μL,模板(1 500 ng/μL)1 μL,双蒸水补足25 μL。PCR反应程序为:94 ℃预变性5 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸25 s,35个循环;最后72 ℃再延伸5 min。取6 μL扩增产物在15 g/L琼脂糖凝胶中进行初步电泳鉴定。胶回收产物与pMD19-T载体连接,经PCR鉴定后,将阳性重组质粒pMD19-BNBD5送Invitrogen(上海)公司进行测序。用MEGA5.0软件将牦牛BNBD5基因序列与其他动物β-防御素5的mRNA序列进行比较,构建系统进化树。
1.4 BNBD5基因原核表达载体的构建
将重组质粒pMD19-BNBD5与原核表达载体pET-32a(+)分别用限制性内切酶BamHⅠ和XhoⅠ进行双酶切,将牦牛BNBD5基因亚克隆到原核表达载体pET-32a(+)上,构建重组表达载体pET32-BNBD5,用其转化DH5α,挑选克隆进行菌液PCR鉴定,并提取重组表达载体进行BamHⅠ和XhoⅠ双酶切鉴定,将阳性质粒送Invitrogen (上海)公司测序。
1.5 重组牦牛BNBD5蛋白的诱导表达
将阳性重组质粒pET32-BNBD5转化大肠杆菌BL21(DE3),挑取单个菌落接种于含有100 μg/mL氨苄青霉素(Amp)的5 mL LB 培养基中,37 ℃、200 r/min过夜培养,次日取培养物按照1∶100(体积比)的比例接种于50 mL含有Amp(100 μg/mL)的LB培养基中,于37 ℃、200 r/min 进一步扩大培养。当菌液OD600=0.6时,加入0.5 mmol/L的IPTG诱导表达,于诱导不同时间(0,1,2,3,4,5,6 h)各取2 mL菌样,8 000 r/min离心5 min,收集沉淀,加入50 μL PBS (pH=7.4)和50 μL 2×SDS凝胶上样缓冲液,煮沸10 min,然后进行SDS-PAGE电泳(5%的浓缩胶,15%的分离胶)。
1.6 重组牦牛BNBD5蛋白的纯化
取10 mL含目的蛋白的菌液接种到1 L LB培养基中,37 ℃、200 r/min振荡6 h,4 ℃、8 000 r/min 离心10 min收集菌体,加入磷酸盐缓冲液重悬,超声破碎(200 W,超声6 s,停9 s,直到样品澄清)后4 ℃、12 000 r/min离心10 min,分别收集上清和沉淀。沉淀用体积分数1%Triton和2 mol/L的尿素各洗2次,4 ℃、12 000 r/min离心10 min收集沉淀,然后用8 mol/L尿素溶解沉淀(1 g湿质量加入10 mL尿素),4 ℃过夜,12 000 r/min离心20 min,收集上清用0.45 μm滤膜过滤,然后用HisTrapTMFF纯化柱纯化蛋白,并对纯化蛋白进行SDS-PAGE分析。将纯化后的蛋白放入透析袋,然后将透析袋依次放入含6,4,2,1 mol/L尿素的复性液中于4 ℃各透析2 h,最后将透析袋置于不含尿素的磷酸盐缓冲液中4 ℃透析过夜,使蛋白质在此过程中复性。
1.7 重组牦牛BNBD5蛋白体外抑菌活性的检测
参照文献[11-12]的Bradford 法检测纯化的重组蛋白的浓度。根据前人对牛防御素的最小抑菌试验[11-12],采用琼脂扩散法,分别取对数生长期的大肠杆菌和金黄色葡萄球菌(各5×106CFU) 涂LB平板,将经高压灭菌过的滤纸片蘸取0.08和0.10 mg/mL 纯化后的重组蛋白溶液,置于倒好的无抗生素的LB固体平板上,同时设氨苄青霉素为阳性对照,纯化的pET-32a(+)空载蛋白为阴性对照,于37 ℃培养过夜,观测以滤纸片为中心的抑菌圈直径。
2 结果与分析
2.1 牦牛β-防御素5基因的克隆与序列分析
本研究根据GenBank 上提交的黄牛BNBD5的基因序列,利用RT-PCR从牦牛肺组织中扩增得到约138 bp 的牦牛BNBD5基因片段(图1),与目的基因片段长度相符,编码45个氨基酸残基(图2),并且含有防御素的特征性分子结构,即在特定位置上有6个保守的半胱氨酸残基,分别在分子内形成Cys1-Cys5、Cys2-Cys4 和Cys3-Cys6共3对二硫键。同源性分析表明,牦牛BNBD5基因与黄牛BNBD5同源性最高,达86.2%,与其他物种BNBD5的同源性为21.0%~79.7%(表1)。牦牛BNBD5基因的系统进化分析结果见图3。
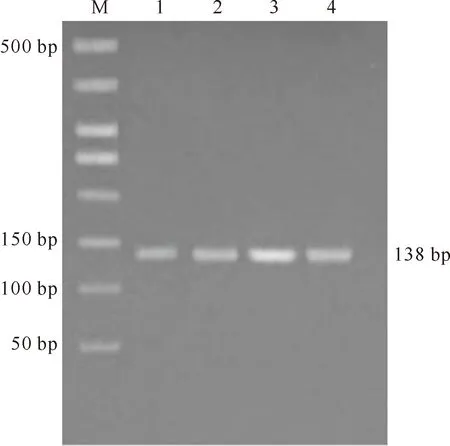
图1 牦牛β-防御素5基因的PCR扩增
2.2 牦牛BNBD5基因原核表达载体的构建
重组质粒pET32-BNBD5 经PCR检测,获得了138 bp的目的片段,BamHⅠ和XhoⅠ双酶切后也得到138 bp的片段(图4),证明外源基因片段已成功插入到质粒中。
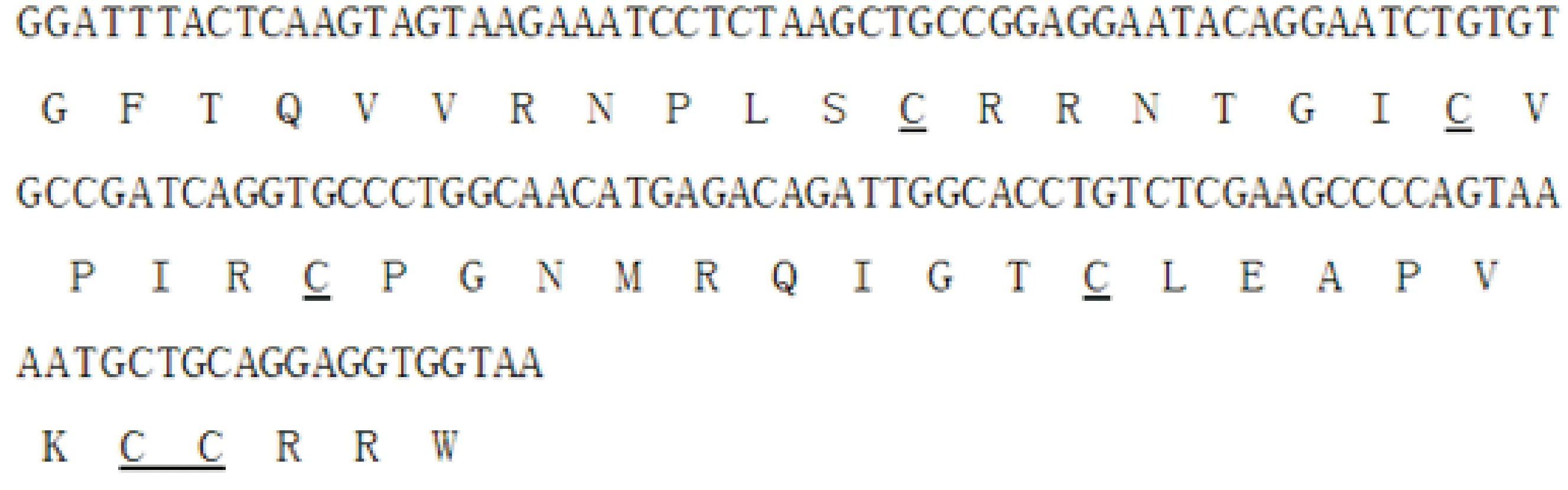
图2 牦牛BNBD5基因序列及其编码的氨基酸序列下划线标示保守的半胱氨酸
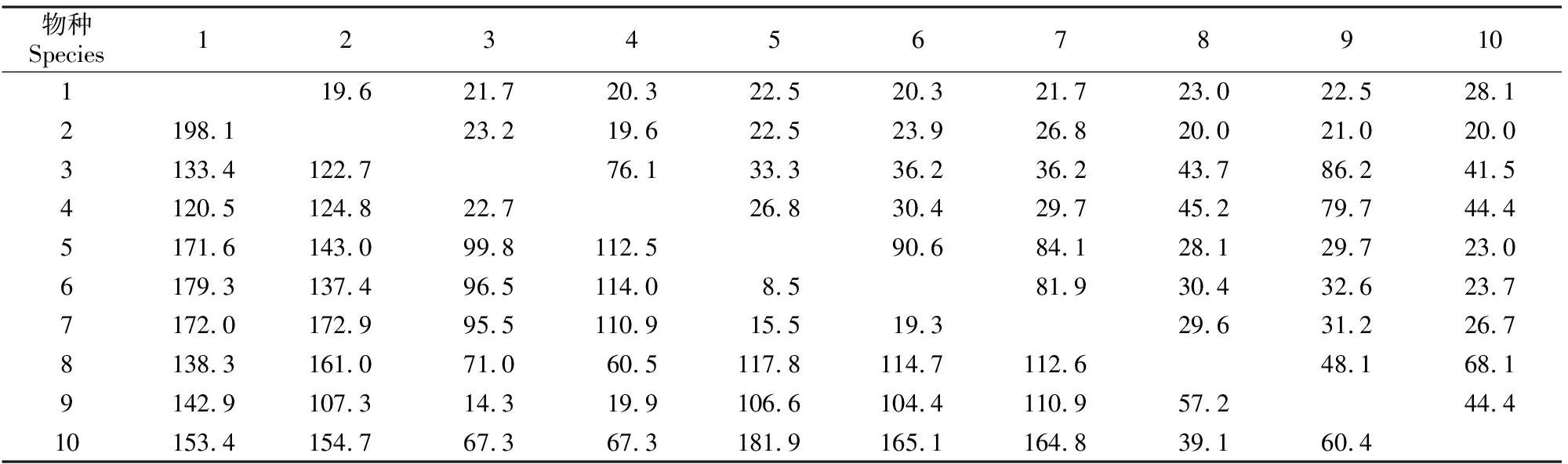
表1 β-防御素5基因核酸序列的同源性比较
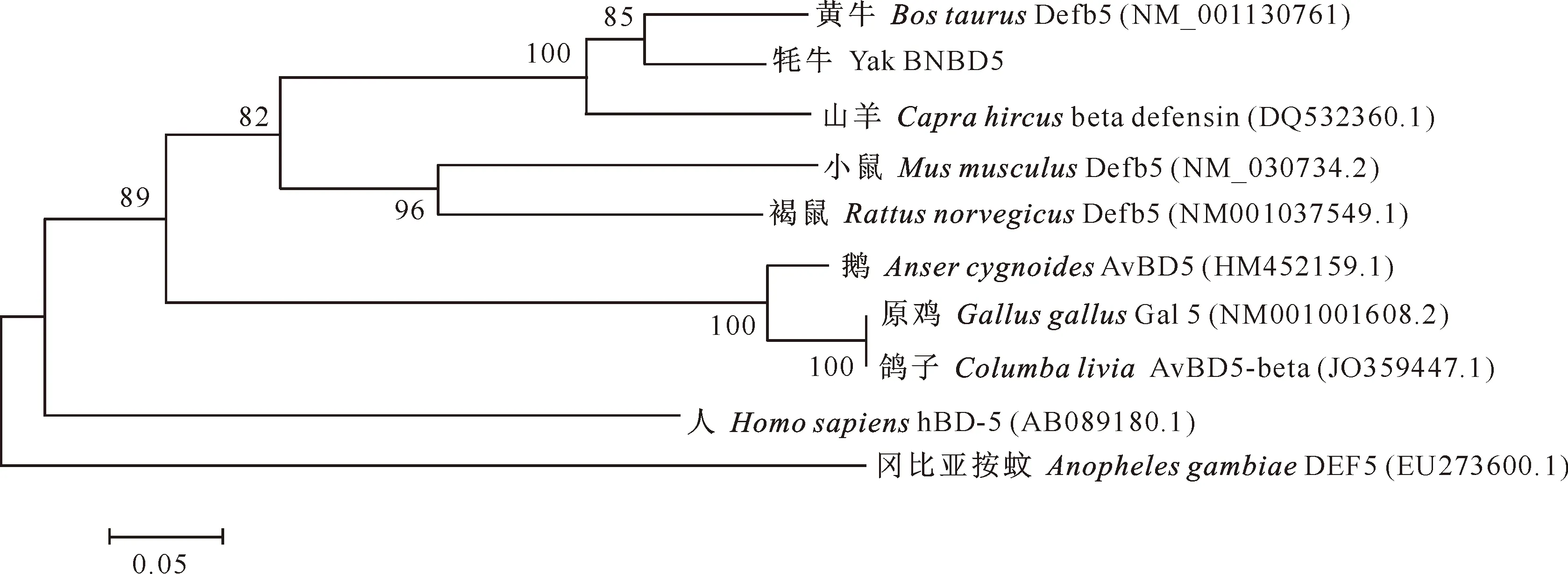
图3 牦牛与其他物种BNBD5基因的系统进化树
2.3 牦牛BNBD5重组蛋白的表达及纯化
SDS-PAGE电泳结果(图5)表明,与诱导前的菌体相比,诱导后的菌体有1条明显的特异性条带,与预期大小25 ku相符合,诱导后,表达量明显增加。BNBD5重组蛋白主要以包涵体的形式存在,上清中蛋白因浓度太低几乎检测不到,BNBD5蛋白经亲和层析纯化后可得到比较纯的融合蛋白(图6)。
2.4 pET32-BNBD5融合蛋白的抑菌活性
将纯化后的BNBD5基因成熟肽融合蛋白进行体外抑菌试验,结果(图7)显示,BNBD5基因成熟肽融合蛋白对革兰氏阴性菌(E.coil)具有较强的抑菌活性。当其质量浓度为0.08 mg/mL时,抑菌圈直径为7.21 mm;当其质量浓度达到0.10 mg/mL时,可看到明显的抑菌效果,抑菌圈直径为7.62 mm;但抑菌圈都小于氨苄青霉素(13.5 mm),而纯化的空载蛋白无抑菌圈。BNBD5基因成熟肽融合蛋白对革兰氏阳性菌(S.aureus)也有较强的抑菌活性。当其质量浓度为0.08 mg/mL时可以观察到抑菌圈,抑菌圈直径为5.61 mm;当其质量浓度为 0.10 mg/mL 时抑菌效果较明显,抑菌圈直径为 6.73 mm;但氨苄青霉素的抑菌圈(12.7 mm)更大,纯化的空载蛋白亦无抑菌圈。
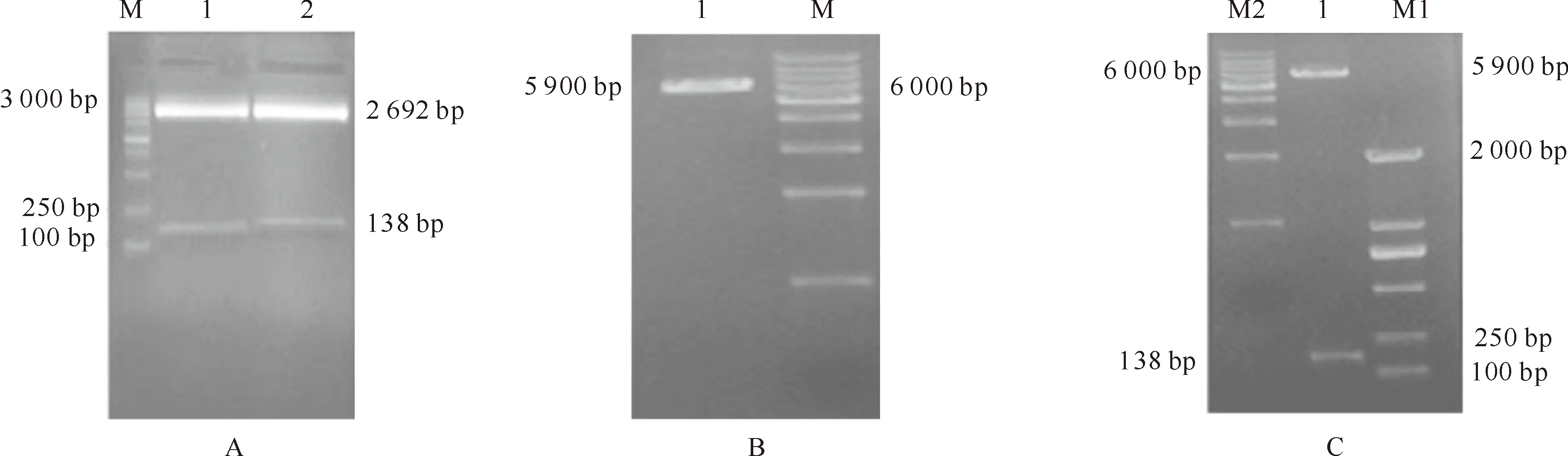
图4 重组质粒pET32-BNBD5的BamHⅠ和XhoⅠ双酶切分析
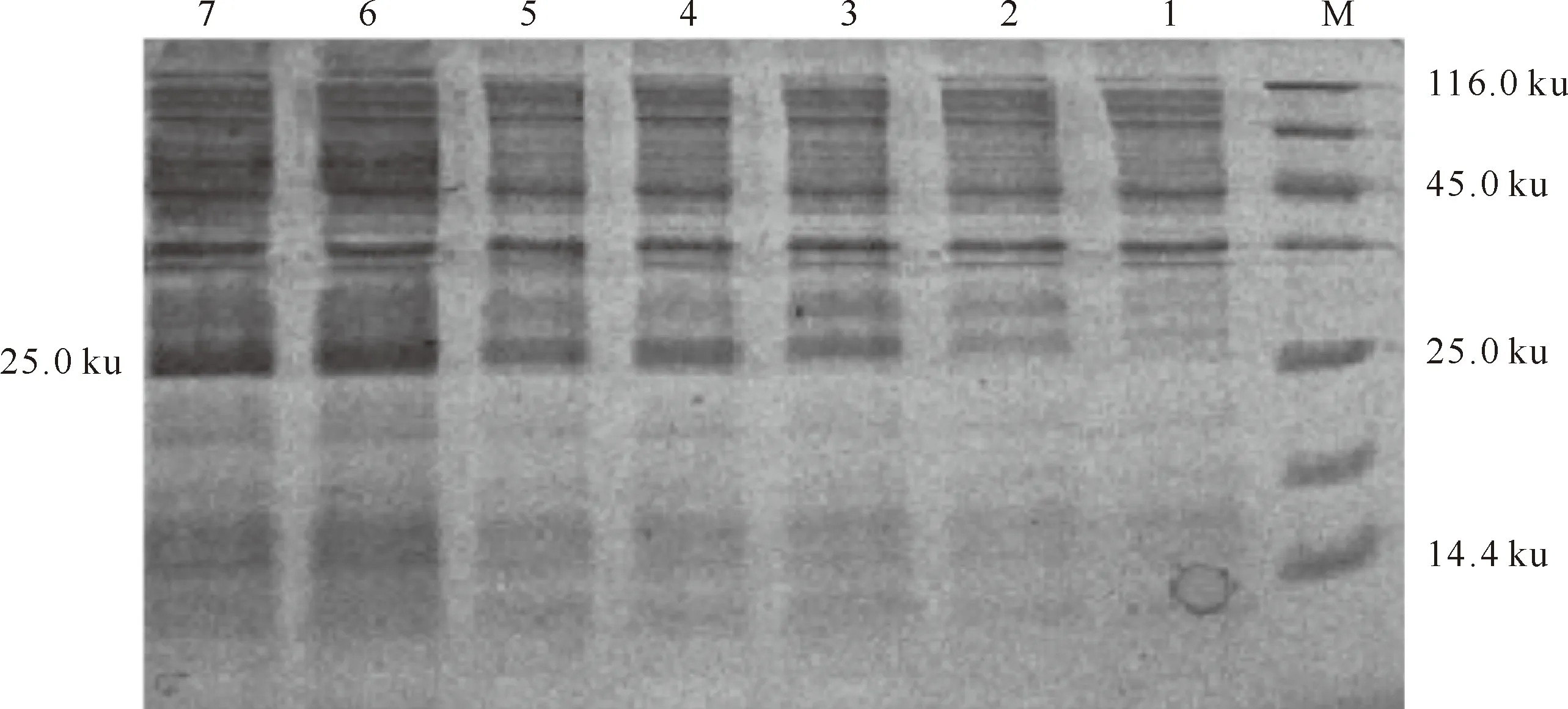
图5 牦牛BNBD5融合蛋白表达的SDS-PAGE分析

图6 融合蛋白BNBD5表达形式的鉴定及纯化蛋白的SDS-PAGE

图7 重组牦牛BNBD5蛋白抑菌活性的检测
3 讨 论
防御素是一种具有代表性的内源抗菌肽,其广泛表达于哺乳动物的组织细胞中。大量研究表明,无论是重组表达还是人工合成的防御素,对细菌、真菌,甚至一些被膜病毒[13]都有很强的杀伤力,且无毒副作用,不会使病原微生物产生耐药性[14-16]。但动物体内天然防御素较少,分离成本较高,使得防御素的利用受到限制,因此通过基因工程手段在体外获得3~5 ku的防御素分子[17-19],可在一定程度上扩大其利用范围,但如何提高表达水平及表达产物的稳定性,使合成的防御素有更好的杀菌活力及更广谱的杀菌效果还需深入研究。
本研究根据已发表的黄牛BNBD5(AJ278799)基因序列,设计特异性引物,利用RT-PCR方法从牦牛肺组织中克隆了牦牛BNBD5基因成熟肽编码区。经测序分析,该成熟肽编码区大小为138 bp,编码45个氨基酸残基,内含6个位置保守的半胱氨酸残基,分别在分子内形成Cys1-Cys5、Cys2-Cys4 和Cys3-Cys6 3对二硫键,这是β-防御素的基本结构单元[20-21]。将该基因成熟肽序列与其他物种的BNBD5成熟肽序列进行同源性分析发现,该基因与黄牛BNBD5的同源性最高,可达86.2%。从遗传进化树可知,哺乳类动物和禽类都存在β-防御素,但他们的同源性都比较低。针对这一现象,很多学者用达尔文进化论来解释[22-23],认为不同物种感染的病原体有可能不同,为了抵御外源病原体,一些基因就会发生有利于自身的突变,从而导致防御素在物种间的同源性较低。
大肠杆菌原核表达系统是目前常用的表达系统之一,以其表达的融合蛋白多以包涵体的形式存在,这样既能保护目的蛋白不被蛋白酶降解,又能提高重组蛋白的产量及稳定性,且不会影响目标蛋白的功能及活性[24-25]。本试验采用His组氨酸标签融合表达系统进行牦牛BNBD5的原核表达,用GE公司的HisTrapTMFF纯化柱纯化蛋白,在包涵体的溶解、复性及透析过程中加入2 mmol的β-巯基乙醇有助于二硫键的正确折叠,从而使纯化的目的蛋白有活性。防御素的抗菌机理非常复杂,他们对微生物作用的活性与特异性主要取决于他们的理化性质,例如阳离子净电荷和疏水性质、β-防御素结构、低聚反应、蛋白水解稳定性等。目前对于防御素的抗菌机制并没有统一的说法,普遍被大家接受的说法是胞膜攻击作用,即抗菌肽作用于细菌的细胞膜,破坏膜的完整性使离子通透性失衡,细胞内容物大量渗出而导致细胞死亡[26]。本研究制备的重组牦牛BNBD5融合蛋白对革兰氏阳性菌及革兰氏阴性菌都具有抑菌活性;空载体纯化的蛋白不具有抑菌活性,不影响重组蛋白的活性,这与前人的研究结果[27-28]一致。但由于本试验都只选了1种革兰氏阳性菌和革兰氏阴性菌进行抑菌活性研究,因此不能说明纯化的重组蛋白对其他细菌的抑菌活性,这是本研究的不足之处。
本试验克隆的牦牛BNBD5成熟肽在BL21中得到了高效表达,且纯化的蛋白对革兰氏阳性菌和革兰氏阴性菌有很强的抗性,可为防御素代替抗生素成为新型的抗菌药物提供理论依据,但有关牦牛防御素的抗菌作用机制等还有待进一步研究。
[参考文献]
[1] 熊显荣,高 川,符 梅,等. 供体细胞来源和TSA处理对牦牛iSCNT胚胎重编程的影响 [J].西北农林科技大学学报:自然科学版,2012,40(10):9-13.
Xiong X R,Gao C,Fu M,et al.Effects of donor cell and TSA treatment on reprogramming of yak-bovine iSCNT embryos [J].Journal of Northwest A&F University:Nat Sci Ed,2012,40(10):9-13.(in Chinese)
[2] Lehrer R L,Lichtenstein A K,Ganz T.Defensins:Antimicrobial and cytotoxic peptides of mammalian cells [J].Annu Rev Immunol,1993,11:105-128.
[3] Luenser K,Ludwig A.Variability and evolution of bovine β defensin genes [J].Genes Immun,2005,6(2):115-122.
[4] Yang D,Chertov O,Bykovskaia S,et al.β-defensins:Linking in-nate and adaptive immunity through dendritic and T cell CCR6 [J].Science,1999,286:525-528.
[5] Garcta R C,Krause A,Schulz S,et al.Human β-defensin 4:A novel inducible peptide with a specific salt-sensitive spectrum of antimicrobial activity [J].FASEB J,2001,15(10):1819-1821.
[6] Diamond G,Zasloff M,Eck H,et al.Tracheal antimicrobial pe-ptide,a cysteinerich peptide from mammalian tracheal mucosa:Peptide isolation and cloning of a cDNA [J].Proc Natl Acad Sci USA,1991,88(9):3952-3956.
[7] Selsted M E,Tang Y Q,Morris W L,et al.Purification,primary structures and antibacterial activities of β-defensins,a new family of antimicrobial peptides from bovine neutrophils [J].J Biol Chem,1993,268(9):6641-6648.
[8] Roosen S,Exner K,Paul S,et al.Bovine β-defensins:Identification and characterization of novel bovine β-defensin genes and their expression in mammary gland tissue [J].Mamm Genome,2004,15(10):834-842.
[9] Goldammer T,Zerbe H,Molenaar A,et al.Mastitis increase mammary mRNA abundance of β-defensin 5,toll-like-receptor 2(TLR2) and TLR4 but not TLR9 in cattle [J].Clin Diagn Lab Immunol,2004,11(1):174-185.
[10] Yang W,Molenaar A,Kurts-Ebert B,et al.NF-kappaB factors are essential,but not the switch,for pathogen-related induction of the bovine beta-defensin 5 encoding gene in mammary epithelial cells [J].Mol Immunol,2006,43(3):210-225.
[11] 赵建乐.牛β-防御素BNBD11在大肠杆菌中的表达及抑菌活性鉴定 [D].陕西杨凌:西北农林科技大学,2011.
Zhao J L.Expression of bovine neutrophil β-defensin 11 inEscherichiacoliand its antibacterial activity analysis [D].Yangling,Shaanxi:Northwest A&F University,2011.(in Chinese)
[12] 苏 健.猪β-防御素1基因在大肠杆菌中的表达与活性鉴定 [D].哈尔滨:东北农业大学,2012.
Su J.Expression and activity identification of porcine β-defensin-1 gene inE.coli[D].Harbin:Northeast Agricultural University,2012.(in Chinese)
[13] 王静华,李有志,汪以真.哺乳动物体内的防御素 [J].中国兽医杂志,2004,40(1):45-46.
Wang J H,Li Y Z,Wang Y Z.Defense in the body of mammalian [J].Chinese Journal Veterinary Medicine,2004,40(1):45-46.(in Chinese)
[14] Buck C B,Day P M,Thompson C D,et al.Human alpha-defensins block papilloma virus infection [J].Proc Natl Acad Sci USA,2006,103(5):1516-1521.
[15] 张可心,蔺利娟,马得莹,等.鸭β-防御素5 基因的分离、鉴定及其生物学作用 [J].微生物学通报,2011,38(11):1688-1697.
Zhang K X,Lin L J,Ma D Y,et al.Isolation,characterization,and determination on bioactivity of duck avian beta-defensin 5 [J].Microbiol China,2011,38(11):1688-1697.(in Chinese)
[16] 周财源,蔺利娟,马得莹,等.鹅β-防御素5 基因克隆与生物学特性的初步分析 [J].畜牧兽医学报,2011,42(8):1193-1200.
Zhou C Y,Lin L J,Ma D Y,et al.Cloning and initial characterization of goose avian β-defensin [J].Acta Vet Zootech Sin,2011,42(8):1193-1200.(in Chinese)
[17] Wang Z,Wang G S.APD:The antimicrobial peptide database [J].Nucleic Acids Res,2004,32:590-592.
[18] Yeaman M R,Yount N Y.Mechanisms of antimicrobial peptide action and resistance [J].Pharmacol Rev,2003,55(1):27-55.
[19] Bals R.Epithelial antimicrobial peptides in host defense again-st infection [J].Respir Res,2010,1(3):141-150.
[20] Kawaguchi A,Suzuki T,Kimura T,et al.Functional analysis of an alpha-helical antimicrobial peptide derived from a novel mouse defensin-like gene [J].Biochem Biophys Res Commun,2010,398(4):778-784.
[21] van Dijk A,Veldhuizen E J,Haagsman H P.Avian defensins [J].Vet Immunol Immunopathol,2008,124(1/2):1-18.
[22] Higgs R,Lynn D J,Gaines S,et al.The synthetic form of a novel chicken β-defensin identified in silico is predominantly active against intestinal pathogens [J].Immunogenetics,2005,57(1/2):90-98.
[23] Ganz T.Defensins and other antimicrobial peptides:A historical perspective and an update [J].Comb Chen High Throughput Screen,2005,8:209-217.
[24] Ma D Y,Wang R Q,Liao W Y,et al.Identification and characterization of a novel antibacterial peptide,avian β-defensin 2 from ducks [J].J Microbiol,2009,47(5):610-618.
[25] Ma D Y,Liao W Y,Wang R Q,et al.Two novel duck antibacterial peptides,avian β-defensins 9 and 10,with antimicrobial activity [J].J Microbiol Biotechnol,2009,19(11):1447-1455.
[26] Dekker N,Cox R C,Kramer R A,et al.Substrate specificity of the integral membrane protease OmP determined by spatially addressed peptide librarie [J].Bioehemistry,2001,40(6):1694-1701.
[27] Wu J,Wang C,He H,et al.Molecular analysis and recombinant expression of bovine neutrophil β-defensin 12 and its antimicrobial activity [J].Springer,2010,10:1033-1043.
[28] Zhang M,Liu J,Yang Z,et al.Expression,purification and characterization of human ubiquitin-activating enzyme,UBE1 [J].Mol Biol Rep,2010,37(3):1413-1419.
