基于分子印迹膜用于检测组胺的电化学传感器
2014-03-21姜随意宁保安白家磊彭媛张娜高志贤
姜随意,宁保安,白家磊,彭媛,张娜,高志贤
(军事医学科学院卫生学环境医学研究所,天津市环境与食品安全风险监控技术重点实验室,天津300050)
基于分子印迹膜用于检测组胺的电化学传感器
姜随意,宁保安,白家磊,彭媛,张娜,高志贤*
(军事医学科学院卫生学环境医学研究所,天津市环境与食品安全风险监控技术重点实验室,天津300050)
利用电化学传感技术,对水样中的组胺进行检测,为研发相应的食品快检技术与设备提供技术基础。在金电极上制备分子印迹膜,应用电化学进行表征,建立电化学检测组胺的方法。该方法检出限:0.5 ng/mL,检测范围:0.5 ng/mL~50 ng/mL,检测时间<30min。所建立的方法对于检测水样的组胺具有灵敏度高、准确度好和精密度高。
电化学传感技术;组胺;分子印迹膜;食品快检技术
组胺(Histamine,HA),又名组织胺,分子式:C5H9N3,化学名4(5)-(2-氨乙基)咪唑。组氨是一种生物胺,它是由组胺酸分解而成,而组氨酸是蛋白质经过分解后产生的一种氨基酸,组胺分子量小,只有111 Da[1],组胺分子式及结构类似物见图1,食品中组胺主要是组氨酸在莫根氏变形杆菌、组胺无色杆菌等微生物和组氨酸脱羧酶等共同作用下发生脱羧反应产生的。人体中组胺主要存储于肥大细胞和嗜碱性粒细胞中[2-3],当机体受到过敏原刺激时,会大量的产生组胺,局部浓度的增加导致过敏反应[4],众所周知,组胺不仅作为速发型超敏反应的一种细胞间化学介质[5],而且也是大脑中的神经递质,大脑中浓度达到1μmol/kg~6μmol/kg[6]。组胺有毒性,可以降低血压,当有机体摄入组胺超过100mg(或每千克体重1.5mg)时,即可引起食物中毒[7]。在由生物胺导致的食品安全问题中,组胺对人类的健康的影响最大。全国曾多次发生过组胺食物中毒事件。世界上很多国家对食品中组胺含量做了限量要求:美国FDA要求水产品中组胺含量不得超过50mg/kg[8];欧盟规定鲭科鱼类中组胺含量不得超过100mg/kg,其它食品中的组胺含量不得超过100mg/kg~800mg/kg;我国规定鲐鱼中组胺含量不得超过100mg/100 g,其它鱼类不得超过30mg/100 g。据相关文献报道,组胺是一种自然产生的物质,在许多蔬菜、水果、啤酒、鱼、奶酪和红葡萄酒中都能产生组胺[7],为了给食品加工生产时的危害分析临界控制点(HACCP)认证提供科学依据,在食品和食品加工行业,快速、准确、可靠的检测组胺显得十分必要。组胺的检测方法主要有:有偶氮试剂比色法、荧光分光光度法、高效液相色谱法(HPLC法)[9]、气相色谱法(GC)[10]、薄层色谱法(TLC)、酶联免疫方法(ELISA法)[11]、毛细管电泳法(CE)和生物学法等。这些方法所用试剂、器皿较多,操作繁琐、费时、灵敏度低。另外,我国现行的标准检验方法是GB/T5009.45-2003和国标《水质组胺等五种生物胺的测定高效液相色谱法》(GB/T21970-2008),目前还没有应用电化学法检测食品中组胺的标准,在国内外的文献检索中,应用电化学法检测食品中组胺的方法也很少,电化学法有操作简便、灵敏度高、快速等优点,因此建立食品中组胺的电化学法检测方法十分必要,本项目采用电化学法开展了这一方法标准化的研究和起草工作。
图1 组胺及其结构类似物Fig.1 Structuresof histaMineand structuralanalogs
在本项目中,我们建立了基于分子印迹膜检测组胺的电化学传感器,相对于传统的检测技术,该技术提出了一个新的发展空间。含有大量印迹孔穴的分子印迹聚合物(MIPs)是人工合成受体,它具有类似天然抗体或酶的特异性和选择性[12],这种含有合成识别元件的仿生传感器可以在各种恶劣的环境中使用。MIPs包含大量的印迹孔穴,这些孔穴能够通过形状、大小和官能团(如氢键)与靶分子进行互补,它特别适用于小分子的检测[13]。在目标分子存在的情况下,电阻抗会发生变化,这些变化可以通过电化学传感器表征。该方法有以下几个优点:首先,MIPs合成成本低[14];第二,MIPs具有较好的稳定性,能承受极端的温度和pH环境[15];第三,MIPs是通过非共价键的方法制备,具有良好的再生性[16]。至今,基于MIPs检测组胺的文献很少,本研究还研究了pH对检测组胺的影响。该传感器加入0.1MHCl溶液再生后可重复使用。我们成功地实现了对组胺的检测,检测限为0.5 ng/mL。
1 材料与方法
1.1 主要试剂
组胺标准品、11-巯基十一烷酸(MUA)、单体甲基丙烯酸(MAA)、交联剂乙二醇二甲基丙烯酸酯(EGDMA)、引发剂2,2-偶氮双(2-甲基丙脒)盐酸盐(AIBA)(美国Sigma-Aldrich公司),1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(EDC)、N-羟基琥珀酰亚胺(NHS)(阿拉丁试剂上海有限公司),结构类似物5-羟色胺、1-咪唑乙酸、5-羟基吲哚乙酸、组胺酸(美国Sigma-Aldrich公司),其它试剂均为国产分析纯,使用前未经纯化处理,实验用水为18.3MΩ·cm超纯水。
1.2 主要仪器
电化学工作站:荷兰IVIUMTECHNOLOGIESBV公司;Ag/AgCl电极、铂丝电极:上海辰华仪器有限公司;金电极:天津艾达恒晟科技发展有限公司;电热真空干燥箱:天津天宇机电有限公司;Eppendorf移液器:德国Eppendorf公司;超声波清洗机:宁波新芝生物科技股份有限公司;其林贝尔脱色摇床:江苏海门其林贝尔仪器制造有限公司;AL-204分析天平:美国METTLER TOLEDO。
1.3 方法
1.3.1 金电极的处理
用药匙取少量Al2O3粉于麂皮上,加少量蒸馏水润湿,将清洗干净的电极在麂皮上“8”字形打磨,打磨好金电极后,用蒸馏水冲洗,将金电极在1MH2SO4体系中进行清洗,循环伏安法扫描电位为-0.2 V~1.2 V,稳定后将金电极放入0.5MH2SO4体系中进行活化,循环伏安法扫描电位为-0.2V~1.6V,扫描稳定后活化完毕,H2SO4体系实验前均用N2除氧10min。
1.3.2 分子印迹膜的制备
将金电极放入1mM的MUA乙醇溶液中反应过夜,清洗干净后,加入400mMEDC、100mMNHS混合液(1∶1,v/v)中避光振荡活化1 h,然后将金电极加入含有200mM的AIBA水溶液中反应3 h,反应完毕后,将金电极放入含有组胺(0.2mmol)、MAA(0.4mmol)、EGDMA(0.8mmol)及DMSO(5mL)的预聚合液中,氮气除氧10min后,放入60℃反应16 h,然后用甲醇/冰乙酸(9∶1,v/v)洗脱模板分子,制备得到分子印迹膜,应用这种材料检测组胺,非印迹膜的制备没有加入组胺,其它方法同前。
1.3.3 最佳pH的筛选
将浓度为5 ng/mL的组胺溶液的pH分别调到4~ 12后,再将修饰好后的金电极分别浸泡10min,然后再进行电化学表征。
1.3.4 电阻抗(EIS)法表征
将不同梯度浓度的组胺标准液(0.5、1.0、2.5、5.0、10、25、50ng/mL)分别与修饰好后的金电极反应10min,每个浓度重复测量3次,绘制标准曲线,建立检测范围,计算出最低检测限值。
1.3.5 精密度实验
通过修饰的金电极对5 ng/mL组胺进行EIS表征,洗脱和再生5次后,观察电阻抗的变化,评价该检测方法的精密度。
1.3.6 干扰实验
应用MIP膜、NIP膜对10倍浓度的干扰物与组胺的检测进行比较,评价MIP膜对组胺检测的选择性。
2 结果
2.1 最佳pH的选择
pH的变化对该传感器的影响较大,随着pH的变化EIS表征会发生相应的变化,组胺在不同的pH形态会发生变化,组胺的等电点为6.9和10.4[17],当pH>10.4时,组胺以其天然的形态出现,当pH<6.9时,组胺含有2个质子,当pH位于二者之间时,组胺含有1个质子。将浓度为5 ng/mL的组胺溶液的pH分别调到4~12后,与金电极反应完毕后进行电化学表征,见图2。

图2 pH对基于MIP膜的电化学传感器检测组胺的影响Fig.2 ElectrocheMicalsensor responseof theMIP fliMin varying pH conditions
pH位于7~9时,电阻抗的变化明显好于其他pH,pH位于8时,达到最佳检测效果,由此可见,含有1个质子的组胺能够很好的与MIP膜结合。
2.2 吸附响应实验
应用EIS对不同浓度组胺的表征如图3所示。
可见各个浓度对应的EIS响应信号成梯度变化,根据EIS响应信号的变化,绘制出了剂量响应曲线及标准曲线如图4所示。
由图可以看出,剂量响应曲线的形状不是一条笔直的直线,而是一个典型的等温结合反应曲线,初始激烈的信号上升,随后逐渐出现饱和平稳,将浓度进行对数变换后,绘制出了标准曲线,公式为:y= 3.440lgx+1.283,R2=0.997,组胺的检测范围为:0.5ng/mL~ 50 ng/mL,检测限值:0.5 ng/mL。检测限值的计算方法根据IUPAC的要求:CL=Cn+tSn/(n)1/2,CL为最低检测限,Cn为最低可检测的浓度,t值选用的是95%可信区间范围,n是检测的样品数(n=5),Sn是测量5个样品的标准差。

图3 EIS对不同浓度组胺的表征图Fig.3 EIS characterization of different concentrationsof histaMine

图4 电化学传感器检测组胺的响应曲线及标准曲线Fig.4 Response curveand calibration curveof the present electrocheMicalsensor for histaMine
2.3 选择性实验
本实验分别用MIP膜、NIP膜修饰的金电极作为识别元件,检测不同浓度的组胺水溶液,比较结果如图5所示。
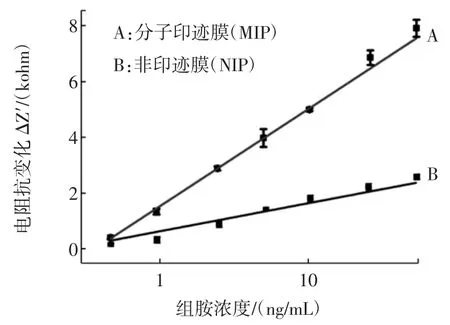
图5 MIP膜与NIP膜对组胺检测的选择性比较Fig.5 Selectivity coMparison ofMIP filMand NIP filMfor histaMine
由图可以看出,MIP膜对组胺的选择性明显好于NIP膜,说明制作的MIP膜对组胺有吸附作用。应用MIP膜、NIP膜对10倍浓度的干扰物与组胺的检测进行比较如图6所示。

图6 组胺与结构类似物的电阻抗变化的比较Fig.6 The iMpedanceshiftof histaMineand structuralanalogues
MIP膜对组胺的选择性好,特异性高。
2.4 精密度实验
通过修饰的金电极对5 ng/mL组胺进行EIS表征,洗脱和再生5次后,电阻抗的变化如图7所示。

图7 连续测定5 ng/ML组胺的EIS表征图Fig.7 EIS response for successive detectionsof 5 ng/MLof histaMine
第1次与第5次检测,电阻抗变化很小,表明该MIP膜的精密度高、稳定度好。
3 讨论
通过对检测条件的优化,制备了高特异性快速响应的分子印迹电化学传感器,建立了检测组胺的标准曲线,最低检测限为:0.5 ng/mL,检测范围:0.5 ng/mL~50 ng/mL。选择性实验结果显示,该材料对结构类似物无明显的交叉反应性,并且洗脱和再生5次后仍对组胺有吸附性,还可以进一步优化实验条件,提高分子印迹膜的稳定性,该方法可作为快速检测食品中组胺的方法之一。
[1]Beaven MA.Histamine:its role in physiological and pathological processes[J].Monographs in Allergy,1978,13:1-113
[2]Paul,W.Fundamental Immunology[M].2nd ed.New York,1984:716-720
[3]Metcalfe D,BaraMD,MekoriY.Mastcells[J].Physiological reviews, 1997,77:1033-79
[4]JOtomo,TTakeshita,SFukuzono,etal.Expression of thehistamine receptor in Xenopusoocyte and itsapplication to the histamine sensor[J].Sensorsand ActuatorsB:Chemical,2000,66:19-21
[5]R Y Lin,LBSchwartz,A Curry,etal.Histamine and tryptase levels in patientswith acute allergic reactions:An emergency departmentbased study[J].Journal of Allergy and Clinical Immunology,2000, 106:65-71
[6]Schwartz JC,Pollard H,Quach T T.Histamine as a Neurotransmitter in Mammalian Brain:Neurochemical Evidence[J].Journal of Neurochemistry,1980,35:26-33
[7]Lehane L,Olley J.Histamine fish poisoning revisited[J].International Journalof Food Microbiology,2000,58:1-37
[8]Food and Drug Administration.Decomposition and histamine in raw, frozen tunaandmahi-mahi,canned tuna;and related species.Compliance Policy Guides,7108.240,1996:540-525
[9]Yoshitake T,Ichinose F,Yoshida H,etal.A sensitive and selective determinationmethod ofhistamineby HPLCwith intramolecular excimer-formingderivatization and fluorescencedetection[J].BiomedicalChromatography,2003,17:509-516
[10]Keyzer JJ,Wolthers BG,Muskiet FA,etal.Measurementofplasma histamine by stable isotope dilution gas chromatography-mass spectrometry:Methodology and normal values[J].Analytical Biochemistry,1984,139:474-481
[11]Ujike A,Ishikawa Y,Ono M,et al.Modulation of Immunoglobulin (Ig)E-mediated Systemic Anaphylaxis by Low-Affinity Fc Receptors for IgG[J].The Journal of Experimental Medicine,1999,189 (10):1573-1579
[12]PKOwens,LKarlsson.Molecular imprinting for bio-and pharmaceuticalanalysis[J].TrACTrends in Analytical Chemistry,1999,18 (3):146-154
[13]S A Piletsky,NW Turner,P Laitenberger.Molecularly imprinted polymers in clinical diagnostics-Future potential and existing problems[J].MedicalEngineering&Physics,2006,28(10):971-977
[14]GWulff.The role of binding-site interactions in themolecular imprinting of polymers[J].Trends in Biotechnology,1993,11(3):85-87
[15]Spivak D A.Optimization,evaluation,and characterization ofmolecularly imprinted polymers[J].Advanced Drug Delivery Reviews, 2005,57(12):1779-1794.
[16]H A De Abreu,W B De Almeida,H A Duarte.pKa calculation of poliprotic acid:histamine.Chemical Physics Letters,2004,383:47-52
ElectrocheMical Sensor for the Detection of HistaMine Based on Molecularly Imprinted Polymer Film
JIANGSui-yi,NINGBao-an,BAIJia-lei,PENGYuan,ZHANGNa,GAOZhi-xian*
(Tianjin Key LaboratoryofRisk Assessmentand Control Technology for Environmentand Food Safety,Institute ofHealth and EnvironmentalMedicine,Tianjin 300050,China)
In thepurposeofproviding fastdetection technologyandequipment,adetectionmethod forhistaminein water samplesusing electrochemical sensorwas established.Molecularly imprinted polymer(MIP)filmswere preparedon thegoldelectrode,andwerecharacterizedbyelectrochemicalmethod.Electrochemicalmethod for the detection ofhistaminewasestablished.TheminimuMdetection limitof theestablishedmethodwas0.5 ng/mL.The sensing techniqueallows for thedetection ofhistamine in thewide range froM0.5 ng/mL to50 ng/mLand detection time lessthan30min.Theestablisheddetectionmethod forhistamineinwatersensitive,accurate,andprecise.
electrochemicalsensing technology;histamine;molecularly imprinted polymer(MIP)films;food fastdetection technology
10.3969/j.issn.1005-6521.2014.18.019
2014-09-15
国家“863”计划项目(2012AA101604)
姜随意(1982—),男(汉),医师,在读硕士研究生,研究方向:食品安全关键技术研究。
*通信作者
