蜂胶对猪细小病毒灭活疫苗佐剂作用的试验
2014-03-11刘永录郭振环沈志强
马 霞,刘永录,郭振环,沈志强
(1.河南牧业经济学院,河南 郑州450011;2.山东省滨州畜牧兽医研究院,山东 滨州256600)
猪细小病毒(Porcine ParvovirusVaccine,PPV)病是引起母猪繁殖障碍的主要病因之一,为了预防猪细小病毒病,上海市农业科学院畜牧兽医研究所在国内首先研制成功猪细小病毒病灭活疫苗[1],并证实豚鼠可以作为猪细小病毒病疫苗效力检验的实验动物[2],豚鼠免疫油佐剂细小病毒疫苗后具有免疫效果确实[3]的优点。国外在用豚鼠和家兔作为疫苗的效力检验方面也做过探讨[4]。
本试验以豚鼠为模型动物,以油佐剂和铝胶佐剂为对照,观察蜂胶对猪细小病毒灭活疫苗的佐剂作用。
1 材料与方法
1.1 蜂胶佐剂的制备 将生产用蜂胶(购自山东省聊城蜂业研究所,蜂胶在75%乙醇溶解率≧65%),在2℃~8℃条件下磨碎过筛,按1∶4(W/V)比例加入95%乙醇,室温浸泡48 h,冷却、过滤,即得纯净蜂胶乙醇浸出液(透明栗色溶液)。
1.2 主要试剂和仪器 主要试剂:RPMI1640培养液,Gibco公司产品;按说明书用三蒸水配制后过滤除菌,分装,4℃保存;伴刀豆素球蛋白(ConA),Sigma公司产品;-20℃保存;Hank's试剂按照文献[5]配制;小牛血清:杭州四季青生物有限公司产品;56℃30min灭活,分装,-20℃保存备用;四唑盐(MTT):3-(4,6-二甲基噻唑-2-x-l)-2,5-乙苯基-四唑溴盐,Sigma公司产品。其他试剂皆为分析纯。ELISA检测试剂盒,R&D Systems Inc,Minneapolis,USA.
主要仪器设备:MULTISKAN-MK3型酶联免疫检测仪,赛默飞世尔(上海)仪器有限公司产品;CO2培养箱,美国Revco公司生产;XSZ-D2型倒置显微镜,重庆光学仪器厂生产;75-2A型微量振荡器,上海医用分析仪器厂生产;96孔细胞培养板和6孔细胞培养板,德国Nunclon公司生产。
1.3 PPV疫苗的制备
1.3.1 病毒接种及收毒 PPV-SD1毒株,山东省滨州畜牧兽医研究院分离、鉴定后保存。猪的肾原传代细胞(Porcine kidney 15,PK-15),中国兽医药品监察所提供。按照常规细胞培养方法[6],用含有8%新生牛血清的DMEM液(pH=7.2)作为PK-15细胞的培养液,用0.25%胰酶消化传代,置于37℃、5%CO2培养箱中培养。PK-15细胞生长至12~15 h时,按照5%接种量接种PPV,待细胞有80%发生细胞病变时收毒。并用豚鼠红细胞血凝试验测血凝效价[7],并测定病毒含量[8]。
1.3.2 病毒的灭活 0.3%甲醛在37℃条件下作用24 h,并不断搅拌。灭活病毒用PK-15细胞连续传代3次,观察细胞有无病变确定病毒灭活是否完全。并按《中华人民共和国兽用生物制品质量标准》(2000版)附录中方法进行无菌检验。
1.3.3 蜂胶佐剂疫苗的制备 取灭活后PPV加入一定比例蜂胶乙醇提取液,用胶体磨慢速转动搅拌,3 000 r/min搅拌3~5min,使其充分混合乳化。终止搅拌前按总量的0.005%加入10%硫柳汞溶液。
1.3.4 铝胶疫苗的制备 取灭活后的PPV配以20%氢氧化铝胶佐剂,按总量的0.005%加入10%硫柳汞溶液。
1.3.5 油佐剂疫苗的制备 94%白油与6%司本-80混合后加2%硬脂酸铝,灭菌后为油相,灭活后的PPV抗原液加2%吐温-80为水相,按照油相和水相5∶3比例混合,乳化。乳化时先缓速混合,再用胶体磨10 000 r/min搅拌20 min。终止搅拌前按总量的0.005%加入10%硫柳汞溶液。
1.4 实验动物 健康豚鼠,体重350 g左右,购自北京中医药大学动物中心。饲养于滨州畜牧兽医研究院P2动物房(温度18℃~24℃,24 h光照),笼长×宽×高为80×50×40 cm,每笼2只,定时用动物房购买豚鼠饲料喂养,自由饮水。试验前检测HI抗体效价阴性。
1.5 试验设计 取豚鼠68只随机均分为4组,1~3组分别肌肉注射0.5mL蜂胶佐剂(propolisadjuvant,PA)PPV灭活疫苗、铝胶佐剂(Aluminum saltadjuvant,AA)PPV灭活疫苗、油佐剂(oilemulsion adjuvant,OA)PPV灭活疫苗0.5mL,空白对照(blank control,BC)组注射0.5mL生理盐水,2周后二免。分别于免疫后第7(D7)、14(D14)、21(D21)、28(D28)、35(D35)天和第42(D42)天每组5只豚鼠心脏采血0.5mL用β-微量法检测细小病毒HI抗体,第D7、D14、D35天每组随机抽取3只采集脾脏,分别用MTT法[13]及ELISA法[14]测定脾淋巴细胞增值及淋巴细胞上清液中IL-2和IL-4的含量。
1.6 数据分析 数据以-X±SE表示,用SPSS软件进行Duncan多重分析。
2 结果
2.1 HI抗体效价变化 免疫后第7天(D7)和D14蜂胶佐剂组的HI抗体效价明显高于铝胶佐剂和油佐剂组,D21~D42油佐剂组高于蜂胶佐剂组,后者高于铝胶佐剂组(P>0.05);在D28,油佐剂组HI抗体效价显著高于蜂胶佐剂和铝胶佐剂组(P<0.05)(表1)。

表1 免疫后HI抗体效价的动态变化 (log2)
2.2 淋巴细胞增殖变化 在D7和D35蜂胶佐剂组协同ConA刺激脾脏T淋巴细胞增殖A570值显著高于油佐剂和铝胶佐剂组,油佐剂组显著高于铝胶佐剂组(P<0.05)。在D14,蜂胶佐剂组A570值显著高于油佐剂和铝胶佐剂组(P<0.05)(表2)。
在D7,蜂胶佐剂组协同LPS刺激脾脏淋巴细胞增殖A570值显著高于油佐剂和铝胶佐剂组,铝胶佐剂组显著高于油佐剂组(P<0.05)。在D14和D35,蜂胶佐剂组协同刺激源LPS刺激脾脏淋巴细胞增殖A570值最高,且高于油佐剂和铝胶佐剂组(P>0.05)(表2)。

表2 各组脾脏淋巴细胞增殖的变化(A570值)
2.3 脾淋巴细胞分泌IL-2的变化 在D7,蜂胶佐剂组脾脏T淋巴细胞分泌IL-2含量显著高于油佐剂和铝胶佐剂组,油佐剂组显著高于铝胶佐剂组(P<0.05)。在D14,蜂胶佐剂组分泌IL-2含量显著高于油佐剂和铝胶佐剂组(P<0.05)。在D35,蜂胶佐剂组分泌IL-2含量显著高于油佐剂和铝胶佐剂组(P<0.05)(表3)。
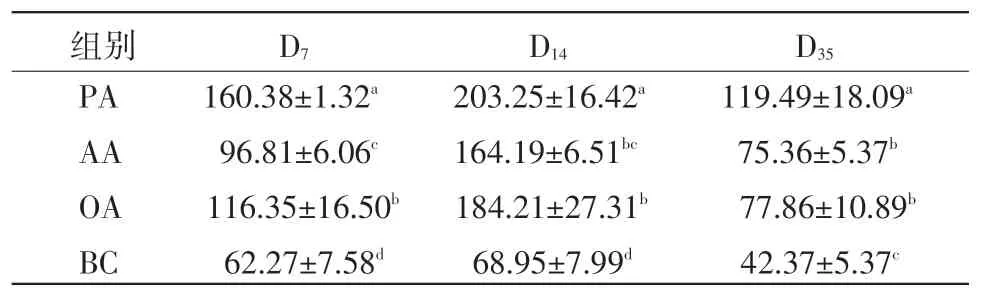
表3 脾淋巴细胞分泌IL-2的变化(μg/mL)
2.4 脾淋巴细胞分泌IL-4的变化 在D7,蜂胶佐剂组和油佐剂组脾脏T淋巴细胞分泌IL-4含量显著高于铝胶佐剂组,三佐剂组含量显著高于对照组(P<0.05)。在D14,蜂胶佐剂组脾脏T淋巴细胞分泌IL-4含量显著高于油佐剂和铝胶佐剂组,油佐剂组显著高于铝胶佐剂组,三佐剂组含量显著高于对照组(P<0.05)。在D35,蜂胶佐剂组脾脏T淋巴细胞分泌IL-4含量显著高于油佐剂和铝胶佐剂组,三佐剂组含量显著高于对照组(P<0.05)(表4)。
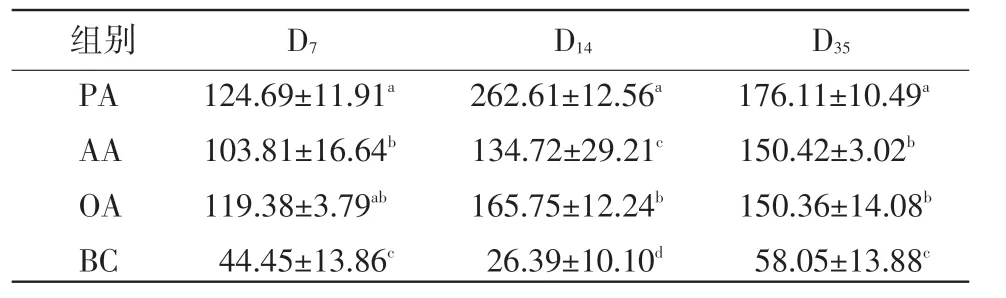
表4 脾淋巴细胞分泌IL-4的变化(μg/mL)
3 讨论
3.1 对体液免疫的影响 本试验结果表明,蜂胶佐剂可使豚鼠对猪细小病毒疫苗取得很好的体液免疫,特别是在免疫早期,血清特异性HI抗体略高于油佐剂组;且在检测免疫后抗体变化过程中发现,蜂胶佐剂组抗体效价高于铝胶佐剂组。
潘雪珠等[2]和叶向华等[3]已经证明,豚鼠可以作为猪细小病毒油佐剂疫苗免疫的检测抗体的校检动物,本试验中也发现豚鼠可以对猪细小病毒油佐剂疫苗产生很好的体液免疫,蜂胶佐剂猪细小病毒佐剂疫苗体液免疫水平比油佐剂略差,但优于铝胶佐剂,因此,可以肯定蜂胶佐剂猪细小病毒疫苗的体液免疫效果。沈志强等首次以蜂胶为佐剂研制的禽霍乱蜂胶菌苗取得了满意的效果,产生抗体快速、7 d可产生坚强免疫力,证明蜂胶在特异性抗体产生早期效果特别明显[9]。赵恒章等[10]以油佐剂、蜂胶和铝胶为佐剂,按一定比例配制成巴氏杆菌的灭活苗,试验证明,油佐剂灭活苗的保护期和蜂胶灭活苗的保护期相当,但蜂胶灭活苗的抗体水平上升速度比油佐剂苗快且保护率高。
3.2 对细胞免疫的影响 本试验通过测定淋巴细胞增殖和IL-2、IL-4细胞因子含量,比较了蜂胶佐剂、油佐剂和铝胶佐剂辅助猪细小病毒灭活疫苗产生免疫应答的影响,结果表明,蜂胶佐剂对疫苗产生细胞免疫水平高于油佐剂。
IL-2为Th1型细胞因子,可以增强机体的抵抗病毒等病原体的能力。IL-4为Th2型细胞因子,可以辅助机体产生特异性抗体。Th1和Th2反应相互协调[11]。程超等[12]报道,将蜂胶黄酮作为佐剂制备EDS-76疫苗,研究其对雏鸡血液中T、B淋巴细胞比例的影响,结果表明,蜂胶黄酮作为佐剂可使雏鸡血液中的T淋巴细胞的比例极显著增加,且血清特异性抗体增加明显。也有研究报道[13],蜂胶的乙醇粗提物单独或配伍其他中药成分作为新城疫疫苗佐剂使用,与其油佐剂比较,可以产生相同或略低的新城疫抗体,但用MTT法测定的淋巴细胞增殖效果是蜂胶佐剂优于油佐剂,并且可以提高雏鸡抵抗新城疫病毒的感染的能力。Fischer G等[14]报道了用小鼠模型免疫蜂胶的酚类提取物佐剂猪疱疹病毒灭活疫苗的试验,结果表明,该疫苗可以提高猪疱疹病毒特异性抗体和小鼠脾脏IFN-γ水平。
[1]潘雪珠,粟寿初,张婉华,等.猪细小病毒灭活疫苗的安全性和免疫力[J].上海农业学报,1988,4(1):1-10.
[2]潘雪珠,粟寿初,余晨,等.注射猪细小病毒灭活疫苗的豚鼠的抗体反应[J].上海畜牧兽医通讯,1987(4):1-4.
[3]叶向阳,张婉华,曹伟明,等.猪细小病毒病油乳剂灭活疫苗研制及应用研究[J].上海畜牧兽医通讯,2002(6):17-18.
[4] Joo H S,Molitor TW,Leman A D.Antibody responses of guineapigs,rabbits and pigs to inactivated porcine parvovirus vaccine[J].Veterinarymicrobiology,1984,9(1):27-33.
[5]Deyun Wang,Yuanliang Hu,Junling Sun,et al.Comparative study on adjuvanticity of compound Chinese herbalmedicinal ingredients[J].Vaccine,2005,23(28):3704-3708.
[6]殷震,刘景华.动物病毒学[M].2版,北京:科学出版社,1997:1145-1155.
[7]中国兽药典委员会.中华人民共和国兽药典[M].2005年版三部,北京:中国农业出版社,附录30.
[8]中国兽药典委员会.中华人民共和国兽药典[M].2005年版三部,北京:中国农业出版社,附录26.
[9]沈志强,刘吉山,李峰,等.禽霍乱与大肠杆菌病多价蜂胶二联灭活疫苗的研究[J].中国预防兽医学报,2004,26(4):290-297.
[10]赵恒章,刘保国,李军民.地方性鸡大肠杆菌多价蜂胶灭活苗的制备及应用[J].甘肃畜牧兽医,2004,4:5-7.
[11]Segura E and Villadangos JA.Antigen presentation by dendritic cells in vivo[J].Current Opinion in Immunology,2009,21:105-110.
[12]程超,明庆磊.蜂胶乙醇提取物及其作为佐剂对雏鸡血液T、B淋巴细胞比例的影响[J].徐州师范大学学报(自然科学版),2002,20(3):61-63.
[13]Zhenhuan Guo,Yuanliang Hu,DeyunWang,etal.Sulfatedmodification can enhance the adjuvanticity of lentinan and improve the immune effect of ND vaccine[J].Vaccine,2009(27):660-665.
[14]Fischer G,Conceição F R,Leite F P,et al.Immunomodulation produced by a green propolis extract on humoral and cellular responses ofmice immunized with SuHV-1[J].Vaccine,2007,25(7):1250-1256.
