稻米中黄曲霉毒素和赭曲霉毒素A的研究进展
2014-03-07赖先文刘承兰
赖先文,张 荷,刘承兰
(天然农药与化学生物学教育部重点实验室,华南农业大学,广东广州 510642)
稻米中黄曲霉毒素和赭曲霉毒素A的研究进展
赖先文,张 荷,刘承兰*
(天然农药与化学生物学教育部重点实验室,华南农业大学,广东广州 510642)
真菌毒素是由某些丝状真菌产生的有毒代谢产物,在自然界中普遍存在,严重威胁人畜健康。综述了黄曲霉毒素和赭曲霉毒素A的理化性质及危害,在稻米中的污染现状、限量标准及分析方法等方面进行阐述,希望能给真菌毒素的研究提供一些参考。
真菌毒素,黄曲霉毒素,赭曲霉毒素A,稻米
真菌毒素(Mycotoxin)是由产毒真菌在适宜的环境条件下产生的有毒代谢产物,广泛分布于粮食、食品、饲料等中,具有急、慢性毒性和致畸、致癌、致突变等作用,严重威胁人畜健康[1-2]。据联合国粮农组织(FAO)估算,全球每年约有25%的农产品受到真菌毒素的污染,2%的农产品因污染严重而失去营养价值和经济价值,造成数百亿美元的经济损失[3]。在已报道的众多真菌毒素如黄曲霉毒素(Afltoxins,AFT)、赭曲霉毒素(Ochratoxin A,OTA)、伏马菌素(Fumonisins,FBs)、玉 米 赤 霉 烯 酮(Zearalenone,ZON)和 脱 氧 雪腐 镰 刀 菌 烯 醇(Deoxynivalenol,DON)和 桔 青 霉 素(Citrinin,CIT)等中[4],黄曲霉毒素和赭曲霉毒素由于毒性强且在农作物中污染普遍[2,5-6],从而受到了各国政府和科研工作者的高度重视。
1 真菌毒素的理化性质及危害
1.1 黄曲霉毒素
黄 曲 霉 毒 素(AFT)是 一 类 主 要 由 黄 曲 霉(Asperillus flavus)和寄生曲霉(A.parasiticus)等产生的有毒代谢产物。目前已报道的黄曲霉毒素有AFB1、B2、G1、G2、M1、M2、P1、Q、H1、GM、B2a和毒醇等20多种化学结构相似的化合物,其中黄曲霉毒素B1、B2、G1和G2是粮食中黄曲霉毒素的主要存在形式[7-8]。黄曲霉毒素的基本结构由一个二呋喃环和一个氧杂萘邻酮(即香豆素)组成,前者为其毒性结构,后者可能与其致 癌 作 用 有 关[9];其 相 对 分 子 量 为 312~346,难 溶 于水,易溶于甲醇、乙腈、丙酮和氯仿等有机溶剂,在紫外光照射下,黄曲霉毒素B1、B2发蓝色荧光,黄曲霉毒素G1、G2发绿色荧光。黄曲霉毒素在中性及酸性溶液中较为稳定,当pH为9~10发生可逆分解;耐高温,普通的加热处理很难破坏其结构。黄曲霉毒素是一类毒性极强的剧毒物质,可使人及动物肝脏组织造成损伤,严重时可导致肝癌甚至死亡;同时还能造成胃肠功能障碍、生殖能力下降和出血性贫血等不良影响[10]。其中,以黄曲霉毒素B1(AFB1)的毒性和致癌性最强,1993年被世界卫生组织(WHO)的癌症研究机构(IARC)划定为I类致癌物[11]。
1.2 赭曲霉毒素
赭曲霉毒素是一类主要由赭曲霉(A.ochraceus)、疣 孢 青 霉(Penicillium verrucosum)和 炭 黑 曲 霉(A.carbonarius)等产生的有毒代谢物,包括A、B、C等7种结构类似的化合物,其中以赭曲霉毒素A(OTA)毒性最大、分布最广[12]。赭曲霉毒素A是由异香豆素与β-苯丙氨酸结合的衍生物,相对分子质量403.8,熔点169℃,纯品为无色针状晶体,微溶于水,易溶于极性溶剂和碳酸氢钠溶液,在紫外光下呈绿色荧光,在苯-乙酸(99/1,v/v)溶液中最大吸收波长为333nm。OTA对热相对稳定,一般的烹饪加工方法只能使其部分分解。OTA毒性作用的主要靶器官为肾脏,可引起多种急慢性肾脏疾病,并被认为与巴尔干地方性肾病有关;还具有肝毒性、神经毒素、免疫毒性等,可导致胎儿畸形、流产甚至死亡,具有致畸、致癌作用[13-15]。1993年,世界卫生组织(WHO)下的癌症研究机构(IARC)将其划为2B类致癌物(可能致癌物)[11]。
2 黄曲霉毒素和赭曲霉毒素在稻米中的污染现状和限量标准
目前,黄曲霉毒素、赭曲霉毒素A等真菌毒素污染已成为影响粮食质量安全的主要因素之一,研究报道世界范围内的水稻、玉米、小麦、高粱等粮谷类作物都不同程度地受到了真菌毒素的污染[8,16-19]。全世界约一半以上人口以稻米作为主食,仅在亚洲,就有20亿人从稻米及稻米产品中摄取60%~70%的热量[20],因此,稻米中真菌毒素的污染对世界各国的人畜健康都是一个严重的威胁。目前已报道在韩国、越南、印度、伊朗、巴基斯坦、尼日利亚、土耳其、瑞典、西班牙、墨西哥、摩洛哥、突尼斯和加拿大等国家的稻米中发现有黄曲霉毒素和赭曲霉素A等真菌毒素的污染[21-33](见表1)。由此可见,稻米真菌毒素的污染已成为世界范围内一个非常严峻的问题。
2012/2013年,我国稻谷总产量2亿t左右,按平均出米率73%计算,折合稻米产量约为1.46亿t,约占全国三大粮食作物总产量的40%和世界稻谷总产量的30%[34]。而且,稻米是我国人民的主食,食用人口占总人口的60%以上。据有关部门统计,我国粮食总产量的70%~80%都储藏在农村,由于储粮设施简陋、储藏条件差、储粮技术落后、缺乏科学管理手段等原因,极易受到真菌及真菌毒素的污染。2006年,Liu等[35]对辽宁省储藏1~14年的16个全谷和37个糙米样品进行了黄曲霉毒素的检测,检出阳性样品分别为16个和36个,平均含量分别为3.87μg/kg和0.88μg/kg;2008年,杨家玲[36]对我国10个城市的91个大米制品中赭曲霉毒素A进行了调查,平均含量为1.938μg/kg;2011年,滕南雁等[37]对来自广西地区的34批大米中的黄曲霉毒素进行了检测,其中3批大米检出了黄曲霉毒素B1,含量均为1μg/kg。
随着人们对食品安全问题的日益重视,真菌毒素也受到了前所未有的广泛关注,先后有100多个国家、地区和组织制订了各种真菌毒素的限量标准(见表2),以保护农牧业的健康发展和人类身体健康。
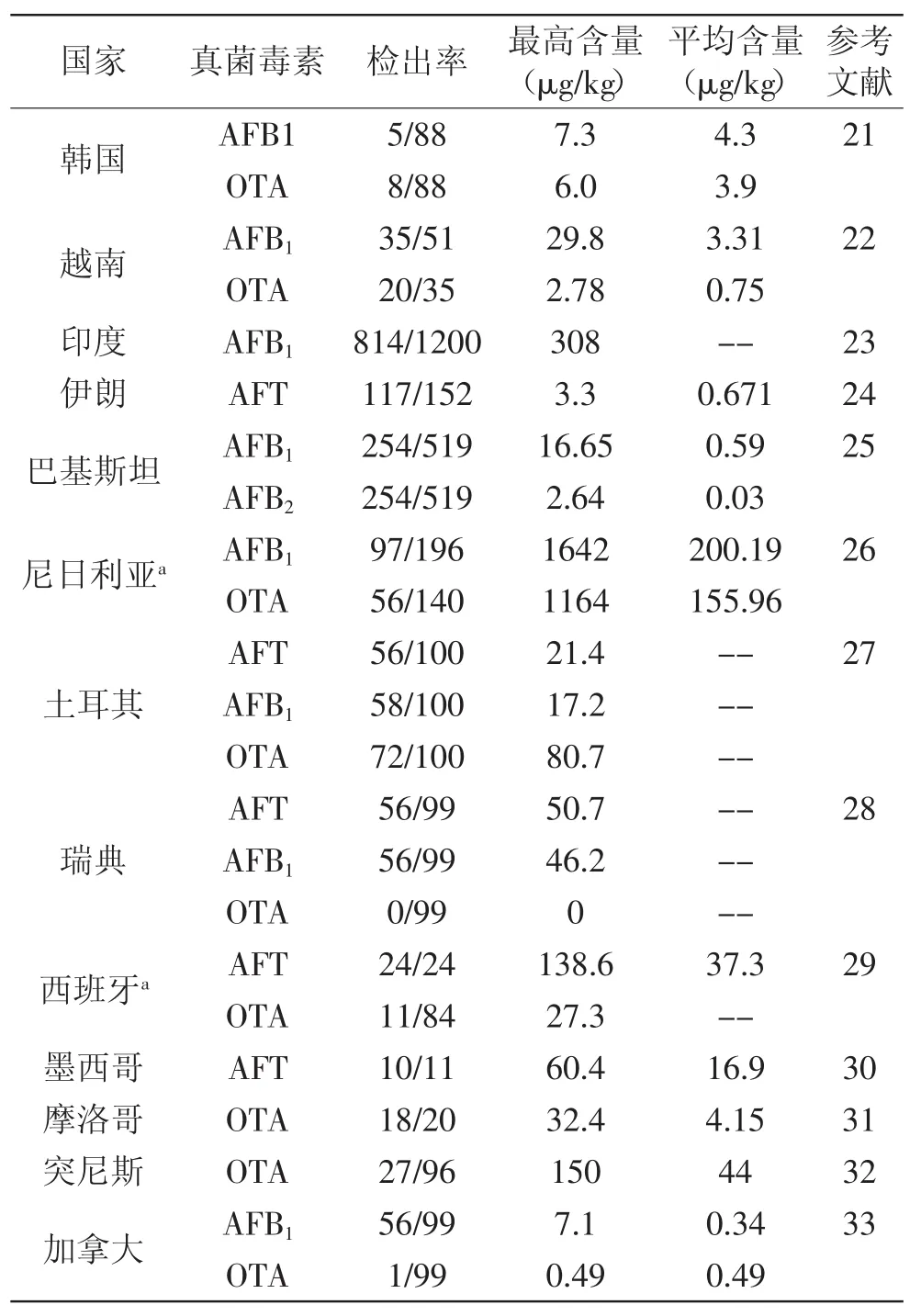
表1 部分国家大米中黄曲霉毒素和赭曲霉毒素A的污染情况Table 1 Contamination situation of aflatoxins and ochratoxin A in rice in some countries
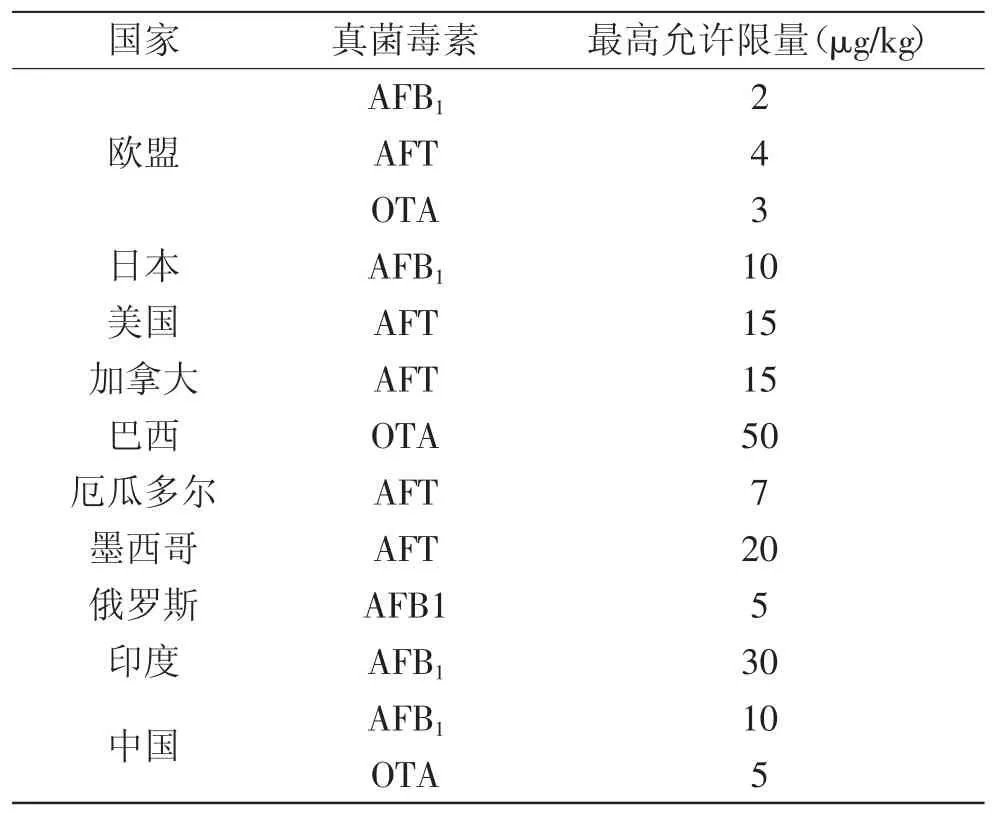
表2 部分国家稻米中黄曲霉毒素和赭曲霉毒素A的最高允许限量Table 2 The maximum levels of the aflatoxins and ochratoxin A in rice in some countries
3 黄曲霉毒素和赭曲霉毒素的分析方法
大多数真菌毒素的化学性质都很稳定,即便是烹饪加工等过程也不容易破坏其活性,而生产实践中又很难避免真菌毒素的产生。另外,随着世界贸易自由化、经济全球化的不断加深,真菌毒素限量已成为限制农产品出口的技术性贸易壁垒之一。因此,建立简便、快速、灵敏的分析方法对掌握稻米中真菌毒素的污染程度和有效降低其危害具有十分重要的意义。
3.1 黄曲霉毒素和赭曲霉毒素的前处理方法
充分提取是分析检测的前提,对于稻米等固体基质中真菌毒素的提取,提取溶剂一般采用甲醇、乙腈和水的混合溶液;提取方式主要有振荡、超声和高速均质等。除了酶联免疫吸附法对净化的要求不高外,大多数用于检测真菌毒素的方法必须进行恰当的净化处理[38]。前处理非常耗时,但是,这些步骤至关重要,直接影响分析结果的准确性和可靠性。
3.1.1 液液萃取 液液萃取(Liquid-liquid extraction,LLE)是基于相似相溶原理,使分析物在两种互不相溶的溶剂中达到平衡,经过反复多次萃取达到分离纯化。其优点是操作简单、方法稳定、成本低,回收率也可达到要求。常规的液液萃取具有有机溶剂使用量大、对环境不友好和费工费时等缺点,已经不能适应“绿色、快速”萃取技术的要求。目前,相继出现了液相微萃取、液膜萃取和逆流色谱等绿色分离技术[39]。分散液液微萃取是2006年Rezaee等[40]首次提出的用于萃取水样中有机物的微型液-液萃取方法,具有操作简便,富集倍数高,萃取效果好等优点,也被广泛应用于各类样品中真菌毒素的提取,如葡萄酒中的OTA[41]、苹果 汁 中 的 展青 霉 素[42]、啤 酒 中 的 玉 米 赤 霉烯酮[43]和谷物中的黄曲霉毒素[44]等。
3.1.2 固相萃取 固相萃取(Solid phase extraction,SPE)是在液固萃取和柱液相色谱技术基础上逐渐发展起来的一种用途广泛的样品前处理技术。与LLE相比,SPE具有回收率和富集倍数高、有机溶剂用量少、无相分离操作、能处理微量样品和易于实现自动化等优点,是目前最常用的样品预处理方法之一。随着色谱分离技术的发展,样品预处理领域也得到了显著发展,先后出现了全自动固相萃取仪、全自动凝胶净化系统、固相微萃取以及基质分散固相萃取等新技术和新方法[45]。李尧等[46]以C18为填料,建立了基质分散固相萃取净化-液相色谱检测谷物中赭曲霉毒素A的分析方法,结果表明,在优化的色谱条件下,可以完全分离谷物中的赭曲霉毒素A,方法回收率为80.0%~93.65%,最低检测限为0.5μg/kg,表明该方法能够快速、准确地检测谷物中赭曲霉毒素A的含量。
3.1.3 免 疫 亲 和 柱 净 化 免 疫 亲 和 柱 净 化 法(Immunoaffinity column,IAC)结合了单克隆抗体技术和亲和层析技术,利用抗原-抗体免疫反应的原理,使用单克隆抗体选择性的吸附提取液中的真菌毒素,以达到分离净化的目的。该方法具有灵敏度高、特异性强、溶剂消耗少和净化效果好等特点,是很多官方机构检测真菌毒素的标准净化方法[47-49]。
3.1.4 多功能柱净化 多功能净化柱(Multifunctional purifying column,MFC)是 一 类 特 殊 的 SPE 柱 ,以 极性、非极性及离子交换等几类基团组成填充剂,选择性吸附提取液中的脂类、蛋白类、糖类等各类杂质,而待测的真菌毒素不被吸附直接通过。与传统的SPE相比,无需经过耗时的活化、淋洗和洗脱过程,可直接上样,一次性完成净化。此方法操作简单、净化效果较好、适用于多残留分析。缺点是价格不便宜,对赭曲霉毒素A的回收率偏低[50-51]。
3.2 黄曲霉毒素和赭曲霉毒素的检测方法
3.2.1 薄 层 色 谱 法 薄 层 色 谱 法( Thin layer chromatography,TLC)是一种传统的真菌毒素分析方法,具有经济简单、灵敏高效等优点,被广泛用于高浓度真菌毒素的定量和半定量分析。国外已经有许多关于薄层色谱法分析真菌毒素的报道,但结果表明TLC法灵敏度较低,操作复杂,分析结果的可重复性和再现性差[52-53]。因此,近年来国际上采用TLC方法检测新真菌毒素的报道已较少,表明TLC在检测真菌毒素领域的发展受到了一定的限制。不过,随着高效薄层色谱法(HPTLC)及薄层扫描仪的发展和应用,提高了TLC的分离效率和检测精确度,进而拓宽了TLC技术在真菌毒素痕量分析领域中的应用。Gao等[54]采用HPTLC测定了谷物中的黄曲霉毒素B1,检出限和定量限分别为0.22ng和0.66ng,以空白样品为基底进行添加回收实验(添加浓度分别为5、10和15ng/g),平均回收率达到81.0%~90.0%。
3.2.2 高 效 液 相 色 谱 法 高 效 液 相 色 谱 法(High performance liquid chromatography,HPLC)是 分 析 真菌毒素最常用的定量方法,在新的国际标准体系中已经处于绝对的主导地位,作为定量的检测方法,在国内外实验室和检测机构得到普遍的使用[55]。对于黄曲霉毒素和赭曲霉毒素A的检测,主要采用荧光检测器检测,结合流动相、色谱柱、柱温和流速等因素,优化色谱条件,从而有效分离各种真菌毒素。由于黄曲霉毒素的荧光特性受溶剂影响大,在极性流动相中,不饱和的AFB1和AFG1极易发生荧光猝灭现象,所以必须在柱前或柱后进行衍生化来增强荧光。目前常用的衍生化方法有柱前三氟乙酸衍生化法、柱后碘衍生化法、柱后溴衍生化法和柱后光化学衍生法[56-57]。
3.2.3 高效液相色谱与质谱联用 高效液相色谱与质谱联用方法(High performance liquid chromatography/ mass spectrometry,LC/MS)适用于大多数真菌毒素的分析,可以同时提供分析物的保留时间和分子结构信息,具有杂质影响小,灵敏度高,适合多组分分析等优点,且可以同时进行定量分析与定性确证,是目前认可的通用检测方法。Soleimany等[58]利用LC-MS/ MS方法同时测定谷物中的AFT、OTA和FBs等11种真菌毒素,样品用有机溶剂提取后,经简单的离心处理后进行检测,检出限在0.01~20μg/kg内,回收率在76.8%~108.4%之间。
3.2.4 酶联免疫吸附法 酶联免疫吸附法(Enzymelinked immunosorbent assay,ELISA)是1971年由荷兰学者Van Weeman和Schurrs,瑞典学者Engvall和Perlman同时提出的将免疫技术用于检测体液中微量物质的固相免疫测定方法[59]。目前,ELISA法已成为检测真菌毒素的重要方法,它具有灵敏、操作简便、样品前处理无需净化(或只需简单净化)、样品处理量大等优点,已建立多种分析各类农产品和食品中真菌毒素的ELISA方法。同时,已有商品化的检测粮油食品中多种真菌毒素(如AFT、OTA、伏马菌素、T-2毒素、呕吐毒素和玉米赤霉烯酮等)的ELISA试剂盒。不过,ELISA相比于其他方法,检测结果的重现性和酶稳定性差,试剂寿命短,且存在交叉反应造成的假阳性问题,因此还需要结合其他方法进行验证。目前,ELISA常用于多种毒素的定性筛选检测[60]。
3.2.5 时间分辨荧光免疫技术 时间分辨荧光免疫技 术(Time-resolved fluoreimmuoassay,TRFIA)是 20世纪80年代发展起来的一种非放射标记分析技术[61]。TRFIA是用具有特殊荧光的镧系离子与螯合剂结合作为示踪物标记蛋白质、多肽、激素、抗体等,在一定的反应体系(抗体抗原免疫反应、核酸探针杂交反应等)发生反应后,用时间分辨荧光仪测定产物中的特异荧光强度,推测反应体系中分析物的浓度,从而达到对待测物进行定量分析的目的[62-63]。TRFIA技术具有灵敏度高、特异性强、稳定性好,且测定范围宽,试剂 寿 命 长 ,操 作 简 便 和 非 放 射 性 等 特 点[64]。 同 时 ,TRFIA具有排除其他荧光干扰,从而克服ELISA的不足,且一次可测定多个样品的优势,现已用于多种真菌毒素的检测[65-66]。李静等[65]建立了时间分辨荧光免疫技术测定油料饼粕中的黄曲霉素B1,回收率在70% ~120%之间。黄飚等[66]采用双标记时间分辨荧光免疫分析技术建立同时检测AFB1和OTA的方法,AFB1的灵敏度达到了0.02μg/L,测量范围为0.02~100μg/L,平均回收率为88.1%;OTA的灵敏度达到了0.05μg/L,测量范围为0.05~50μg/L,平均回收率为89.9%。
3.2.6 多种真菌毒素的联合检测 当前,单个真菌毒素的检测技术已非常成熟,相关的研究报道也较多,但鉴于真菌毒素毒性强,且存在叠加、增效等互作效应[67],严重威胁人畜健康,各国分析工作者纷纷开始研究多种真菌毒素的联合检测。与单独检测相比,真菌毒素的联合检测方法显示出巨大的优势,不仅缩短了分析时间、提高了食品安全性,同时节约了大量的试剂和能源成本。目前关于AFT和OTA同时检测的方法主要有HPLC和LC-MS/MS方法[68-69];也有研究采用ELISA同时检测AFT和OTA[70]。但是,由于不同种类的真菌毒素在理化性质上存在差异,要同时使每种真菌毒素都达到最佳分析条件将非常困难,这也导致联合检测的灵敏度和平均回收率一般都低于单独检测。本课题组采用分散液液微萃取结合液相色谱分析,研究同时检测大米中的黄曲霉毒素B1、B2和赭曲霉毒素A,取得了较满意的结果[71]。
4 展望
真菌毒素是影响稻米质量安全的主要因素之一,严重危害人类和动物的健康。随着科学技术的发展,真菌毒素的作用机理越来越得到阐明;同时,一些新的真菌毒素也将被发现,并可能显示出更大的危害。因此,真菌毒素的研究必将是21世纪的热门课题之一。我国是水稻的最大生产国,稻米也是我国居民最基本、最重要的主粮,稻米质量安全直接关系到全国人民的健康,涉及到整个国家的粮食安全和社会稳定。鉴于世界范围内稻米真菌毒素的污染形势,结合稻米在我国居民膳食结构的特殊地位及我国研究现状,开展我国稻米中真菌毒素污染水平和发展趋势研究极为重要和紧迫。当前,有关真菌毒素的检测手段在快速发展,但主要是开展一种或几种真菌毒素的检测研究,同时测定多种真菌毒素的报道还较少。对于稻米中真菌毒素的污染控制,除了采取相应的预防和脱毒措施外,对检测技术也提出了更高的要求。因此,建立稻米中多种真菌毒素的同时快速检测方法必将成为当前粮食质量安全领域的一个重要方面,只有改进和完善检测技术,才能确保人畜健康和农产品安全。
[1] 陈宁庆. 实用生物毒素学[M]. 北京:中国科学技术出版社,2001:212-215.
[2]Sweeney MJ,Dobson AD.Mycotoxin production by Aspergillus,Fusarium and Penicillium species[J].International of Journal of Food Microbiology,1998,43(3):141-158.
[3]Schatzmayr G,Zehner F,Taubel M,et al.Microbiologicals for deactivating mycotoxins[J].Molecular Nutrition and Research ,2006,50(6):543-551.
[4]Weidenboerner M.Encyclopedia of food mycotoxins[M]. Berlin:Springer-Verlag,2000:218-220.
[5]World Health Organization(WHO).Aflatoxins.In :Safety evaluation of certain food additives and contamination.WHO Food Additive Series No.40.Report of the 49th Meeting of the Joint FAO/WHO Expert Committee on Food Additives(JECFA)[C].Geneva(Switzerland):WHO;1998,P.359-468.
[6]Juan C,Zinedine A,Idrissi L,et al.Ochratoxin A in rice on the Moroccan retail market[J].International Journal of Food Microbiology,2008(126):83-85.
[7] 黄洁. 黄曲霉毒素检测方法研究进展[J]. 化学分析计量,2013,22(5):100-105.
[8]Tanaka K,Sago Y,Zheng YZ,et al.Mycotoxins in rice[J]. International Journal of Food Microbiology,2007,119:59-66.
[9]吴丹. 黄曲霉毒素在粮食和食品中的 危害 及防治[J]. 粮食加工,2007,32(3):91-94.
[10]陈志飞,王元凯,严亚贤,等.真菌毒素的污染状况及毒性研究[J].检验检疫学刊,2012,22(5):71-76.
[11]IARC.Some naturally occurring substances:items and constituents heterocyclic aromatic amines and mycotoxins. Monographs on the evaluation of carcinogenic risks to humans [C].Lyon,France:International Agency for Research on Cancer,1993:56.
[12]Ringot D,Chango A,Schneider YJ,et al.Toxicokinetics and toxicodynamics of ochratoxin A,an update[J].Chem Biol Interact,2006,159(1):18-46.
[13]Schlatter C,Studer RJ,Rasonyi T.Carcinogenicity and kinetic aspects of ochratoxin A[J].Food Additives and Contaminants,1996,13(1):43-44.
[14]Holzhauser D,Delatour T,Marin-Kuan M,et al.Ochratoxin A:toxicity and carcinogenicity[J].Toxicology Letters,2003,65:144.
[15] 高翔,李梅,张立实. 赭曲霉毒素A的毒性研究进展[J]. 国外医学(卫生学分册),2005,32(1):51-55.
[16]Dowling TS.Fumonisins and its toxic effects[J].Cereal Food World,1997(42):13-15.
[17]Salem NM,Ahmad R.Mycotoxins in food from Jordan:Preliminary survey[J].Food Control,2010(21):1099-1103.
[18]Li R,Wang X,Zhou T,et al.Occurrence of four mycotoxins in cereal and oil products in Yangtze Delta region of China and their food safety risks[J].Food Control,2014,35:117-122.
[19]Logrieco A,Mule G,Moretti A,et al.Toxigenic Fusarium species and mycotoxins associated with maize ear rot in Europe [J].European Journal of Plant Pathology,2002(108):597-609.
[20] 国际稻米年秘书处. 联合国粮食及农业组织.国际稻米年度报告(摘登)[J]. 粮食与饲料工业,2004(10):1-6.
[21]Park JW,Choi SY,Hwang HJ,et al.Fungal mycoflora and mycotoxins in Korean polished rice destined for humans[J]. International Journal of Food Microbiology,2005,103(3):305-314.
[22]Nguyen MT,Tozlovanu M,Tran TL,et al.Occurrence of aflatoxin B1,citrinin and ochratoxin A in rice in five provinces of the central region of Vietnam[J].Food Chemistry,2007(105):42-47.
[23]Reddy K R,Reddy C S,Muralidharan K.Detection of Aspergillus spp.and aflatoxin B1in rice in India[J].Food Microbiology,2009,26(1):27-31.
[24]Mohammadi M,Mohebbi GH,Akbarzadeh S,et al.Detection of Aspergillus spp.and determination of the levels of aflatoxin B1in rice imported to Bushehr,Iran[J].African Journal of Biotechnology,2012,11(38):9230-9234.
[25]Firdous S,Ejaz N,Aman T,et al.Occurrence of aflatoxins in export-quality Pakistani rice[J].Food Addititves and Contaminants Part B,2012,5(2):121-125.
[26]Makun HA,Gbodi TA,Akanya OH,et al.Fungi and some mycotoxins contaminating rice(Oryza sativa) in Niger State,Nigeria[J].African Journal of Biotechnology,2007,6(2):99-108.
[27]Aydin A,Aksu H,Gunsen U.Mycotoxin levels and incidence of mould in Turkish rice[J].Environmental Monitoring and Assessment,2011,178(1-4):271-280.
[28]Fredlund E ,Thim AM ,Gidlund A ,et al.Moulds and mycotoxins in rice from the Swedish retail market[J].Food Additives and Contaminants Part A,2009,26(4):527-533.
[29]Suarez-Bonnet E ,Carvajal M ,Mendez-Ramirez I,et al. Aflatoxin(B1,B2,G1,and G2) contamination in rice of Mexico and Spain ,from local sources or imported[J].Journal of Food Science,2013,78(11):1822-1829.
[30]Gonzalez L,Juan C,Soriano JM,et al.Occurrence and daily intake of ochratoxin A of organic and non-organic rice and rice products[J].International Journal of Food Microbiology,2006,107(2):223-227.
[31]Zinedine A,Soriano JM,Juan C,et al.Incidence of ochratoxin A in rice and dried fruits from Rabat and Sale area,Morocco[J]. Food Additives and Contaminants,2007,24(3):285-291.
[32]Zaied C,Abid S,Zorgui L,et al.Natural occurrence of ochratoxin A in Tunisian cereals[J].Food Control,2009,20(3):218-222.
[33]Bansal J,Pantazopoulos P,Tam J,et al.Surveys of rice sold in Canada for aflatoxins,ochratoxin A and fumonisins[J].Food Additives and Contaminants Part A,2011,28(6):767-774.
[34] 刘笑然,刘娟.2012/2013年度中国稻米产业分析[J]. 中国粮食经济,2014(1):35-38.
[35]Liu ZX,Gao JX,Yu JJ.Aflatoxins in stored maize and rice grains in Liaoning Province,China[J].Journal of Stored Products Research,2006,42(4):468-479.
[36]杨家玲. 我国主要食品中赭曲霉毒素A调查与风险评估[D]. 杨凌:西北农林科技大学,2008.
[37]滕南雁,宋宁宁,刘涛.广西地区市售食用植物油和大米中黄曲霉毒素B1的采样调查和分析[J]. 中国卫生检验杂志,2011,21(6):1531-1532.
[38]Bhatnagar D,Lillehoj EB,Arora DK.Mycotoxins in Ecological Systems[C].FS Chu ,Handbook of applied mycology:Marcel Dekker,New York,1992:87.
[39]杨春蕾,曹学丽.基于液-液萃取机理的新型环境样品前处理方法研究进展[J]. 中国农学通报,2011,27(6):242-248.
[40]Rezaee M,Assadi Y,Milani Hosseini M,et al.Determination of organic compounds in water using dispersive liquid-liquid microextraction[J].Journal of Chromatography A,2006,1116(1-2):1-9.
[41]Arroyo-Manzanares N,Gamiz-Gracia L,Garcia-Campana AM.Determination of ochratoxin A in wines by capillary liquid chromatography with laser induced fluorescence detection using dispersive liquid-liquid microextraction[J].Food Chemistry,2012,135(2):368-372.
[42]Victor-Ortega MD,Lara FJ,Garcia-Campana AM,et al. Evaluation of dispersive liquid-liquid microextraction for the determination ofpatulin in apple juices using micellar electrokinetic capillary chromatography[J].Food Control,2013,31(2):353-358.
[43]Antep HM,Merdivan M.Development of new dispersive liquid-liquid microextraction technique for the identification of zearalenone in beer[J].Analytical Methods,2012,4(12):4129-4134.
[44]Campone L,Piccinelli AL,Celano R,et al.Application of dispersive liquid-liquid microextraction for the determination of aflatoxins B1,B2,G1and G2in cereal products[J].Journal of Chromatography A,2011,1218(42):7648-7654.
[45] 吴芳华. 固相萃取新技术研究进展[J]. 分析测试技术与仪器,2012,18(2):114-120.
[46]李尧,张雪梅,党献民,等.基质分散固相萃取净化液相色谱检测谷物中赭曲霉毒素A[J]. 粮食与饲料工业,2012(10):57-60.
[47] 中华人民共和国出入境检验检疫行业标准(SN/T 1664-2005). 牛奶和奶粉中典曲霉毒素M1、B1、B2、G1、G2含量的测定[S].2005.
[48]Scott PM,Trucksess.Application of immunoaffinity columns to mycotoxin analysis[J].Journal of AOAC International,1997,80(5):941-949.
[49]Uchigashima M,Saigusa M,Yamashita H,et al.Development of a novel immunoaffinity column for aflatoxin analysis using an organic solvent-tloerantmonoclonalantibody[J].JournalofAgricultural and Food Chemistry,2009,57(19):8728-8734.
[50]樊祥,褚庆华,周瑶,等.多功能柱净化-高效液相色谱法检测麦类中赭曲霉毒素A[J].分析实验室,2007,26(S1):284-286.
[51]郑翠梅.高效液相色谱-四级杆-飞行时间质谱法同时测定粮食中13种真菌毒素[D].泰安:山东农业大学,2012.
[52]Karuna R,Sashidhar RB.Use of ion-exchange chromatography coupled with TLC-laser scanning densitometry for the quantization of fumonisin B1[J].Talanta,1999,50(2):381-389.
[53]Sokolovi M,Impraga B.Survey of trichothecene mycotoxins in grains and animal feed in Croatia by thin layer chromatography [J].Food Control,2006,17(9):733-740.
[54]Gao HG,Chen L,Pan GS,et al.Development and Validation of an HPTLC Method for Determination of Aflatoxin B1[J].LC GC North America,2011(S):71-74.
[55]王松雪,鲁沙沙,张艳,等.国内外真菌毒素检测标准制修订现在与进展[J]. 食品工业科技,2011,32(3):408-412.
[56]王阳,曹忠波.柱前衍生高效液相色谱法测定食品中黄曲霉毒素B1、B2、G1、G2[J].中国卫生检验杂志,2011,21(2):344-345.
[57]许梓荣,史莹华,冯建蕾,等.光化学衍生法结合HPLC测定食品和饲料中的黄曲霉毒素[J].中国粮油学报,2005,20(2):71-75.
[58]Soleimany F,Jinap S,Abas F.Determination of mycotoxins in cereals by liquid chromatography tandem mass spectrometry [J].Food Chemistry,2012,130(4):1055-1060.
[59]张占军,王富花.酶联免疫吸附技术及其在食品安全检测中的应用[J]. 食品研究与开发,2011,32(1):157-161.
[60] 张宇昊,杨琳,马良. 真菌毒素同时检测方法研究进展[J].中国粮油学报,2011,26(6):123-128.
[61]Tan M,Song B,Wang G,et al.A new terbium(III) chelate as an efficient singlet oxygen fluorescence probe[J].Free Radical Biology and Medicine,2006,40(9):1644-1653.
[62]Niu CG,Liu J,Qin PZ,et al.A novel bifunctional europium chelate applied in quantitative determination of human immunoglobin G using time-resolved fluorimmunoassay[J]. Analytical Biochemistry,2011,409(2):244-248.
[63]Harma H,Soukka T,Lovgren T.Europium nanoparticles and time-resolved fluorescence for ultrasensitive detection of prostatespecific antigen[J].Clinical Chemistry,2001,47(3):561-568.
[64]Zhang Z,Liu JF,Yao Y et al.A competitive dual-label time resolved fluoroimmunoassay for the simultaneous determination of chloramphenicol and ractopamine in swine tissue[J].Chinese Science Bulletin,2011,56(15):1543-1547.
[65]李静,李培武,张奇,等.时间分辨荧光免疫层析试纸条在油料饼粕黄曲霉素B1检测中的应用[J]. 中国油料作物学报,2014,36(2):256-262.
[66]黄飚,张钰,马智鸿,等.用双标记时间分辨荧光免疫法同时检测黄曲霉素B1和赭曲霉毒素A[J]. 卫生研究,2009,38(4):385-388.
[67]易中华,吴兴利.饲料中常见霉菌毒素间的毒性互作效应[J]. 饲料研究,2009(1):15-18.
[68]Tang YY,Lin HY,Chen YC,et al.Development of a quantitative multi-mycotoxin method in rice,maize,wheat and peanut using HPLC-MS/MS[J].Food Analytical Methods,2013(6):727-736.
[69]Desmarchelier A,Oberson JM,Tella P,et al.Development and comparison of two multiresidue methods for the analysis of 17 mycotoxins in cereals by liquid chromatography elcetrospray ionization tandem mass spectrometry[J].Journal Agricultural and Food Chemistry,2010(58):7510-7519.
[70]Debjani S,Debopam A,Dipika R,et al.Simultaneous enzyme immunoassay for the screening of aflatoxin B1and ochratoxin A in chili samples[J].Analytica Chimica Acta,2007,584:343-349.
[71]Lai XW,Sun DL,Ruan CQ,et al.Rapid analysis of aflatoxin B1,B2,and ochratoxin A in rice samples using dispersive liquidliquid microextraction combined with HPLC[J].Journalof Separation Science,2014,37(1-2):92-98.
Research progress in aflatoxins and ochratoxin A in rice
LAI Xian-wen,ZHANG He,LIU Cheng-lan*
(Key Laboratory of Natural Pesticide and Chemical Biology,Ministry of Education,South China Agricultural University,Guangzhou 510642,China)
Mycotoxins are toxic metabolites produced by some filamentous fungi,which occur in foodstuffs and feeds.They have been a hazard to man and animals.The physical,chemical properties and hazard of aflatoxins and ochratoxin A were introduced.Due to the risk to human and animal health,their contamination situation,the maximum residue levels and analysis method in rice were summarized.The aim was to provide reference for mycotoxins research.
mycotoxins;aflatoxins;ochratoxin A;rice
TS55.1
A
1002-0306(2014)22-0386-06
10.13386/j.issn1002-0306.2014.22.076
2014-05-26
赖先文(1987-),男,硕士研究生,研究方向:真菌毒素污染研究。
* 通讯作者:刘承兰(1976-),男,博士,副教授,研究方向:农产品安全。
国家自然科学基金(31071546)。
