羊栖菜多酚的提取及纯化工艺研究
2014-03-07吕成林汪秋宽宋悦凡任丹丹何云海
吕成林,汪秋宽,宋悦凡,任丹丹,何云海
(大连海洋大学,辽宁省水产品加工及综合利用重点实验室,国家海藻加工技术研发分中心,辽宁大连 116023)
羊栖菜多酚的提取及纯化工艺研究
吕成林,汪秋宽*,宋悦凡,任丹丹,何云海
(大连海洋大学,辽宁省水产品加工及综合利用重点实验室,国家海藻加工技术研发分中心,辽宁大连 116023)
以羊栖菜为原料,研究确定经济高效的羊栖菜多酚提取分离纯化的方法。检测分析乙醇浓度、料液比、提取时间、提取温度参数对多酚粗提物提取率的影响,优化得到羊栖菜多酚粗提物的最佳提取工艺为:乙醇浓度40%、料液比1∶25、提取时间5h、提取温度70℃。以多酚吸附量和解吸率为指标,对10种不同类型的大孔树脂进行了筛选,通过动态吸附与解吸实验,确定大孔树脂的最佳吸附条件。综合分析结果表明大孔树脂NKA-9对羊栖菜多酚的吸附量和解吸率最佳,吸附量和解吸率分别达到0.73mg/g和91%。NKA-9树脂分离最佳工艺条件为:上柱液pH为4,体积为300mL,流速为1mL/min;洗脱液浓度为70%,洗脱液体积为400mL,洗脱流速为1mL/min。
羊栖菜,多酚,大孔树脂,纯化
海藻生物资源丰富,据报道种属超过15000种[1]。与陆地植物相比,海藻具有许多特殊的成分,现已成为海洋生物活性物质的新来源[2]。海藻多酚广泛存在于海藻体内,因其具有抗氧化、抗肿瘤、抗菌、抗病毒[3-5]等多种生物活性,越来越受到人们的关注,是开发利用海洋药物的潜在来源。
羊栖菜,又名鹿角尖、海大麦,隶属于褐藻门、马尾藻科、马尾藻属。中国北起辽东半岛,南至雷州半岛,均有它的分布;以浙江沿海最多。研究表明,我国常见的褐藻(包括海带、裙带菜、鼠尾藻、海黍子、羊栖菜等)均含有数量不等的多酚,而羊栖菜多酚含量高达干重的2%,海黍子2.8%[6]。关于羊栖菜中多酚类物质的提取已有研究,包括传统的溶剂提取法和超声提取法,然而对羊栖菜中多酚的纯化研究却鲜有报道[7]。多酚广泛应用在农业、环保、食品、医药等领域,发挥着重要的作用。多酚类物质在农业上可以起到生物农药和生长激素的作用来抵抗病虫害[8];在生态环境保护中降低废水中的重金属含量,缓解植物酸铝毒害[9-10];在食品工业中还可用作天然的抗氧化剂和保鲜剂[11-12];在医药领域也发挥着抑菌抗病毒、抗癌、预防心血管疾病等重要作用[13-14]。目前关于多酚类物质的提取、分离纯化主要采用的是溶剂提取和大孔树脂纯化。本实验选择了10种大孔吸附树脂纯化羊栖菜多酚,并对其提取工艺和纯化工艺进行了优化,为羊栖菜多酚类物质的开发和利用提供理论依据。
1 材料与方法
1.1 材料与仪器
羊栖菜 购于浙江省温州市,实验前粉碎至粉,备用;大孔树脂ADS-7、ADS-17、NKA-2、NKA-9、H103、S-8、X-5 南开大学化工厂;大孔树脂HPD-750、HPD-BJHQ、AB-8 沧州宝恩吸附材料科技有限公司;无水乙醇、碳酸钠、没食子酸 均为分析纯,天津市富宇精细化工有限公司;福林酚 Sigma。
FW100高速万能粉碎机 天津市泰斯特仪器有限公司;RE-52CS旋转蒸发仪 上海亚荣生化仪器厂;722S分光光度计 上海分析仪器总厂。
1.2 实验方法
1.2.1 标准曲线的制作及羊栖菜多酚含量测定 精确称取没食子酸标准品100mg,蒸馏水定容至1000mL,得到0.1mg/mL的标准溶液。准确吸取没食子酸标准溶液0、0.2、0.4、0.6、0.8、1.0mL,分别置于10mL带盖试管中,加入2.5mL 10%福林酚试剂,反应5min后,加入2mL 7.5%Na2CO3溶液,混匀定容至10mL,避光反应2h,蒸馏水调零,760nm波长处测定吸光度值A[15]。以没食子酸标准溶液的浓度(μg/mL)为横坐标,以吸光度A为纵坐标作没食子酸(GA)标准曲线。
羊栖菜多酚粗提液用蒸馏水定容于100mL容量瓶中,取0.5mL待测样品,加入2.5mL 10%福林酚试剂,反应5min后,加入2mL 7.5%Na2CO3溶液,混匀定容至10mL,避光反应2h,蒸馏水调零,760nm波长处测定吸光度。利用没食子酸(GA)标准曲线计算相应的总酚含量(mgGA样品/g样品提取物干重)。
1.2.2 单因素实验考察羊栖菜多酚粗提物提取工艺条件 称取5.00g羊栖菜粉末,加入1∶20(v/m)的60%乙醇溶液,50℃浸提6h,抽滤,合并上清液,旋转蒸发除去乙醇,测定多酚含量。分析乙醇浓度、料液比、提取时间、提取温度对多酚粗提物提取得率的影响,以多酚含量为检测指标,以乙醇浓度(25%、40%、60%、80%、95%)、料液比(1∶10、1∶15、1∶20、1∶25、1∶30)、提取时间(2、4、6、8、10h)、提取温度(30、40、50、60、70℃)作为实验因素,研究各个因素对羊栖菜多酚粗提物提取率的影响。在单因素实验的基础上,采用4因素3水平正交设计探讨羊栖菜多酚提取的最佳工艺,正交实验因素水平表见表1。

表1 正交实验因素水平表Table 1 The orthogonal factor level table
1.2.3 大孔树脂纯化羊栖菜多酚
1.2.3.1 树脂的预处理及再生 各种大孔吸附树脂用无水乙醇在室温下密封浸泡24h,使其充分溶胀,然后用蒸馏水洗至中性;再用5%的盐酸溶液浸泡12h,蒸馏水洗至中性;最后用5%的NaOH溶液浸泡12h,蒸馏水洗至中性,备用。
树脂每次处理过多酚后需再生,先用无水乙醇浸泡24h,用蒸馏水洗至中性后再按预处理方法用5%盐酸溶液和5%NaOH溶液处理,备用[16]。
1.2.3.2 静态吸附与解吸实验 分别称取预处理好的10种大孔树脂各5g,滤纸吸干表明水分,置于250mL锥形瓶中,加入已知浓度的羊栖菜多酚溶液50mL,于恒温振荡器中,25℃振荡吸附24h,充分吸附后,过滤,测定上清液中多酚浓度。并计算吸附量Q(mg/g)及吸附率E(%)[17]。

式中:C0为吸附前的多酚溶液浓度,mg/mL;C1为吸附后的多酚溶液浓度,mg/mL;V0为多酚粗提液体积mL;m为树脂的质量,g。
树脂静态吸附后,过滤,将吸附饱和后的树脂置于锥形瓶中,加入70%乙醇50mL,置于25℃水浴摇床振荡24h,充分解吸后,计算解吸率D(%)。
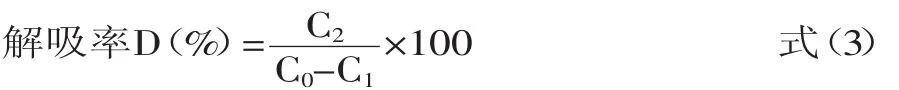
式中:C0为吸附前的多酚溶液浓度,mg/mL;C1为吸附后的多酚溶液浓度,mg/mL;C2为解吸后的多酚溶液浓度,mg/mL。
1.2.3.3 NKA-9树脂动态吸附实验 将预处理好的NKA-9树脂湿法装柱,装入Φ2.6cm×30cm层析柱,蒸馏水平衡,加入一定量的多酚粗品溶液,充分吸附后,先用蒸馏水洗,去除多糖、蛋白质等杂质,再用乙醇溶液洗脱,部分收集,合并含多酚的部分,检测多酚含量。分别考察上样流速(mL/min)、上样体积(BV)、样液pH及洗脱流速(mL/min)、洗脱液体积(BV)、洗脱液浓度对吸附和解吸的影响。
2 结果分析

图1 没食子酸标准曲线Fig.1 Standard curve of gallic acid
2.1 没食子酸(GA)标准曲线
没食子酸标准曲线见图1,以吸光度为纵坐标,标准溶液浓度为横坐标,绘制标准曲线,得线性回归方程Y=0.0859X+0.0291(R2=0.9994),结果表明,没食子酸浓度在0.001~0.010mg/mL范围内线性关系良好。
2.2 羊栖菜多酚提取单因素实验及正交优化结果
2.2.1 乙醇浓度对多酚粗提物提取得率的影响 乙醇浓度对羊栖菜多酚粗提物得率的影响见图2。由图2可知随着乙醇浓度的升高,羊栖菜多酚粗提物得率有上升的趋势,但当乙醇浓度超过40%时羊栖菜多酚粗提物得率开始下降。这是因为乙醇浓度过高会使醇溶性杂质、色素成分溶出,导致提取率下降,而乙醇浓度较低时,褐藻胶等糖类物质和水互溶影响多酚的提取得率,因此本实验选择30%、40%、50%作正交优化实验。
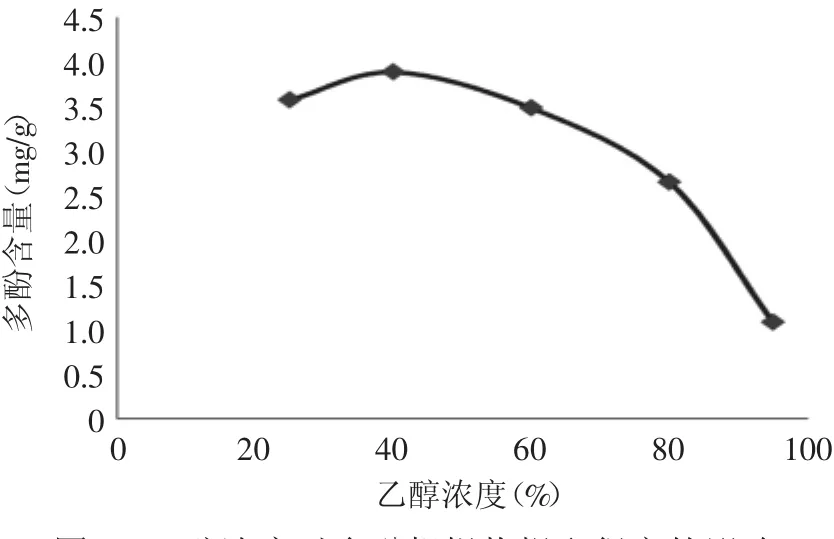
图2 乙醇浓度对多酚粗提物提取得率的影响Fig.2 Effect of ethanol concentration on extraction of polyphenols
2.2.2 料液比对多酚粗提物提取得率的影响 料液比对羊栖菜多酚粗提物得率的影响见图3,由图3可知随着料液比不断加大,多酚粗提物得率逐渐增大,当料液比超过1∶20时多酚粗提物得率开始下降,料液比过高,醇溶性杂质浸出率增高,对后续处理不利,同时造成溶剂的浪费。因此本实验选择选择1∶15、1∶20、1∶25作正交优化实验。

图3 料液比对多酚粗提物提取得率的影响Fig.3 Effect of liquid to solid ratio on extraction of polyphenols
2.2.3 提取时间对多酚粗提物提取得率的影响 提取时间对羊栖菜多酚粗提物得率的影响见图4。由图4可知随着提取时间的增加,多酚粗提物得率逐渐升高,当提取时间为6h时,多酚含量达到最高。而过长时间的提取并不能显著增加多酚的提取效率。提取时间过长,多酚易发生降解、氧化等化学反应致使多酚分子结构发生一定的破坏,综合考虑,本实验选择4、5、6h作正交优化实验。

图4 时间对多酚粗提物提取得率的影响Fig.4 Effect of time on extraction of polyphenols
2.2.4 温度对多酚粗提物提取得率的影响 提取温度对羊栖菜多酚粗提物得率的影响见图5。由图5可知温度对多酚粗提物的提取率具有显著的影响。随着温度的升高,提取率逐渐上升。温度升高,提取液的粘度下降,分子运动加速,氢键更易断裂,多酚的渗透、溶解、扩散速度也加快,因而多酚类物质更易于溶出。但温度过高也会使多酚发生氧化或者降解等一些不可逆的化学反应[18-19],同时也会增加相应的生产成本,因此本实验选择50、60、70℃作正交优化实验。

图5 温度对多酚粗提物提取得率的影响Fig.5 Effect of temperature on extraction of polyphenols
2.2.5 正交实验结果分析 实验结果见表2。根据表2极差分析R的大小,决定因素的影响次序。各因素对羊栖菜多酚粗提物得率影响大小顺序为C>D>A>B,即料液比>提取温度>乙醇浓度>提取时间。按照各因素的最优水平选取理论最佳组为C3D3A2B2,即料液比1∶25、提取温度70℃、乙醇浓度40%、提取时间5h,此时总酚含量为:4.60±0.05(mgGA/g),高 于 最 佳 优化 实 验 组 C2D3A2B1提 取 的 总 酚 含 量 4.45(mgGA/g)。
2.3 各种树脂对羊栖菜多酚粗提物的吸附与解吸
按1.2.3.2的方法测定十种不同树脂对羊栖菜多酚粗提物的静态吸附和解吸情况,结果见表3,由表3可知NKA-9大孔树脂效果最好,其树脂结构为交联聚苯乙烯,对生物碱的分离,黄酮、多酚类物质的提取具有显著的效果。虽然ADS-7和S-8两种树脂的吸附性能良好,但其解吸率却很低,其树脂极性较强,对多酚吸附牢固,解吸较为困难。而NKA-9树脂吸附率适中,解吸效果极佳,从产品回收的角度出发,本实验选用NKA-9树脂分离纯化羊栖菜多酚粗提物,并进行进一步的优化实验。
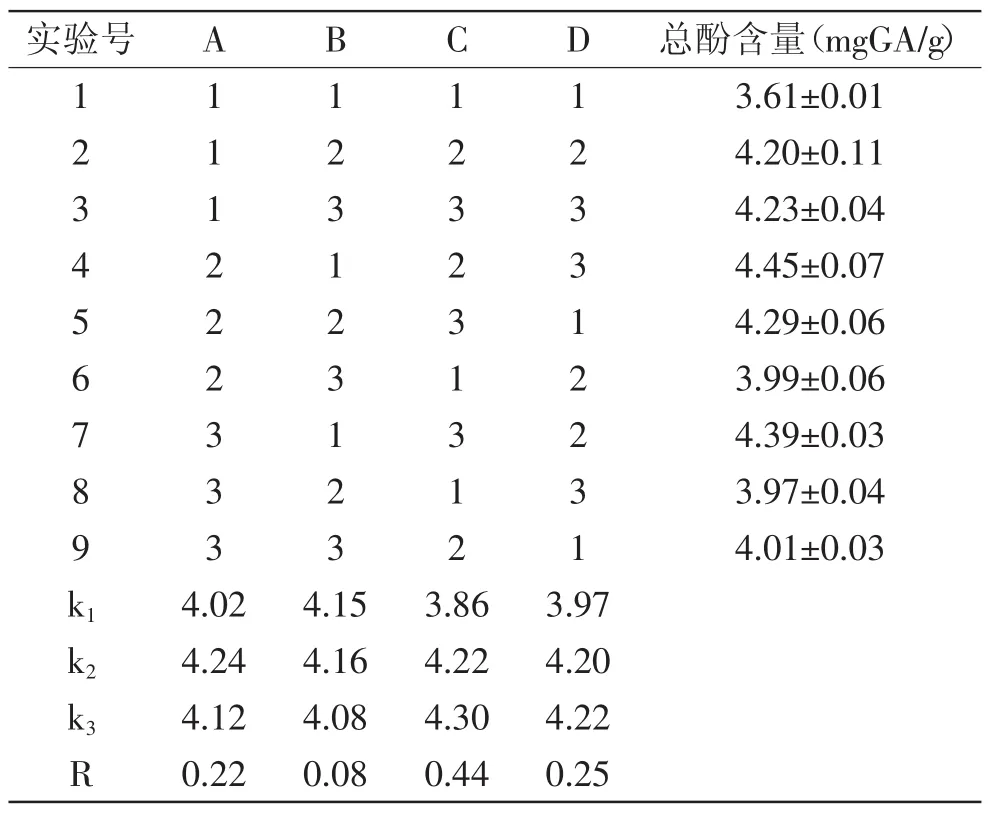
表2 L9(34)正交实验表Table 2 Orthogonal test table

表3 多酚的吸附与解吸性能比较Table 3 The adsorption and desorption properties of polyphenols compared
2.3.1 上样流速对吸附的影响 上样速度主要是影响溶质向树脂表面的扩散,流速不同则树脂达到吸附饱和时的吸附量也不同。上样速度慢,虽有利于树脂对多酚物质的吸附,但也会延长树脂达到吸附饱和的时间,降低树脂吸附的效率。但当上样速度过快时,溶液中的多酚物质还未扩散到树脂的内表面,就被冲出柱子,从而造成树脂吸附率的下降[20]。吸光度值可直接反映多酚含量的多少,为了便于比较,以吸光度值作为参照标准,下文保持一致。从图6中可以看出,不同的上样速率,多酚的泄露点和饱和点不同,考虑到吸附的高效性和降低样液的浪费,要尽可能的快速吸附,并提高多酚的吸附量。因此,控制上样速度为1.0mL/min较好。
2.3.2 样液体积对吸附的影响 按1.2.3.3的方法上柱,控制流速为1mL/min,充分吸附饱和后,测定羊栖菜多酚在NKA-9大孔树脂上的动态吸附曲线。如图7所示,当流出液体积达到300mL左右时吸附达到饱和,流出液浓度基本不变,说明NKA-9大孔树脂对羊栖菜多酚具有较好的动态吸附性能,从而确定上柱液的体积。

图6 流速对多酚吸附的影响Fig.6 Effect of feeding rate on adsorption
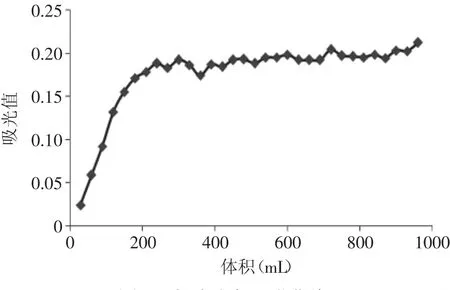
图7 多酚动态吸附曲线Fig.7 Dynamic adsorption curve of polyphenols
2.3.3 样液pH对吸附影响 如图8所示,溶液的pH过高或过低时,树脂的吸附量都相对较低。当溶液的pH为4时,树脂对羊栖菜多酚的吸附量最高。羊栖菜多酚提取液中含有一些酚酸类物质,其提取液呈酸性[21],因此酸性条件下有利于多酚物质的吸附,所以调整溶液pH为4,可提高树脂的饱和吸附量。
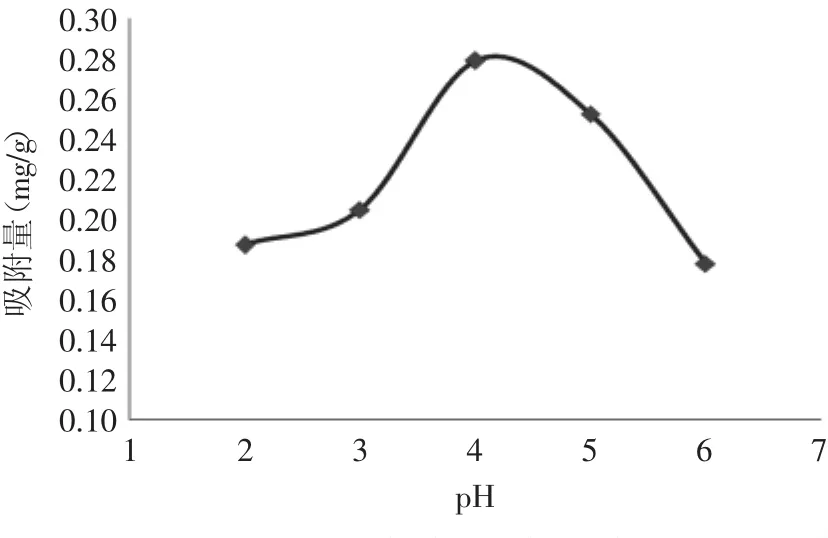
图8 pH对多酚吸附的影响Fig.8 Effect of pH value on adsorption
2.3.4 洗脱液浓度对解吸的影响 本实验选择无毒的乙醇作为解吸剂。选取50%、60%、70%、80%、90%等五种不同浓度的乙醇溶液对静态饱和吸附的树脂进行解吸,比较上清液多酚含量。由图9可知,随着乙醇溶液浓度的升高,解吸率也随之增加,因为较低浓度的乙醇无法有效地破坏树脂与多酚之间形成的氢键,导致解吸率较低[22]。当乙醇浓度增加到70%时,解吸率最高,继续增加乙醇浓度解吸率下降,虽然也相对较高。但考虑到高浓度乙醇易挥发且增加生产成本,因此选择70%的乙醇溶液作为解吸剂。

图9 乙醇浓度对解吸率的影响Fig.9 Effect of the concentration of ethanol on desorption ratio
2.3.5 洗脱液体积解吸的影响 根据上述实验确定的吸附条件饱和吸附后,用70%的乙醇溶液以1mL/min进行洗脱,绘制洗脱曲线,观察多酚含量与洗脱剂用量的关系。如图10所示,当洗脱液体积达到75mL时多酚开始洗脱出来,洗脱液体积达到400mL时,多酚基本都被洗脱下来,结果表明,NKA-9大孔树脂具有良好的洗脱性能,洗脱体积确定为400mL。

图10 多酚动态解吸曲线Fig.10 Dynamic desorption curve of polyphenols
2.3.6 洗脱流速对解吸的影响 根据上述实验确定的吸附流速,选择0.5、1.0、1.5、2.0、2.5mL/min五个洗脱流速来考察动态洗脱的效果。从图11可以看出,不同的洗脱速率对洗脱效果有较大的影响。较低的流速能增加洗脱剂在树脂柱中停留的时间,有利于洗脱剂向树脂内部扩散,同样也会增加工作周期;而流速过快,洗脱剂不能与被吸附的多酚进行充分作用而将其从树脂的吸附位点置换出来,洗脱不完全,效率很低[23]。因此选取1.0mL/min为最佳洗脱流速。

图11 流速对多酚解吸的影响Fig.11 Effect of elution rate on desorption
3 结论
3.1 正交优化羊栖菜多酚的最佳提取工艺:乙醇浓度40%、料液比1∶25、提取时间5h、提取温度70℃。
3.2 多酚含量测定的没食子酸标准曲线:Y=0.0859X+ 0.0291(R2=0.9994),线性关系良好。
3.3 运用静态吸附与解吸实验筛选出适用于羊栖菜多酚分离纯化的大孔树脂NKA-9。
3.4 通过羊栖菜多酚在NKA-9树脂上的动态吸附研究,确定了最佳吸附条件为:上样流速1min/mL、上样体积300mL、样液pH4.0;最佳洗脱条件为:洗脱流速1mL/min、乙醇浓度70%、洗脱体积400mL。且经树脂纯化后得到的羊栖菜多酚纯度达到干基的11.4%。
[1]于曙光. 褐藻多酚化合物提取、纯化及生物活性研究[D].青岛:青岛大学,2003.
[2]Yong-xin Li,Isuru Wijesekara,Yong Li,et al.Phlorotannins as bioactive agents from brown algae[J].Process Biochemistry,2011,46:2219-2224.
[3]Masaaki Nakai,Norihiko Kageyama.Phlorotannins as radical scavengers from the extract of sargassum ringgoldianum[J]. Marine Biotechnology,2006,13:409-413.
[4] 魏玉西,孙峋,等.鼠尾藻 多酚的抗肿 瘤活性研究[J]. 中草药,2008,39(1):93-95.
[5]林超,于曙光,郭道森,等.鼠尾藻中褐藻多酚化合物的抑菌活性研究[J]. 海洋科学,2006,30(3):94-97.
[6] 严小军.中国常见褐藻的多酚含量测定[J]. 海洋科学集刊,1996,37:61-64.
[7]Yinping Li,George K Skouroumounis,Gordon M Elsey,et al. Microwave-assistance provides very rapid and efficient extraction of grape seed polyphenols[J].Food Chemistry,2011,129:570-576.
[8]武予清,郭予元.棉花单宁-黄酮类化合物对棉铃虫的抗性潜力[J]. 生态学报,2001,21(2):286-289.
[9] 张力平,孙长霞. 落叶松单宁挣化有毒金属离子的研究[J].林产工业,2004,31(2):32-34.
[10]Lu J-L.Effect of tea polyphenols on the growth of acid and aluminium sensitive plants[J].Tea Sci,1997,17:137-140.
[11]孙建霞,孙爱东,白卫滨,等.苹果多酚的提取工艺及其对油脂的抗氧化作用[J]. 食品与发酵工业,2005,37(3):122-124.
[12] 周玲. 天然抗氧化剂-茶多酚的应用[J].中国食品添加剂,2005(4):96-99.
[13]Cai Y Z,Luo Q,Sun M,et al.Antioxidant activity and phenolic compounds of 112 traditional Chinese medicinal plants associated with anticancer[J].Life Sciences,2004,74:2157-2182.
[14]袁静,余新欣,章复清.茶多酚调脂及抗脂质过氧化作用的实验研究[J]. 陕西中医学院学报,2003,23(3):37.
[15]López A,Rico M,Rivero A,et al.The effects of solvents on the phenolic contents and antioxidant activity of stypocaulonscoparium algae extracts[J].Food Chemistry,2011 ,125(3):1104-1109.
[16]李建新.1-MCP对苹果贮藏期间多酚物质含量变化的影响及苹果多酚的纯化、功效研究[D].郑州:河南农业大学,2008.
[17] 白蕾. 海 带多酚的分 离提取及其 抗肿 瘤 活 性研究[D]. 大连:大连理工大学,2008.
[18]王如,宿文斌,王承明,等.黄连木饼粕粗多酚提取的响应曲面优化研究[J]. 食品科学,2008,29(7):160-165.
[19] 刘清. 大麦多酚化合物的提取、纯化及功 能性质研究[D].无锡:江南大学,2007.
[20] 郭娟. 苹果渣中苹果多酚的提取、纯化及功效研究[D]. 郑州:河南农业大学,2006.
[21]王育红.大孔树脂吸附苹果多酚特性及苹果多酚功效研究[D].郑州:河南农业大学,2007.
[22]叶燕彬,李希璇,郜文,等.大孔吸附树脂分离纯化元宝枫叶总多酚[J]. 首都医科大学学报,2010,31(5):629-632.
[23]黄阿根,董瑞建,谢凯舟.茶树花多酚大孔树脂纯化工艺研究[J]. 农业工程学报,2007,23(9):239-244.
Study on the extraction and purification of polyphenols from Sargassum fusiforme
LV Cheng-lin,WANG Qiu-kuan*,SONG Yue-fan,REN Dan-dan,HE Yun-hai
(Key Laboratory of Aquatic Product Processing and Utilization of Liaoning Province,National R&D Branch Center For Seaweed Processing(Dalian),Dalian Ocean University,Dalian 116023,China)
Studies were carried out on the technology for separating polyphenols crude extract from Sargassum fusiforme efficiently and economically.The ethanol concentration,solid-liquid ratio,extraction time and extraction temperature were optimized by orthogonal test depending on their effects on polyphenols crude extract extracting yield.The optimized factors were ethanol concentration of 40% ,solid-liquid ratio 1∶25,extraction time 5h and extraction temperature 70℃ .Ten different types of macroporous resin were surveyed and selected when the adsorption capacity and desorption rate taken as indicators.The adsorption conditions of the selected macroporous resin were determined by dynamic adsorption and desorption experiment.The results showed that NKA-9 resin had the best adsorption capacity and static desorption rate for the polyphenols from Sargassum fusiforme.The adsorption capacity and desorption rates were 0.73mg/g and 91%respectively.The optimum conditions for elution were column liquid pH4,liquid column volume 300mL,feeding rate 1mL/min;eluent concentration 70%,eluent volume 400mL,elution rate 1mL/min.
Sargassum fusiforme;polyphenols;macroporous resin;purification
TS254
B
1002-0306(2014)22-0231-06
10.13386/j.issn1002-0306.2014.22.042
2014-03-17
吕成林(1988-)男,硕士研究生,研究方向:食品生物技术。
* 通讯作者:汪秋宽(1962-),女,硕士研究生,教授,研究方向:海藻精深加工关键技术及综合利用。
公益性行业(海洋)科研专项(201405040)。
