骨蛋白水解物和魔芋复配对冷冻鱼糜抗冻效果的研究
2014-03-07吕鸿皓董福家武淑影夏秀芳
黄 莉,吕鸿皓,董福家,武淑影,夏秀芳,费 楠
(东北农业大学食品学院,黑龙江哈尔滨 150030)
骨蛋白水解物和魔芋复配对冷冻鱼糜抗冻效果的研究
黄 莉,吕鸿皓,董福家,武淑影,夏秀芳*,费 楠
(东北农业大学食品学院,黑龙江哈尔滨 150030)
通过骨蛋白水解物抗氧化实验和魔芋凝胶特性实验,确定了高抗氧化活性的骨蛋白水解物和高凝胶性的魔芋最佳使用量分别为4%、0.5%,并将二者复配添加到鲤鱼鱼糜中,与商业抗冻剂进行对比,通过测定鱼糜的保水性(蒸煮损失、汁液损失)、硫代巴比妥酸(TBARS)及肌肉蛋白的凝胶特性(硬度、弹性、保水性、白度),研究其对冷冻鱼糜(-18℃下贮藏180d)的保护效果。结果表明:鲤鱼鱼糜冻藏180d,添加骨蛋白水解物和魔芋样品的汁液流失、蒸煮损失、TBRAS、羰基含量分别比对照组降低了62.71%、50.25%、71.83%、36.51%;而蛋白凝胶的硬度、弹性、保水性、白度分别比对照组增加了52.80%、42.19%、10.67%、12.88%(p<0.05),其各项指标相比商业抗冻剂组分别提升了15.79%、6.45%、36.17%、10.00%、14.78%、14.55%、3.55%、4.84%。这说明骨蛋白水解物和魔芋复配后可有效抑制冷冻鱼糜在冻藏过程中脂肪氧化、蛋白质变性的发生,并能有效地提高鱼糜保水性和凝胶特性。因此,冷冻鱼糜抗冻剂的最佳配方为:骨蛋白水解物添加量4%,魔芋添加量0.5%。
冷冻鱼糜,骨蛋白水解物,魔芋
鱼糜制品具有加工简单、细嫩美味、营养丰富等特点,为了较长时间保存鱼糜制品,其大部分制品均储藏在冷冻条件下,在冻藏过程中鱼糜制品易发生蛋白质和脂肪氧化,导致其营养价值流失以及功能特性的降低。目前有效抑制蛋白质变性的方法就是向鱼肉制品中添加抗冻剂[1]。传统抗冻剂如糖类、磷酸盐[2]等虽然能够有效抑制蛋白质冷冻变性,但加入后会使味道变甜,影响口感。而新型抗冻剂如聚葡萄糖、麦芽糊精[3]等由于价格及食品法规等问题,推广也受到限制。因此,寻找新型的高效、健康、天然的抗冻剂成为了水产品储藏过程中的又一重大问题。
骨蛋白水解物是用蛋白酶水解骨蛋白得到一种酶解物,其产物是多肽和游离氨基酸,其易于人体消化吸收,具有独特的营养功效[4]。Wang[5]将马铃薯蛋白水解物添加到熟牛肉糜中,通过实验证明水解物能够较强的抑制脂肪氧化。刁静静等[6]对骨蛋白水解物的水解条件进行优化,并将其应用于卵磷脂脂质氧化体系中,研究表明,骨蛋白具有较高的抗氧化能力。
纯 化 魔 芋 精 粉 ,俗 称 魔 芋 葡 甘 聚 糖(Konjac glucomannan,KGM)。因为KGM具有良好的乳化性、吸水性、稳定性、成膜性及凝胶形成能力,所以可作为食品的添加剂。
虽然有蛋白水解物应用肉制品和骨蛋白水解物抗氧化能力的研究,但将骨蛋白水解物应用于抑制鱼肉制品的脂肪氧化及蛋白质变性却未见报道,本研究将魔芋精粉(KGM)和骨蛋白水解物作为抗冻剂加入鲤鱼鱼糜中来提高鱼糜品质、延长鱼糜制品货架期,为鱼糜制品的精深加工提供技术支持。
1 材料与方法
1.1 材料与仪器
新鲜鲤鱼(平均质量1.15~1.25kg) 购于哈尔滨家乐福超市;95%蛋白质含量的猪骨蛋白水解物干粉 北京中海康源科技有限公司;魔芋精粉 明瑞化工产品有限公司;其他试剂 均为国产分析纯。
GL-21M型高速冷冻离心机 湖南湘仪科学仪器设备有限公司;LG10-2.4A型高速离心机 北京医用离心机厂;日本电色ZE-6000型色差仪 上海首立实业有限公司;HR2870型搅拌机 珠海经济特区飞利浦家庭电器有限公司;721型可见分光光度计 上海元析仪器有限公司;TA-XT plus型质构分析仪 英国Stable Micro System公司。
1.2 实验方法
1.2.1 骨蛋白水解物抗氧化能力的测定
1.2.1.1 金属离子螯合能力的测定 金属离子螯合能力的测定参照Wang等[5]的方法。a.对Cu2+的螯合,b.对Fe2+的螯合。
1.2.1.2 清除自由基能力的测定 参照Bougatef等[7]的方法,并略作修改。取骨蛋白质水解液0.5mL及1×10-4mmol/L DPPH溶液3.5mL加入同一带塞试管中摇匀,在室温下密闭静置30min,用纯溶剂作参比,于517nm处测吸光度。根据公式计算每种水解液对DPPH自由基的清除率:
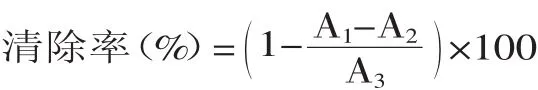
式中,A1为加水解液后DPPH溶液的吸光度;A2为水解液的吸光度;A3为未加水解液时DPPH溶液的吸光度。
1.2.1.3 卵 磷 脂 脂 质 氧 化 体 系 ( soybean phosphatidylcholine liposome,liposome)的制备 参照Decker等[8]的方法,并稍作修改。称取一定量的大豆卵磷脂溶于0.12mol·L-1KCl,5mmol/L组氨酸缓冲溶液(pH6.8)中,制成0.2mg·mL-1卵磷脂溶液,均质,并在4℃下超声处理45min。然后取5mL的卵磷脂脂质体,加入1mL骨蛋白水解物,向混合物中加入0.1mL
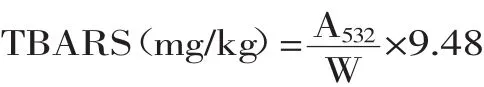
式中:A532为溶液的吸光值;W为样品的重量(g);9.48为常数。
1.2.2 魔芋特性的测定
1.2.2.1 魔芋凝胶的制备 将不同添加量魔芋(0.3%、0.4%、0.5%、0.6%、0.7%)加入肌原纤维蛋白中配制成40mg/mL的肌原纤维蛋白溶液,将溶液放入25mm× 40mm(Diameter×Height)密 封 的 玻 璃 瓶 中 ,置 于80℃的水浴锅中加热30min,形成凝胶后取出用自来水冷却至室温,贮藏在2~4℃的冰箱中过夜,待测。制备好的凝胶在每次分析前要放在室温下(25~27℃)平衡30min。
1.2.2.2 凝胶特性的测定 凝胶质构(TPA)的测定将肌原纤维蛋白凝胶在室温下放置30min,将待测样品置于测定平台上固定好,室温下利用物性分析仪进 行 测 量 。 用 质 构 剖 面 分 析 方 法(Texture profile analyse,TPA)测定凝胶的硬度、弹性指标。选用的物性仪参数如下:测定模式选择下压距离,测试前速度为5mm/s,测试速度为1mm/s,测试后速度为1mm/s,下压距离为凝胶高度的50%,触发力为5g,探头型号选择P/0.5。室温下进行检测,每个样品进行三次平行实验,结果取平均值。
凝胶白度值的测定:使用色差计测定凝胶的L*值,a*值,b*值。L*值代表亮度,刻度从0(黑色)到100(白色);a*值代表红度(a*值为正值表示红色,a*值为负值表示绿色),b*值表示黄度(b*值为正值表示黄色,b*值为负值表示蓝色)。所有样品做三次平行实 验 结 果 取 平 均 值 。 根 据 Gipsy[10]的 方 法 计 算 白 度(Whiteness):50mmol/L FeCl3和0.1mL 10mmol/L抗坏血酸钠引发脂质氧化,然后将样品放在37℃水浴中保温1h,通过测定硫代巴比妥酸反应物质(thiobarbituric acid-reacitive substances,TBARs)研究脂肪氧化情况。
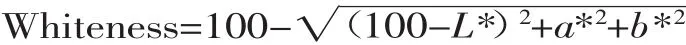
1.2.1.4 TBARS的测定 TBARS的测定参照Fan等[9]的方法,并作适当修改。取1mL样品加入3mL硫代巴比妥酸溶液、17mL三氯乙酸-盐酸溶液,混匀后,沸水浴中反应30min,冷却,取5mL样品加入等体积的氯 仿 ,3000r/min下 离 心10min,532nm 处 测 吸 光 值 。TBARS值以每升脂质氧化样品溶液中丙二醛的毫克数表示。计算公式:
凝胶保水性的测定:凝胶保水性(Water-holding capacity,WHC)的测定,根据Xia[11]的方法。
1.2.3 原料肉的处理及指标的测定
1.2.3.1 鲤鱼鱼糜样品的制备和贮藏 将新鲜鲤鱼在冷藏条件(4℃)下击晕,去除鱼鳞、内脏和鱼皮,选取白肉用搅碎机搅成鱼糜,并将4%骨蛋白水解物、0.5%魔芋及商业抗冻剂加入鱼糜中,混匀,在-18℃下冻藏180d,每隔30d对样品的各项指标进行测定。
1.2.3.2 鲤鱼鱼糜保水性的测定 汁液损失的测定:按照 AOAC[12]的方法进行,按照以下公式来计算:

蒸煮损失率测定:按照Samchez-Alonso等[14]的方法进行。
1.2.3.3 鲤鱼脂肪氧化指标的测定 TBARS的测定方法同1.2.1.4。
1.2.3.4 鱼糜肌原纤维蛋白的提取 根据Jiang等[13]的方法,并稍加修改。将鱼肉搅碎,加入四倍体积的冰磷酸盐缓冲溶液(磷酸氢二钠和磷酸二氢钠)用搅拌器匀浆60s,在(4℃,9500×g)离心15min。重复上述步骤2次,最后用4层纱布过滤,所得滤液离心,然后用0.1mol/L冰NaCl溶液冲洗,离心所得沉淀物即为肌原纤维蛋白。放置在4℃的冰箱内备用,鲤鱼肌原纤维蛋白的提取过程在4℃条件下操作。
1.2.3.5 鲤鱼鱼糜蛋白羰基含量的测定 羰基含量的 测 定 参 照Carney等[14]的 方 法 并 略 做 改 动 ,方 法 如下:取1mL 2g/mL的肌原纤维蛋白溶液放入塑料离心管 ,每 管 中 加 入 1mL 10mmol/L 2 ,4- 二 硝 基 苯 肼(DNPH),室温下反应1h(每1min旋涡振荡一次)后,添加1mL 20%三氯乙酸,10000r/min离心5min,弃清液,用1mL乙酸乙酯∶乙醇(1∶1)清洗沉淀3次除去未反应的试剂,加3mL 6mol/L盐酸胍溶液后置于37℃条件下水浴保温15min溶解沉淀,再将反应液10000r/min离心3min除去不溶物质,所得沉淀在370nm处测吸光值。使用分子吸光系数22000L/(mol·cm)计算羰基含量,羰基含量表示为nmol/mg蛋白。
1.2.3.6 鲤鱼蛋白凝胶特性的测定 鱼糜凝胶质构、白度值、持水力测定方法同1.2.2.2。
1.2.4 数据处理 每个实验平行三次。数据统计分析采用Statistix 8.1(分析软件,St Paul,MN) 软 件进行,使用Tukey HSD程序进行差异显著性(p<0.05)分析,采用Sigmaplot 10.0 软件作图。
2 结果与讨论
2.1 骨蛋白水解物抗氧化实验
不同浓度骨蛋白水解物的抗氧化能力比较结果如表1所示。由表1可知,Cu2+螯合能力、Fe2+螯合能力、清除自由基及抑制氧化的能力均随骨蛋白水解物添加量的增加呈上升趋势,骨蛋白水解物的含量从0%增加至4%时,Cu2+螯合能力、Fe2+螯合能力、清除自由基分别增加了13.63%、6.83%、28.83%,TBRAS值降低了0.99mg·L-1;而当添加量从4%增加到6%时,上述各项指标分别变化了5.12%、2.25%、8.02%及0.14mg·L-1,综合考虑确定骨蛋白水解物的添加量为4%。
2.2 不同浓度魔芋凝胶特性实验
不同添加量魔芋凝胶特性的比较结果如表2所示。由表2可知,随着魔芋添加量的增加,肌原纤维蛋白凝胶的弹性、硬度、白度及持水力均不断增大。这说明凝胶具有较好的凝胶形成能力,可提高鱼糜制品的质量[15],其中当添加量从0%增加至0.5%时,各项指标增加的幅度均比较显著(p<0.05),其弹性、硬度、白度及持水力分别增加了0.013、1.86g、4.43和7.35%;而当魔芋添加量从0.5%增加到0.7%时,各项指标分别增加了0.003、0.29g、0.32及1.46%。所以魔芋添加量在0.5%时其凝胶特性最佳,当添加量达到0.5%后,随着添加量的增加其凝胶效果增长的并不明显(p>0.05)。
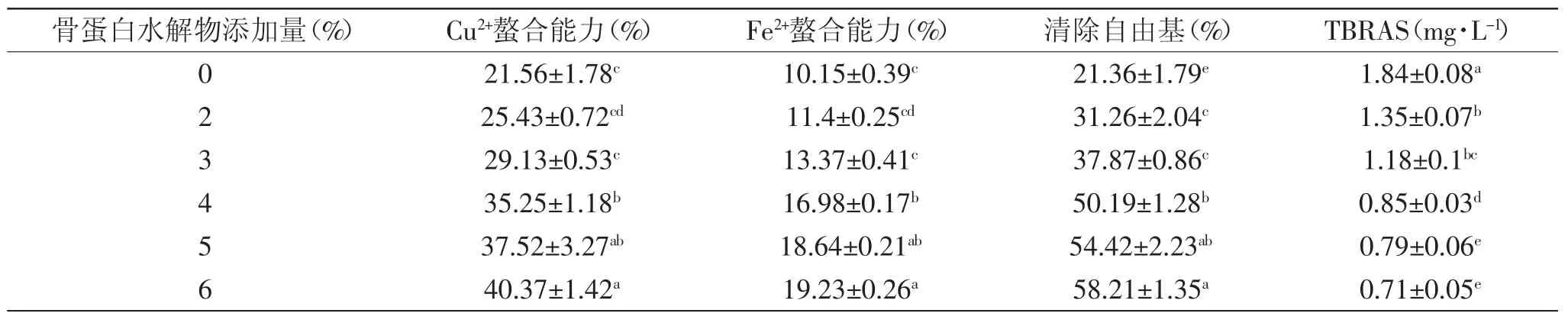
表1 骨蛋白水解物抗氧化能力Table 1 Antioxidant capacities of bone protein hydrolysates
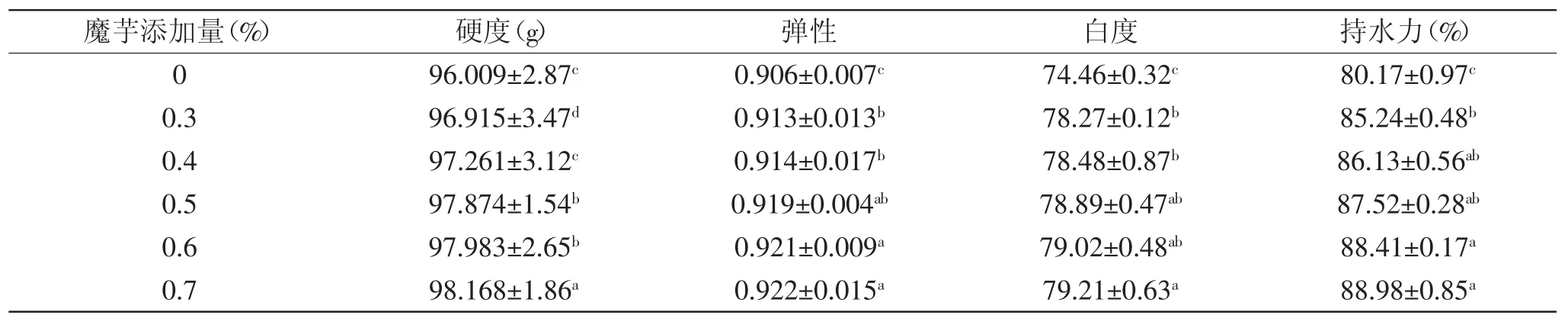
表2 魔芋凝胶的特性Table 2 Gel properties of konjac gel
2.3 骨蛋白水解物与魔芋复配对冻藏鲤鱼鱼糜质量的影响
2.3.1 鱼糜保水性的测定 鱼糜的汁液流失和蒸煮损失是衡量鱼糜保水性的很重要的两个指标[16],由图1可以看到,随着冻藏时间的延长,所有样品的汁液流失率和蒸煮损失率均呈上升趋势,其中对照组样品上升的幅度明显要大于添加骨蛋白和魔芋复配组及商业抗冻剂组。冻藏至180d,骨蛋白水解物和魔芋复配组样品的汁液流失、蒸煮损失相比对照组分别降低了62.71%、50.25%。这主要是由于长时间贮藏导致肌肉结构发生变化,造成原肌球蛋白网状结构的收缩、肌球蛋白的变形和胞外空间的增大等,致使鱼糜的保水性降低;而骨蛋白水解物与魔芋复配组其保水性降低的比较缓慢,至冻藏结束期,其汁液流失率和蒸煮损失率甚至低于商业抗冻剂组,这是因为魔芋和骨蛋白水解物复配后具有很强的吸水性,可提高鱼糜的保水性,这与张静雅[17]研究所得的结论相一致。
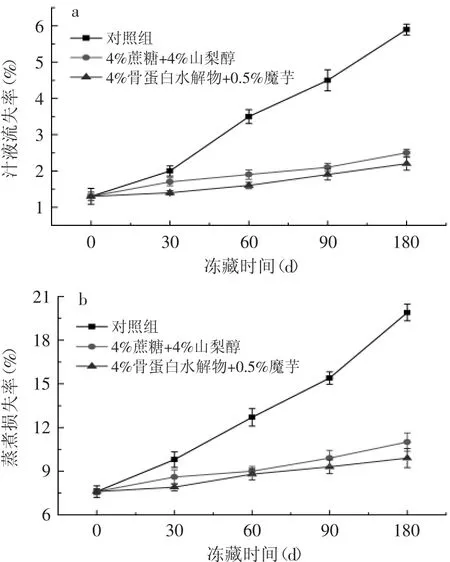
图1 不同添加物对冻藏鲤鱼鱼糜汁液流失率和蒸煮损失率的影响Fig.1 Effect of different additives on the juice and cooking loss ratio of minced carp during frozen storage
2.3.2 鱼糜硫代巴比妥酸(TBRAS)测定 TBARS值广泛应用于测定肉类和水产品脂肪的氧化酸败程度,是较好的脂肪氧化评价指标[18]。由图2可以看出,在贮藏期的前15d,所有鱼糜样品的TBRAS值并没有明显差异(p>0.05),这说明在开始阶段,鱼肉还比较新鲜,脂肪氧化程度不高。而随后TBARS值随着贮藏时间的延长明显升高,特别是对照组的样品,在贮藏后期TBRAS值增加的幅度很大,说明随着贮藏时间的延长,鱼肉脂肪氧化的程度变大,鱼肉的品质明显降低。相比对照组样品,骨蛋白水解物与魔芋复配组及商业抗冻剂组的样品TBRAS增加的幅度则没有那么明显(p>0.05),其中至贮藏结束,骨蛋白水解物与魔芋复配组和商业抗冻剂组相比,其TBRAS值相差并不显著(p>0.05),这可能是由于骨蛋白水解物与魔芋复配对脂肪氧化具有较好的抑制效果,起到了有效的保护作用。
2.3.3 鱼糜蛋白羰基含量的测定 冻藏过程中鲤鱼肌原纤维蛋白羰基含量的变化如图3所示,随着冻藏时间的延长,所有样品中羰基含量发生明显增加(p<0.05)。贮藏相同时间,商业抗冻剂组及复配组样品的羰基含量要低于对照组,至贮藏期结束,商业抗冻剂组及复配组与对照组相比,羰基含量分别降低了1.3、1.8nmol/mg。实验结果表明,长时间冻藏导致了鲤鱼肌原纤维羰基含量的增加。羰基的形成(醛基和酮基)是蛋白质氧化后一个显著变化,被广泛地用于测量蛋白质的氧化程度。羰基可以通过以下四种途径产生:a.氨基酸侧链直接氧化;b.肽骨架的断裂;c.还原糖反应;d.结合非蛋白羰基化合物。在侧链上带有NH-或NH2-的氨基酸对羟基自由基(·OH)非常敏感。在蛋白氧化过程中,这些基团被转化成羰基基团[19]。本实验研究发现,骨蛋白水解物和魔芋可以有效地降低羰基含量,这主要是因为骨蛋白水解物和魔芋复配后会与脂游离基发生反应形成不活泼的物质,通过稳定氢过氧化物以防止进一步生成自由基而达到抗氧化的效果,从而延缓蛋白质氧化的发生[20]。
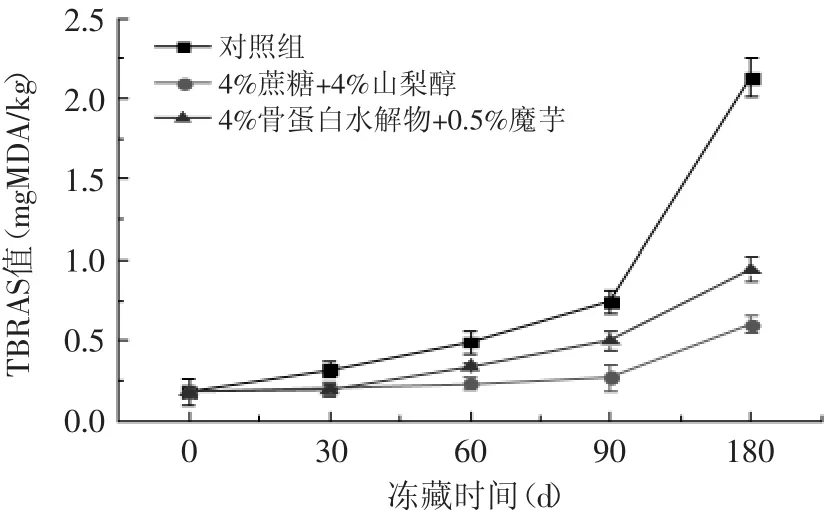
图2 不同添加物对冻藏鲤鱼鱼糜TBRAS的影响Fig.2 Effect of different additives on the TBRAS of minced carp during frozen storage
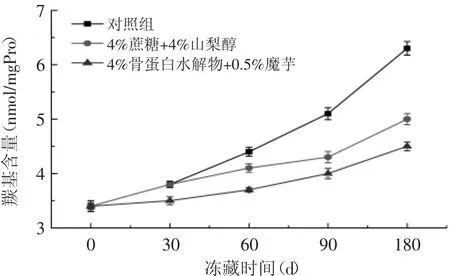
图3 不同添加物对冻藏鲤鱼鱼糜肌原纤维蛋白羰基的影响Fig.3 Effect of different additives on the carbonyl content of minced carp myofibrillar protein during frozen storage
2.3.4 鱼糜凝胶特性的测定 表3为分别加入商业抗冻剂、骨蛋白水解物对冻藏鲤鱼鱼糜凝胶特性的影响。肌原纤维蛋白凝胶的硬度、弹性、能很好的反映蛋白形成凝胶的能力。其中,硬度值指第一次穿刺样品时的压力峰值。弹性指产品本身在第一次穿刺过程中变形后的“弹回”程度,它的度量是第二次穿刺的测量高度同第一次测量的高度的商。由表3可以看出在180d的贮藏期,所有样品凝胶的硬度和弹性均呈下降趋势,而添加商业抗冻剂及骨蛋白水解物与魔芋复配的样品其弹性和硬度下降趋势缓慢,特别是在贮藏后期两者与对照组相比,其弹性和硬度值相差比较显著(p<0.05)。待贮藏结束,对照组、商业抗冻剂组及复配组样品的弹性和硬度和新鲜鱼糜相比分别降低了0.49、46.9g,0.36、37.0g,0.28、28.2g,这表明抗冻剂可以制蛋白冷冻变性,而骨蛋白水解物及魔芋复配后其抗冻效果更加显著。
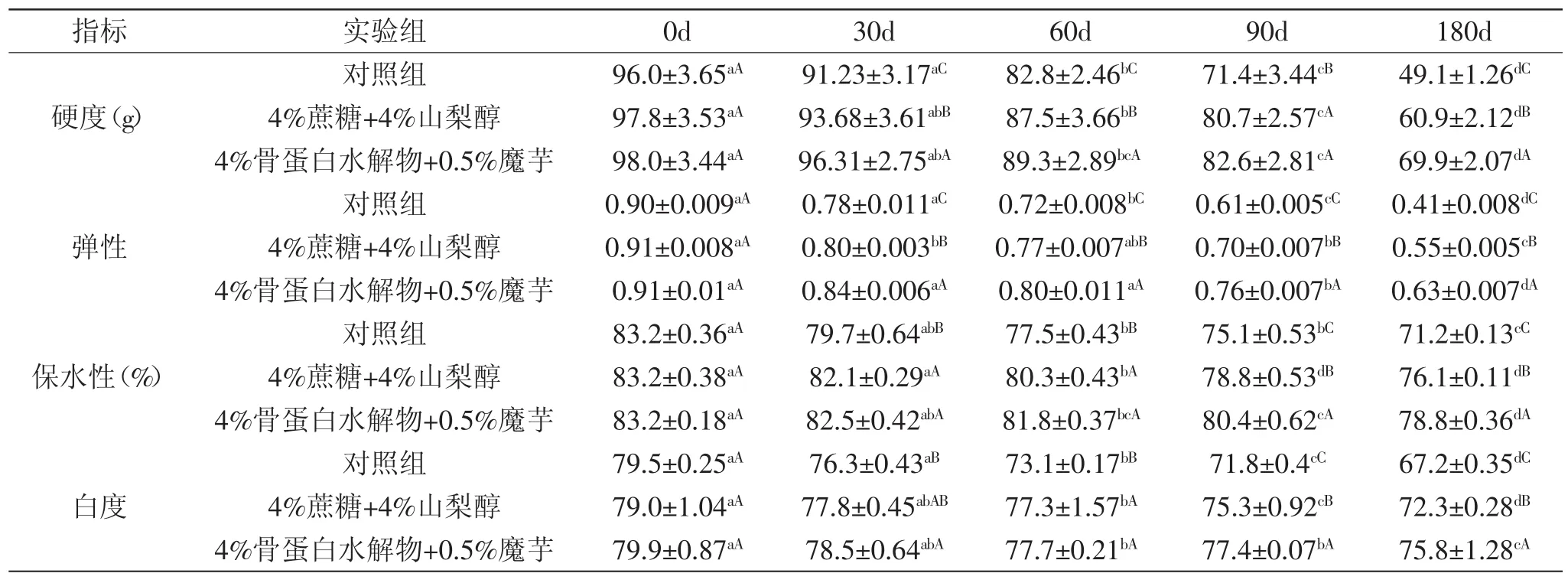
表3 不同添加物对冻藏鲤鱼鱼糜凝胶特性的影响Table 3 Effect of different additives on the gel properties of minced carp during frozen storage
贮藏时间的延长会明显降低鲤鱼鱼糜肌原纤维蛋白凝胶的保水性,这表明蛋白凝胶网状结构丧失了一些截留水分的能力[21]。新鲜鲤鱼鱼糜肌原纤维蛋白凝胶的保水性为83.2%,经过180d的冷冻贮藏后,对照组凝胶保水性为71.2%,下降了12.0%(p<0.05),这表明形成的肌原纤维蛋白凝胶三维网状结构越来越疏松,胶束不能很好的截留水分而释放更多水分;商业抗冻剂及4%骨蛋白水解物与0.5%魔芋复配组样品凝胶保水性降低缓慢,分别降到76.1%、78.8%,下降了7.1%、4.4%(p<0.05)。两组比较发现,后者有更高的保水性,意味着有更加良好的三维网状结构的凝胶,蛋白变性程度越小。
凝胶白度值的降低可能是由于在冻藏过程中肌肉蛋白质发生氧化引起的,也可能是由于脂肪氧化引起色素蛋白与肌肉蛋白交联,在肌原纤维蛋白提取过程由于冻结使蛋白质发生不同程度的变性,蛋白质分子间相互作用,色素蛋白去除不完全而保留在肌原纤维蛋白中引起的,冷冻贮藏相同的天数,商业抗冻剂及复配组样品的白度值高于未添加抗冻剂试样是因为商业抗冻剂及骨蛋白水解物与魔芋复配在一定程度上抑制了鲤鱼鱼糜肌原纤维蛋白的氧化。鱼糜凝胶有更高的白度值可能是由于在蛋白凝胶形成过程中天然血红素蛋白的热处理及其变化引起的,而更低的白度值可能是因为更多的变性或是氧化的血红素蛋白造成的[22]。
3 结论
通过骨蛋白水解物抗氧化实验和魔芋凝胶特性实验确定骨蛋白水解物和魔芋最佳添加量,并将其应用于冻藏鲤鱼鱼糜中,研究二者复配对鲤鱼鱼糜质量及蛋白凝胶的影响。研究结果表明:骨蛋白水解物添加量为4%时抗氧化效果最好,魔芋添加量为0.5%时凝胶效果最为显著,在-18℃下贮藏180d,添加骨蛋白水解物和魔芋复配组鱼糜样品的汁液流失率、蒸煮损失率、TBRAS明显低于对照组;而蛋白凝胶的硬度、弹性、保水性及白度值高于对照组(p<0.05),复配组的抗冻效果要优于商业抗冻剂,说明骨蛋白水解物和魔芋复配后在冻藏过程中可有效抑制脂肪氧化,延缓蛋白质变性,提高凝胶强度。这将为骨蛋白水解物及魔芋应用于食品生产中,延长食品货架期提供参考。
[1]刘欣,周爱梅,赵力超,等.海藻糖、乳酸钠对冻藏编鱼鱼糜蛋白抗冻效果的影响[J].食品与发酵工业,2007,33(8):60-63.
[2]汪学荣,周维禄.复合磷酸盐对鱼糜制品的保水效果研究[J]. 食品科技,2009(9):50-51.
[3]Syeh J,Laeroix C,Carrier M.Determination of optimal level of lactitol for surimi[J].Journal of Food Science,1991,56:285-290,296.
[4]刁静静.骨蛋白水解物的功能特性及抗氧化性的研究进展[J]. 肉类研究,2007(6):26-29.
[5]Wang L L,Xiong Y L.Inhibition of lipid oxidation in cooked beef patties by hydrolyzed potato protein is related to its reducing and radical scavenging ability[J].Journal of Agricultural and Food Chemistry,2005,53(23):9186-9192.
[6]刁静静,孔保华,陈洪生.具有抗氧化活性的骨蛋白肽水解条件优化的研究[J]. 食品工业科技,2008,29(6):177-180.
[7]Bougatef A,Nedjar-Arroume N,Manni L,et al.Purification and identification of novel antioxidant peptides from enzymatic [J].Food Chemistry,2010,118(3):559-565.
[8]Decker E A,Hultin H O.Factors influencing catalysis of lipid oxidation by the soluble fraction of mackerel muscle[J]. Journal of Food Sciences,1990,55:947-950,953.
[9]Fan W J,Zhang Y K,Chen Y C,et al.TBARS predictive models of pork sausages stored atdifferent temperatures[J].Meat Science,2014,96(1):1-4.
[10]Gipsy T M,Gustavo V,Barbosa-Canovas.Color and texturalparameters of pressurized and heat-treatedsurimi gels as affected by potato starch and egg white[J].Food Research International,2004,37(8):767-775.
[11]Xia X F,Kong B H,Xiong Y L,et al.Decreased gelling and emulsifying properties of myofibrillar protein from repeatedly frozen-thawed porcine longissimus muscle are due to protein denaturation and susceptibility to aggregation[J].Meat Science,2010,85(3):481.
[12]AOAC.Official method of analysis(16th)[M].Washington,DC:Association of the Official Analytical Chemists,1995.
[13]Jiang X J,Zhang Z J,Cai H N,et al.The effect of soybean trypsin inhibitor on the degradation of myofibrillar proteins by an endogenous serine proteinase of crucian carp[J].Food Chemistry,2006,94(4):498-503.
[14]Carney J M,Floyd R A,Wu J F,et al.Free Radical Daily administration of α -phneyl-N-tert-butyl nitrone(PBN)decreases the level of oxidized brain protein and increases brain glutamine synthetase activity in aged gerbils[J].Biology and Medicine,1990,9(1):84-87.
[15]Boonsumrej S,Chaiwaniehsiri S,Tantratian S,et al.Effect of freezing and thawing on the quality changes oftiger shrimp(Penaeus Mondon) frozen by air—blast and cryogeic freezing [J].Journal of Food Engineering,2007,80(1):292-299.
[16]Zhang Y,Xie B,Gan X.Advance in the applications of konjac glucomannan and its derivatives[J].Carbohydrate Polymers, 2005,60(1):27-31.
[17]张静雅,陆剑锋,林琳,等.鲢鱼冷冻鱼糜抗冻剂的复配研究[J]. 食品科学,2012,33(2):127-132.
[18]Chin K B,Keeton J T,Longnecker M T,et al.Functional,textural and microstructural properties of low-fat bologna(model system) formulated with a konjac blend[J].Food Science,1998,63(5):801-807.
[19]Zhuang H,Savage E M,Smith D P,et al.Effect of dry-air chilling on warner-bratzler shear force and water-holding capacity of broiler breast meat deboned four hours postmortem [J].Journal of Food Poultry Science,2008,7(8):743-748.
[20]Badiif, Howell N K.Effect of antioxidants citrate,and cryoprotectants on protein denaturation and texture of frozen cod(Gadus morhua)[J].Journal of Agricultural and Food Chemistry,2002,50(7):2053-2061.
[20]崔旭海,孔保华.蛋白质氧化及其对乳蛋白结构与功能性的影响[J]. 中国乳品工业,2008,36(1):44-47.
[21]Xia X F,Kong B H,Xiong Y L,et al.Decreased gelling and emulsifying properties of myofibrillar protein from repeatedly frozen-thawed porcine longissimus muscle are due to protein denaturation and susceptibility to aggregation[J].Meat Science,2010,85:481-486.
[22]Rawdkuen S,Sai-Ut S,Khamsorn S,et al.Biochemical and gelling properties of tilapia surimi and protein recovered using an acid-alkaline process[J].Food Chemistry,2009,112(1):112-119.
Study on properties of boneprotein hydrolyzate and konjac and their applications as antifreeze in frozen carp surimi
HUANG Li,LV Hong-hao,DONG Fu-jia,WU Shu-ying,XIA Xiu-fang*,FEI Nan
(College of Food Science,Northeast Agricultural University,Harbin 150030,China)
Konjac gel experiments and antioxidant properties of bone protein hydrolyzate experiment to determine the optimum use amount of high antioxidant activity of the bone protein hydrolyzate and the high gel konjac were 4%and 0.5% ,respectively.As the same time,compounding boneprotein hydrolysates and konjac as cryoprotectant was compared with commercial cryoprotecta nts.The water holding capacity (WHC ) (cooking loss , thawing loss ) , thiobarbituric acid reactive substances ( TBARS ) of carp surimi and the gel properties(hardness,spring,WHC,whiteness) of surimi protein were measured to study protective effect on frozen surimi(-18℃ ,180d) with the compounding group.Results indicated that the cooking loss ,thawing loss,TBARS and carbonyl content of compounding group decreased by 62.71% ,50.25% ,71.83% ,36.51%at the end of the storage compared to the control groups.While the hardness,spring,WHC and whiteness of protein gel increased by 52.80% ,42.19% ,10.67% ,12.88% ,and the indicators increased 15.79% ,6.45% ,36.17% ,10.00% ,14.78%,14.55%,3.55% ,4.84%compared to the commercial cryoprotectants group (p<0.05) ,respectively.The results demonstrated that compounding boneprotein hydrolysates and konjac could inhibit fat oxidation ,prevent protein denaturation by frozen sorage,and improve WHC,gel strength of surimi significantly.The best formula of the frozen surimi cryoprotectants was 4%bone protein hydrolyzate,0.5%konjac.
suimi;boneprotein hydrolyzates;konjac
TS201.1
A
1002-0306(2014)22-0139-06
10.13386/j.issn1002-0306.2014.22.022
2014-01-16
黄莉(1988-),女,硕士研究生,研究方向:食品科学。
* 通讯作者:夏秀芳(1973-),女,博士,副教授,研究方向:农产品加工及贮藏。
黑龙江省博士后资助项目(LBH-Z11212);东北农业大学博士启动基金(2012RCB28)。
