乳酸乳球菌Nisin抗性基因的异源性表达和活性研究
2014-02-07杨洁贺松
杨洁,贺松
(成都大学附属医院,四川成都610081)
乳酸乳球菌Nisin抗性基因的异源性表达和活性研究
杨洁,贺松
(成都大学附属医院,四川成都610081)
目的评估乳酸乳球菌Nisin抗性基因在德氏乳杆菌保加利亚亚种的表达活性,为建立食品级筛选标记做准备。方法将新鲜牛奶接种于含有400μg/ml乳酸链球菌素的M17平板上,在分离的菌株中筛选乳酸乳球菌,同时提取其基因组DNA和质粒DNA,根据已公布的Nisin抗性基因序列设计一对引物,以提取的基因组DNA和质粒DNA为模板进行PCR扩增,产物进行电泳分析。将目的基因插入到大肠杆菌乳杆菌穿梭质粒—pMG36e中,并在德式乳杆菌保加利亚亚种中观察目的基因的表达活性及其作为筛选标记的活性。结果成功筛选出对Nisin具有抗性的乳酸乳球菌,进行目的基因扩增后成功将目的基因转化到L6032中,并表达出Nisin抗性。结论在德式乳杆菌保加利亚亚种中成功克隆及表达出Nisin抗性基因。
乳酸乳球菌;德式乳杆菌保加利亚亚种;Nisin抗性基因;食品级筛选标记
乳酸链球菌素(Nisin)是乳酸链球菌产生的一种多肽物质,由34个氨基酸残基组成[1]。食用后在人体的生理PH条件和α-胰凝乳蛋白酶作用下很快水解成氨基酸,不会改变人体肠道内正常菌群以及产生如其它抗菌素所出现的抗性问题,更不会与其它抗菌素出现交叉抗性,是一种高效、无毒、安全、无副作用的天然食品防腐剂[2,3],在全球48个国家合法使用[4]。乳酸链球菌素(Nisin)能有效抑制引起食品腐败的许多革兰氏阳性细菌[5,6],如乳杆菌、明串珠菌、小球菌、葡萄球菌、李斯特菌[7,8]等,特别是对产芽孢的细菌如芽孢杆菌和梭状芽孢杆菌有很强的抑制作用[4]。通常,产芽孢的细菌耐热性很强,如鲜乳采用135℃、2s超高温瞬时灭菌,非芽孢细菌的死亡率为100%,芽孢细菌的死亡率90%,还有10%的芽孢细菌不能杀灭。若鲜乳中添加0.03~0.05g/kg Nisin就可抑制芽孢杆菌和梭状芽孢杆菌孢子的发芽和繁殖。Nisin的抑菌机制为:吸附于敏感菌的细胞膜上,其C末端侵入膜内形成通透孔道,允许分子量小于0.5kDa的亲水分子流入,而导致细胞膜去极化及ATP的泄漏,细胞自溶而死亡[9,10]。乳酸乳球菌的Nisin抗性基因通常来源于两个因素:对于能产Nisin抗性基因的乳酸乳球菌菌株,NisI基因在Nisin免疫中有重要的作用[11,12];对于非产Nisin抗性基因的乳酸乳球菌,能编码Nisin抗性序列[13]。
无论何种类型的载体都必须带有一个有效的筛选标记确保转化子的筛选。传统的乳酸菌载体都带有一个或多个编码特定抗生素(如红霉素、氯霉素等)的异源性基因,这为遗传操作保持了一定的选择压力,是有效的重组子筛选方法。但是如果将带有抗生素抗性基因的菌株投放到环境或人和动物体内,由于抗性基因有转移的可能,将会带来严重生物安全隐患,因此在实际生产中也必然受到限制。最有效的方法是使用对人体安全的食品级筛选标记来构建载体。目前国内外已有许多关于食品级筛选标记研究的报道,包括细菌素抗性及免疫性标记、重金属抗性标记、噬菌体抗性标记、营养缺陷互补标记和糖类利用筛选标记。
在本次研究中,从新鲜牛奶中分离出带有Nisin抗性基因的乳酸乳球菌,然后将Nisin抗性基因克隆到德式乳杆菌保加利亚亚种中,研究其中的转化成功菌株的Nisin抗性基因活性。
1 材料与方法
1.1 标本来源Nisin从Sigma公司购买,质粒PMG36e由荷兰University of Groningen Jan.Kok教授惠赠。大肠杆菌DH5α菌株常规培养于37℃LB培养基中[14]。作为Nisin抗性基因敏感的表达宿主德式乳杆菌保加利亚亚种在37℃MRS培养基[15]中培养。
1.2 仪器与试剂细菌基因组提取试剂盒(Promega)、质粒抽提试剂盒(Promega)、紫外分光光度计
1.3 实验方法将从农场获得的新鲜牛奶接种于含有400μg/ml乳酸链球菌素的M17肉汤中[16],在30℃条件下培养16h,然后将50ul菌悬夜接种于含有400μg/ml乳酸链球菌素的M17琼脂平板上,在30℃条件下培养24h。将筛选出的单克隆菌株按照上述方法再次培养。然后对筛选出的细菌进行革兰染色、形态学、触酶试验进行初步筛选,选择触酶阴性的革兰阳性球菌,用乳酸乳球菌16S rDNA通用引物(F-5’-AGAGTTTGATCCTGGCTCAG-3’;R-5’-AAGGAGGTGATCCAGCCGCA-3’[17])扩增,反应条件为:94℃预变性3min,94℃变性30s、58℃退火40s、72℃延伸90s进行30个循环,72℃延伸10min。将扩增的产物送Invitrogen公司测序,测序结果用Blast软件进行在线比对。
分别利用细菌基因组提取试剂盒(Promega)和质粒抽提试剂盒(Promega)提取阳性筛选菌株的基因组DNA和质粒DNA。DNA的含量与纯度利用紫外分光光度计在260nm和280nm处测定,将其保存于4℃条件下。
根据GenBank公布的Nisin抗性基因序列(No: M37002),设计一对引物:F-5’-AAAACTGCAGGCCATGACTTGATACCCGAT-3,R-5’-CCCAAGCTTGCATTGGTACTTGCTTTCGG-3’(分别在上游引物引进限制性核酸内切酶Pst I,下游引物引进限制性核酸内切酶Hind III,见下划线处),扩增产物长度为1406bp,包括Nisin抗性基因开放阅读框和启动子。以之前提取的基因组DNA和质粒DNA作为模板进行扩增,反应条件为:94℃预变性5min,94℃变性40s、55℃退火40s、72℃延伸90s进行35个循环,72℃延伸10min。扩增产物用1%的琼脂糖凝胶电泳分析。用QIAGEN公司的DNA纯化试剂盒对PCR产物进行纯化,纯化产物用Pst I和Hind III进行双酶切,酶切产物与选择相同的限制性核酸内切酶酶切的质粒PMG36e进行连接,连接产物命名为pMG36e-nsr。pMG36e-nsr转化大肠杆菌DH5α感受态细胞,并接种于含有150μg/ml红霉素的LB高渗肉汤中,在37℃条件下振荡培养2h,取50μl培养液涂布接种于含有150μg/ml红霉素的LB平板,在37℃培养18h。挑取单克隆菌落,采用酶切鉴定、PCR鉴定和测序鉴定(由Invitrogen公司完成)。
用质粒抽提试剂盒提取重组质粒pMG36ensr,电穿孔转化德式乳杆菌保加利亚亚种(L6032),转化条件为1.9Kv,2.8ms。将转化后的细菌接种在含有200g/L蔗糖的MRS高渗液体培养基,37℃培养3h。将细菌培养液接种于含有10 μg/ml红霉素的MRS平板,在37℃培养3d。阳性转化菌株命名为L6032-nsr,分别接种于含有不同浓度乳酸链球菌素(0 μg/ml,100 μg/ml,200 μg/ml,300 μg/ml, 400 μg/ml)的MRS肉汤,37℃培养48h,在同样条件下培养L6032和L6032-PMG36e作阴性对照,每三个小时测量菌液在600nm处的吸光度值,并描绘出生长曲线。同时在含有10μg/ml红霉素的MRS肉汤中培养L6032-nsr,作为对照分析Nisin抗性基因表达活性。
2 结果
2.1 Nisin抗性菌株的分离与鉴定最终分离出6株有Nisin抗性的菌株。这些分离出的6中菌株通过形态学、生化鉴定和16S rDNA测序鉴定均为乳酸乳球菌,分别命名为L-no1、L-no2、L-no3、L-no4、L-no5、L-no6。
2.2 Nisin抗性基因的克隆以从上述6株单克隆菌株提取的基因组DNA和质粒DNA为模板进行PCR扩增,目的基因片段从L-no2的基因组DNA中获得。将目的基因片段纯化后利用限制性内切酶进行双酶切,转入质粒pMG36e中,命名为pMG36e-nsr。通过酶切鉴定、PCR鉴定和测序鉴定证实重组质粒构建成功。基因序列中包含开放阅读框(957 bp)和上游的转录调控位点。我们将克隆基因与GenBank(http://www.ncbi.nlm.nih.gov/sites)公布的nsr基因进行同源性分析,利用欧洲分子生物学实验室提供的ClustalW2软件进行序列比对,分析结果见表1和图1。从图1和表1看出,我们扩增的序列与公布的乳酸乳球菌质粒pND301 (U25181)相似性为95%、与乳酸乳球菌(M37002)相似性为88%、与乳酸乳球菌克隆菌株TS1640 (AY219902)相似性为87%、与乳酸乳球菌K21-1 (EU747092)相似性为85%。
2.3 nsr基因的活性表达利用电转化将重组质粒pMG36e-nsr转入德式乳杆菌保加利亚亚种(L6032)中,阳性转化菌株(L6032-nsr)分别接种于含有不同浓度乳酸链球菌素(0 μg/ml,100 μg/ml, 200 μg/ml,300 μg/ml,400 μg/ml)的MRS肉汤,描绘出在600nm处的生长曲线(见图2)。从图2中可看出,不含有乳酸链球菌素的肉汤中L6032-nsr, L6032和L6032-pGM36e均生长良好,6h后达到对数生长,24h后进入平台期。但是在含有100 μg/ml的乳酸链球菌素的肉汤中L6032和L6032-pGM36e在第一个24h几乎不生长,24h后,由于乳酸链球菌素活性的降低,这两种菌株开始生长。因为L6032-nsr具有Nisin抗性,它的生长完全不受乳酸链球菌素的影响,在五个MRS肉汤中均生长良好。同时,为了验证nsr基因作为食品级筛选标记的活性,我们将其与红霉素抗性基因(Emr)作对比。我们将L6032-nsr分别接种于含有400 μg/ml的乳酸链球菌素和10 μg/ml的红霉素MRS肉汤中,测定它们在600nm出的生长曲线(见图2)。从图中可看出,两个生长曲线几乎是一样,如此可以说明,我们可以用nsr基因替代Emr作为一种食品级筛选标记。

表1 本次研究的nsr基因序列与网上公布的序列同源性比对得分
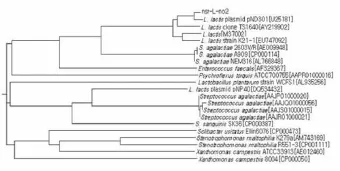
注:Nsr-L-no2为Nisin抗性基因包括了开放阅读框和启动子。图1 nsr基因序列与公布的序列比对的系统树图
3 讨论
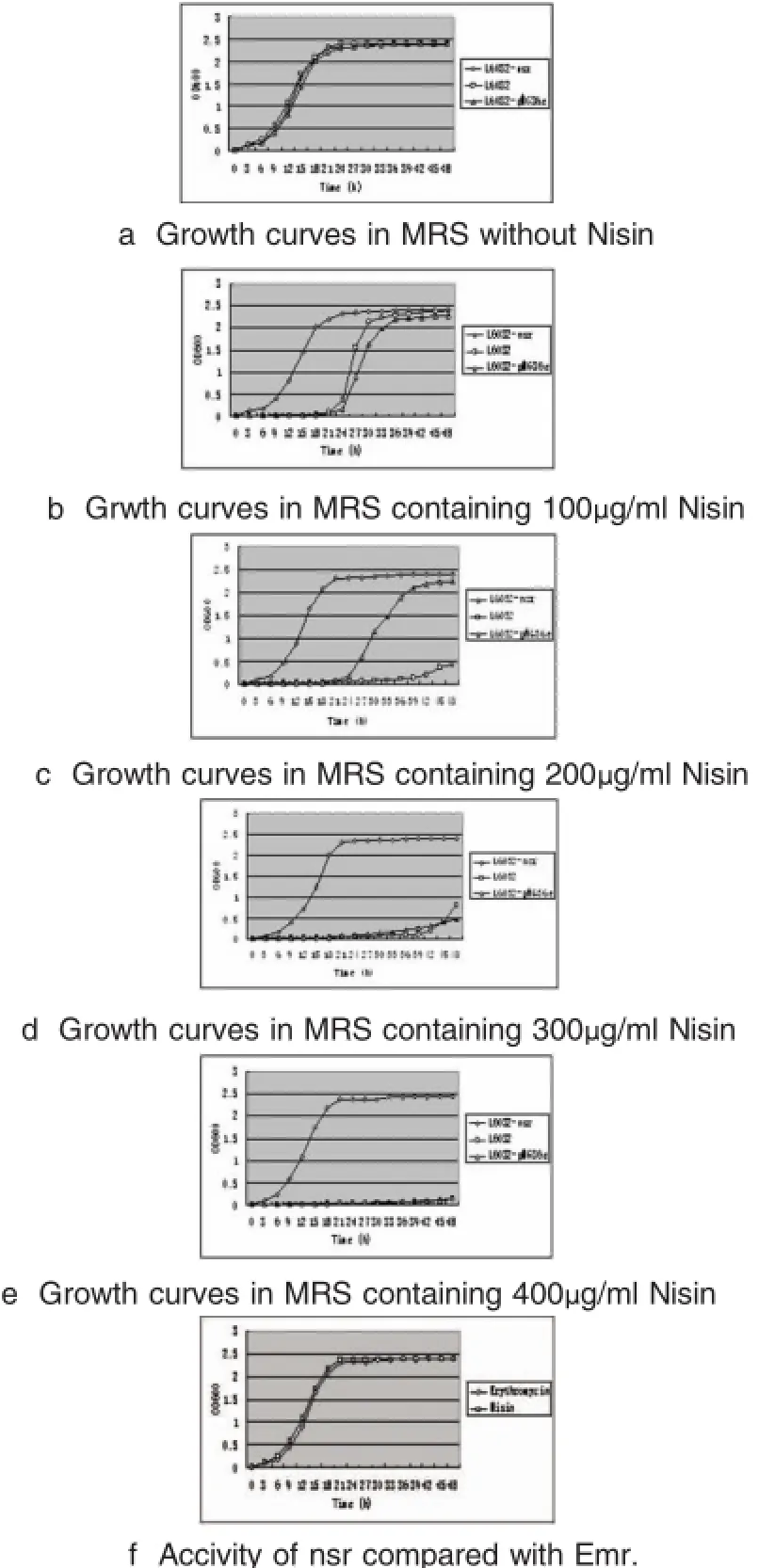
图2 德式乳杆菌保加利亚亚种在含有不同浓度Nisin的MRS培养基中的生长曲线
将新鲜牛奶接种于含有400 μg/ml高浓度的乳酸链球菌素的M17平板上,我们最终分离出6株带有Nisin抗性的乳酸乳球菌,通过一系列的鉴定,只在其中一株中发现了nsr基因。其余五种菌株对Nisin的抗性可能是产Nisin的乳酸乳球菌,或者与网上公布的M37002的核酸序列有较大差异。
乳酸菌被大量应用于酸奶和奶酪的生产中,由于这种大量的商业运用,开展了大量的基础与应用研究来更好地了解乳酸菌[18-20],力求找出更好的菌种或者通过基因优化的方式改善菌种,这类菌株应该适合实验室和工厂应用。由于乳酸菌应用的特殊性,这就要求其载体系统必须具有十分安全的特性。采用的选择标记、染色体组成型或控制基因表达范围,都必须满足食品级载体系统的三个基本条件。表达宿主菌必须是安全的、特征清楚且稳定的食品级微生物,如:乳酸乳球菌、乳酸杆菌及其他已在食品工业中得到长期而广泛应用的菌株;诱导物必须是食品级的,如乳糖、蔗糖、嘌呤、嘧啶、Nisin等可被人食用或对人体无害的物质,或温度、酸诱导等对人体无害的条件;载体必须是食品级的,不能有非食品级的功能性DNA存在,与食品级表达系统有关DNA必须来源于食品级(GRAS)微生物。
乳酸菌能够携带的质粒具有很多能工业化的特性,包括乳糖利用、生产细菌、噬菌体抗性、胞外多糖生产[21-23]。许多方法已经被设计运用于乳酸菌的染色体突变,但是乳酸菌的质粒携带基因工程在食品级方面的应用存在着巨大的潜在利用,这一方面目前还很少被涉及到。有效的质粒基因工程可以去除或者替换不良基因,进行特定的质粒基因的功能分析,还能引入基因的点突变决定个别核苷酸和氨基酸的重要性。除了与食品级质粒基因工程相关的局限性,缺乏一个现有的可选择标记完成转录也使其应用受到限制。由于抗生素选择标记在食品级的应用限制,三种替代方式已被使用。第一种是显性标记,包括了细菌素抗性和免疫性标记[24]、重金属抗性标记,这类标记比较直观,但是依赖于目的质粒上的筛选标记的存在。第二种选择标记是营养互补型标记,比如胸苷酸互补型、氨基酸互补型,这种方法是需要有相应的基因缺陷型菌株,然后在表达质粒中加入该表型互补的序列。第三种是糖类利用筛选,比如乳糖利用[25]、蔗糖、木糖等等。
在本次研究中,我们将nsr基因克隆到质粒pMG36e中,形成重组质粒pMG36e-nsr,研究nsr基因在德式乳杆菌保加利亚亚种(L6032)的活性表达。研究证明L6032-nsr获得了较强的Nisin抗性。与红霉素抗性标记作对比,L6032-nsr仍然在只含有Nisin的MRS平板中生长良好。由此说明重组质粒在没有红霉素筛选压力的情况下仍然没有丢失。可见,将来nsr基因作为食品级筛选标记有较大潜力能够代替抗生素筛选标记。
食品级筛选标记Nisin的筛选效能与红霉素作为筛选标记相同,但是Nisin的传代是否会丢失,还待进一步实验研究。
[1]Carr FJ,Chill D,Maida N.The lactic acid bacteria:A literature survey[J].Crit Rev Microbiol,2002,28(4):281-370.
[2]Cleveland J,Montville TJ,Nes IF,et al.Bacteriocins:safe,natural antimicrobials for food preservation[J].Int J Food Microbiol. 2001,71(1):1-20.
[3]Delves-Broughton J,Blackburn P,Evans RJ,et al.Applications of the bacteriocin,nisin[J].Antonie Leeuwenhoek,1996,69(2):193-202.
[4]Deegan LH,Cotter PD,Hill C,et al.Bacteriocins:Biological tools for bio-preservation and shelf-life extension[J].Int Dairy J 2006,16(9):1058-1071.
[5]Brand AM,de Kwaadsteniet M,Dicks LM.The ability of nisin F to control Staphylococcus aureus infection in the peritoneal cavity,as studied in mice[J].Lett Appl Microbiol,2010,51(6):645-649.
[6]García P,Martínez B,Rodríguez L,et al.Synergy between the phage endolysin LysH5 and nisin to kill Staphylococcus aureus in pasteurized milk[J].Int J Food Microbiol,2010,141(3):151-155.
[7]Takahashi H,Kuramoto S,Miya S,et al.Use of Commercially Available Antimicrobial Compounds for Prevention of Listeria monocytogenes Growth in Ready-to-Eat Minced Tuna and Salmon Roe during Shelf Life[J].J Food Prot,2011,74(6):994-998.
[8]Brandt AL,Castillo A,Harris KB,et al.Inhibition of Listeria monocytogenes by food antimicrobials applied singly and in combination[J].J Food Sci,2010,75(9):M557-563.
[9]Breukink E,Wiedemann I,van Kraaij C,et al.of the cell wall precursor lipidⅡby a pore-forming peptide antibiotic[J].Science, 1999,286(5448):2361-2364.
[10]Smith L,Hasper H,Breukink E,et al.Elucidation of the antimicrobial mechanism of mutacin 1140[J].Biochemistry,2010,47(10): 3308-3314.
[11]Brotz H,Bierbaum G,Leopold K,et al.The lantibiotic mersacidin inhibits peptidoglycan synthesis by targeting lipid II.Antimicrob Agents Chemother,1998,42(1):154-160.
[12]Martínez B,Bottiger T,Schneider T,et al.Specific interaction of the unmodified bacteriocin Lactococcin 972 with the cell wall precursor lipid II[J].Appl Environ Microbiol,2008,74(15):66-70.
[13]Takala TM,Saris PE.A food-grade cloning vector for lactic acid bacteria based on the nisin immunity gene nisI.Appl Microbiol Biotechnol,2002,59(4-5):467-471.
[14]Danquah MK,Forde GM.Growth medium selection and its economic impact on plasmid DNA production.J Biosci Bioeng, 2007,104(6):490-497.
[15]Sawatari Y,Hirano T,Yokota A.Development of food grade media for the preparation of Lactobacillus plantarum starter culture[J].J Gen Appl Microbiol,2006,52(6):349-356.
[16]Kilstrup M,Hammer K.Short communication:salt extends the upper temperature limit for growth of Lactococcus lactis ssp.cremoris on solid M17 medium[J].J Dairy Sci,2000,83(7):1448-1450.
[17]Edwards U,Rogall T,Blocker H,et al.Isolation and direct complete nucleotide determination of entire genes.Characterization of a gene coding for 16S ribosomal RNA[J].Nucleic Acids Res, 1989,17(19):7843-7853.
[18]Villatoro-Hernandez J,Montes-de-Oca-Luna R,Kuipers OP. Targeting diseases with genetically engineered Lactococcus lactis and its course towards medical translation[J].Expert Opin Biol Ther,2011,11(3):261-7.
[19]Fernández M,Martínez-Bueno M,Martín MC,et al.Heterologous expression of enterocin AS-48 in several strains of lactic acid bacteria[J].J Appl Microbiol,2007,102(5):1350-1361.
[20]Bueno DJ,Casale CH,Pizzolitto RP,et al.Physical adsorption of aflatoxin B1 by lactic acid bacteria and Saccharomyces cerevisiae: a theoretical model[J].J Food Prot,2007,70(9):2148-2154.
[21]Honda H,Kataoka F,Nagaoka S,et al.Beta-galactosidase,phospho-beta-galactosidase and phospho-beta-glucosidase activities in lactobacilli strains isolated from human faeces[J].Lett Appl Microbiol,2007,45(5):461-466.
[22]Simova ED,Beshkova DM,Angelov MP,et al.Bacteriocin production by strain Lactobacillus delbrueckii ssp.bulgaricus BB18 during continuous prefermentation of yogurt starter culture and subsequent batch coagulation of milk[J].J Ind Microbiol Biotechnol,2008,35(6):559-567.
[23]Chervaux C,Ehrlich SD,Maguin E.Physiological study of Lactobacillus delbrueckii subsp.bulgaricus strains in a novel chemically defined medium[J].Appl Environ Microbiol,2000,66 (12):5306-5311.
[24]Brede DA,Lothe S,Salehian Z,et al.Identification of the propionicin F bacteriocin immunity gene(pcfI)and development of a food-grade cloning system for Propionibacterium freudenreichii[J]. Appl Environ Microbiol,2007,73(23):7542-7547.
[25]Takala TM,Saris PE,Tynkkynen SS.Food-grade host/vector expression system for Lactobacillus casei based on complementation of plasmid-associated phospho-beta-galactosidase gene lacG[J].Appl Microbiol Biotechnol,2003,60(5):564-570.
Heterologous expression and activity research of a nisin resistance gene in Lactobacillus delbrueckii subsp bulgaricus
Objective To evaluate the activity of nisin resistance gene(nsr)in transformant Lactobacillus delbrueckii subsp. bulgaricus,and prepare for establishing a food-grade selective marker.Methods Inoculated fresh milk in M17 broth containing 400μg/ml nisin and incubated at 30℃for 16 h.Then picked out the suspected colonies,and extracted genomic DNA and plasmid DNA.Based on the nsr gene sequence information,PCR amplification was performed with genomic DNA or plasmid DNA,electrophoretic analysis was used to analyze the products.The target gene was inserted into pMG36e,and recombinant plasmid pMG36e-nsr was transformed into Lactobacillus delbrueckii subsp.bulgaricus(L6032)competent cells.Results Six nisin resistant stains were identified as Lactococcus lactis.The target gene was cloned into E.coli-Lactobacillus shuttle vector pMG36e.The Nisin resistibility was obtained when the recombinant plasmid pMG36e-nsr was transformed into Lactobacillus delbrueckii subsp. bulgaricus L6032 competent cells.Conclusions The nsr gene was successfully cloned and expressed in Lactobacillus delbrueckii subsp.bulgaricus L6032.
Lactococcus lactis;Lactobacillus delbrueckit subsp.bulgaricus;Nisin resistance gene(nsr);Food-grade.
YANG Jie,HE Song.
The Affiliated Hospital of Chengdu University,Chengdu 610081,China.
2014-03-03;
2014-05-26)
杨洁,女,1989年3月出生,毕业于成都医学院医学检验系,检验师,研究方向为分子生物以及微生物检验。
Q786
A
1674-1129(2014)04-0381-05
10.3969/j.issn.1674-1129.2014.04.006
