细菌一氧化氮合酶及其在食品科学研究中的应用
2014-01-21罗慧婷孔保华李沛军李木子
罗慧婷,孔保华,*,李沛军,2,李木子
细菌一氧化氮合酶及其在食品科学研究中的应用
罗慧婷1,孔保华1,*,李沛军1,2,李木子1
(1.东北农业大学食品学院,黑龙江 哈尔滨 150030;2.合肥工业大学生物与食品工程学院,安徽 合肥 230009)
一氧化氮合酶(nitric oxide synthase,NOS)是一种广泛存在于哺乳动物体内的调节酶,具有催化生成一氧化氮的重要功能。近年来,人们在细菌体内也发现NOS的存在。本文介绍细菌中NOS的结构、生化机制和功能等,对其在食品科学研究中的应用进行了综述,并对其今后的研究重点和发展方向进行展望。
一氧化氮合酶;细菌;食品科学;应用
一氧化氮合酶(nitric oxide synthase,NOS)是高等生物体中重要的信号分子——一氧化氮(nitric oxide,NO)合成的关键酶,具有催化L-精氨酸氧化生成L-瓜氨酸和NO的功能[1]。哺乳动物中,NO参与许多生物进程,从血压的调节到抵抗病原体的保护作用[2]。研究显示,哺乳动物NOS是复杂的高度调节合成酶,而细菌NOS在结构及特性上与哺乳动物NOS存在差异,因此,有学者推断细菌NOS的功能可能不同于哺乳动物NOS的功能[3]。由于哺乳动物NOS对多细胞信号和免疫应答的重要性,细菌NOS亦成为当今研究热点。从食品质量安全的观点上看,一些有益微生物也具有产生类NOS蛋白的能力,逐渐引起了人们的兴趣和研究。本文就细菌NOS的结构、生理生化特性和功能以及其在食品科学研究中的应用进行了综述。NOSNoc。随后人们相继在乳酸菌、金黄色葡萄球菌(Staphylococcus aureus)、枯草芽孢杆菌(Bacillus subtilis)、耐辐射奇球菌(Deinococcus radiodurans)、炭疽芽孢杆菌(Bacillus anthrasis)和嗜热脂肪芽孢杆菌(Geobacillus stearothermophilis)等微生物中也检测到了细菌NOS的存在[5],如表1所示。细菌NOS与哺乳动物NOS有许多共同的特性,例如,它们都是二聚体结构,具有血红素光谱特性,当有充足的辅因子提供时,它们均可催化L-精氨酸反应,产生NO分子。此外,与哺乳动物NOS相比,细菌NOS在结构与功能上具有其特异性。

表1 目前发现的典型细菌NOSTable 1 Typical bacterial NOS
1 细菌NOS概述
1994年,Chen Yijun等[4]首次在诺卡氏菌(Nocardia)中发现并成功纯化得到细菌NOS,这种酶被命名为
1.1 细菌NOS的结构和催化机制
利用X射线进行晶体衍射可知,哺乳动物NOS是有活性的同源二聚体蛋白,每一个亚基包含两个区域:由血红素、四氢生物喋呤(H4B)和底物L-精氨酸结合位点等构成的N末端氧化酶区域(NOSoxy);含NADPH、FAD和FMN结合位点的C末端黄素蛋白还原酶区域(NOSred);钙调节蛋白位于这两部分中间,将两个区域连接在一起,控制电子从NOSred向NOSoxy的转移。然而,细菌NOS仅具有与哺乳动物NOS的NOSoxy部分高度相似的结构,缺乏相关的NOSred、钙调蛋白结合区、N末端钩区和锌环指序列[12]。哺乳动物NOS的N末端拥有一个由50 个残基组成的“钩”部,其中包括一段锌离子结合位点,也包含辅助因子H4B部分的结合位点,在哺乳动物NOS中起稳定二聚体和催化的作用。而细菌NOS能形成不含这个“钩”的稳定二聚体。细菌NOS的催化活性中心称为血红素袋,包括血红素、H4B和底物的结合位点,两侧的β-折叠和处于二聚体界面的螺旋-转角模体将血红素包裹在摇篮状结构中。与哺乳动物NOS相比,一些细菌NOS的血红素袋中残基发生了改变,由哺乳动物NOS中的缬氨酸(Val)变成了异亮氨酸(Ile)[13]。
细菌NOS催化生成NO的机制包含两步基于血红素的氧合反应:第一步L-精氨酸羟基化成稳定的中间产物Nω-羟基-L-精氨酸(Nω-hydroxy-L-arginine,NOHA),第二步NOHA转化生成NO和L-瓜氨酸(图1)。值得注意的是,这两步氧激活作用似乎都需要H4B作为血红素暂时的电子供体[10]。亚铁血红素氧合复合物间氢键与底物L-精氨酸或中间产物NOHA的不同作用控制着氧化反应的进程和产物类型。金黄色葡萄球菌NOS(saNOS)血红素-氧复合物的拉曼共振研究结果显示,L-精氨酸和NOHA控制NOS催化时氧合中间物的稳定性和产率。
细菌NOS普遍发现于革兰氏阳性菌中,由于细菌NOS缺乏NOSred,需要补充适合的还原酶才能产生NO[14]。在一些重组实验中,细菌NOS,如枯草芽孢杆菌NOS(bsNOS)和耐辐射奇球菌NOS(drNOS),使用哺乳动物NOS的NOSred作为其还原酶搭档,催化L-精氨酸氧化成NO,但产率较哺乳动物NOS低[15]。进一步研究表明,当bsNOS接受来自一些非特异性细胞还原酶的电子时,能形成NO[16]。此外,在大肠杆菌体内表达的细菌NOS,可于体外产生NO,这可能是由于其利用了宿主还原酶的缘故。
细菌NOS与哺乳动物NOS的辅因子结合情况相似。研究发现,saNOS在所有辅因子都存在时才能达到最大活性,这些因子可维持二聚体最大稳定性,缺乏任何一种辅因子都会使saNOS的活性显著降低[7]。动物和细菌NOS中相关蝶呤辅助因子的类型存在差异,而有些细菌NOS则能结合其他的蝶呤因子。四氢叶酸酯(H4F)与H4B有同样的蝶啶环结构,能在所有细菌中合成,可作为细菌NOS天然辅助因子H4B的功能性替代物。例如,bsNOS中既含有H4B也含有H4F,而drNOS结合H4F时比H4B更有效[9]。
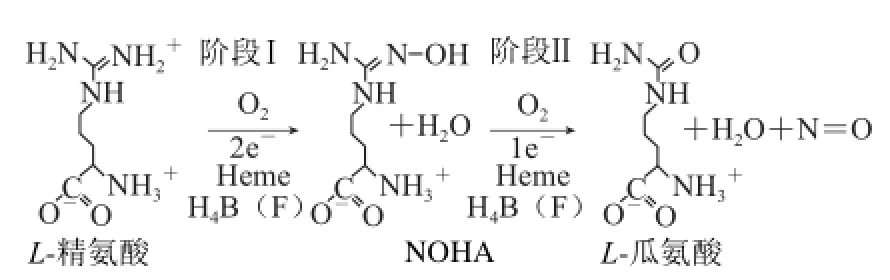
图1 NOS催化机制途径[10]Fig.1 Catalytic mechanism of NOS[10]
1.2 细菌NOS的生化特性
1.2.1 细菌NOS的活性诱导及抑制
经过分离纯化可以得到具有较强活性的细菌NOS。将提取得到的粗酶液经过Mono Q离子交换、2’5’-ADP-琼脂糖亲和层析和Superdex 200HR凝胶渗透色谱3 步柱层析,最终成功制备得到了纯化倍数为900的NOS,其得率为2.8%[6]。同位素标记瓜氨酸形成、基于NO形成的化学发光分析法、血红素结合法、电化学分析和荧光分析法等一系列手段均可用于检测细菌NOS活性。细菌NOS的活性变化直接调节NO的生成量及其生物学效应。甲醇和过氧化氢(H2O2)对细菌NOS均有诱导作用,可使其活性显著增加。
L-精氨酸类似物是最常见NOS抑制剂,它们能与细菌NOS竞争性结合。典型的哺乳动物NOS抑制剂对纯化得到的saNOS具有抑制效应,包括氨基胍(amino guanidine,AG)、NG-硝基-L-精氨酸甲酯(NG-nitro-L-arginine methyl ester,NAME)和NG-单甲基-L-精氨酸(NG-monomethyl-L-arginine,NMA)等,这些抑制剂都能以剂量依赖的方式抑制金黄色葡萄球菌NOS活性。
1.2.2 细菌NOS的光谱特性
人们对细菌NOS的光谱学特性进行了一系列的研究,包括紫外-可见光谱(ultraviolet and visible absorption spectra,UV-Vis)、拉曼共振光谱(resonance raman,RR)、傅里叶变换红外光谱(Fourier transform infrared,FTIR)、电子顺磁共振(electron paramagnetic resonance,EPR)和电子核双共振光谱(electron nuclear double resonance,ENDOR)等。对高铁saNOS的UV-Vis光谱和拉曼共振研究显示,在生理条件下,以混合自旋状态存在。Salard-Arnaud等[8]的实验也说明bsNOS中血红素是以五配位高自旋状态(5C-HS)和六配位低自旋状态(6C-LS)的混合物形式存在,而在室温下,主要以5C-HS状态存在。
1.3 细菌NOS的基因序列及克隆
细菌中存在NOS,最令人信服的证据为其体内存在合成NOS的基因序列。基因组序列测定结果显示,大多数细菌的开放阅读框架中存在编码类NOS蛋白的基因,它与哺乳动物NOSoxy基因序列有高度相似性(图2)。此外,其中似乎还含有一些H4B的合成基因。测序结果同时也说明,革兰氏阳性菌中不存在编码细菌NOS还原酶区域的基因。
细菌和真核生物NOS之间存在高度同源性,有约45%的氨基酸是完全相同的,50%~60%是类似的。系统进化树也表明这些同系物具有很高的相似度,几乎所有的血红素结合和活性位点的残基都是保守的。目前,细菌NOS已经可以进行克隆提取,在大肠杆菌中体外表达以得到有活性的蛋白,并可有效利用大肠杆菌中的还原酶而合成大量的NO[17]。

图2 几种典型的哺乳动物NOS与细菌NOS Alignment序列比对Fig.2 Multiple sequence alignments of mammal and bacterial NOS
1.4 细菌NOS的功能
直至目前,人们尚未完全弄清细菌NOS的功能。Cohen等[18]第一次研究了马铃薯疮痂链霉菌(Streptomyces turgidiscabies)体内NOS(stNOS)的功能,结果显示,NOS负责其植物毒素Thaxtomin的生物合成,能干扰植物细胞壁合成引起马铃薯疮痂病。它在致病岛上的位置和它接近编码非核糖体肽合成基因的位置(txtA和txtB)极大程度上证明了stNOS与Thaxtomin的硝化作用有关。因此,研究stNOS能为预防植物疮痂病变提供新的思路。此外,研究发现,drNOS具有硝酸盐活性,能在体外催化合成少量4-硝基-L-色氨酸[19]。
最新研究表明,一旦芽孢杆菌的NOS基因被破坏,其对氧化损伤会变得更敏感。NOS催化生成的NO可通过抑制巯基还原酶作用,有效抵抗芬顿反应(Fenton reaction)羟基的形成,从而保护细胞免受氧化和亚硝化应激,并因此减少DNA的损失细胞凋亡[20]。此外,NO还可用于直接活化特定的芽孢杆菌过氧化氢酶。对金黄色葡萄球菌的研究也得到了类似结果[21]。由于很多抗生素药物都是通过提高细菌的氧化压力而使细菌致死,NOS催化产生的内源性NO能够提高细菌对该类药物的抗药性,即NOS活性较强的细菌具有较强的耐药性。例如,一株敲除NOS的炭疽芽孢杆菌的变异体,其芽孢感染鼠模型后会失去它的毒性。因此,可以通过抑制NOS的活性或NOS的转录量,降低内源性NO浓度,从而达到削弱细菌的耐药性,提高现有抗生素药效的目的[22]。
2 细菌NOS在食品科学研究中的应用
一些食品中使用的细菌体内可能含有NOS,从而可催化L-精氨酸生成NO。主要有乳酸菌:包括植物乳杆菌(Lactobacillus plantarum)和发酵乳杆菌(Lactobacillus fermentum)等;葡萄球菌:主要包括木糖葡萄球菌(Staphylococcus xylosus);以及片球菌(Pediococcus sp.)和青紫色素杆菌(Chromabacterium violaceum)等。
2.1 肉制品呈色
肉类生产中经常使用亚硝酸盐作为腌制剂,但其一直是食物安全性的隐患。过量的亚硝酸盐摄入易导致高铁血红蛋白症,引起组织缺氧中毒;同时反应过程中生成的亚硝酸是致癌物质亚硝胺的前体。近年来,人们逐渐接受一些食用菌作为一类新型、健康和极具潜力的天然食品添加剂替代肉制品中亚硝酸盐的使用。
亚硝酸盐作为传统的肉制品护色剂,分解后被还原性物质作用生成NO,NO与肌肉纤维细胞中的还原型肌红蛋白结合,生成粉红色的亚硝基肌红蛋白(nitroso myoglobin,NO-Mb)。对一些肉制品发酵剂或从肉中分离得到的天然菌株研究发现,他们具有将高铁肌红蛋白(Met-Mb)转换为红色衍生物的能力,这表明其体内可能含有NOS[23]。
在肉类工业中乳酸菌是公认安全的微生物(generally recognized as safe,GRAS)。Arihara等[24]测试了超过1 550 种菌株,发现其中库特菌Kurthia sp. K-22、青紫色素杆菌C. violaceum K-28和发酵乳杆菌L. fermentum JCM1173可在厌氧条件下转化生成红色的肌红蛋白衍生物,但只有L. fermentum JCM1173菌株转化生成了NO-Mb。进一步研究发现,由于培养基中未添加亚硝酸盐,发酵乳杆菌JCM1173是在无亚硝酸盐的条件下将Met-Mb转变红色的NO-Mb的,这表明NO分子是由该菌株发酵代谢所得,即其体内含有NOS。
大量研究表明,某些发酵乳杆菌体内含有NOS,具有转化生成NO分子的能力。Morita等[25]分离得到10 株来源不同,可将Met-Mb转换为NO-Mb的发酵乳杆菌菌株。这10 株菌株中,L. fermentum IFO 3956具有最强的产NO-Mb能力,菌株细胞在标记有同位素15N的L-精氨酸培养基中将一个或两个终端胍基氮变成15NO。Møler等[26]进一步将L. fermentum JCM1173和L. fermentum IFO3956应用到无硝发酵肠生产中,均获得了稳定的腌肉颜色,证实这两株菌均能产NO,从而推测二者体内含有NOS:他同时提出,应进一步优化加工和发酵条件。Zhang Xue等[27]将L. fermentum AS1.1880应用到无硝哈尔滨红肠的制作中,进行适度发酵。结果表明,L. fermentum AS1.1880在发酵的过程中形成了NO-Mb,且NO-Mb生成量随菌种添加量的增加而增大。当发酵乳杆菌接种量为为108CFU/g时,其NO-Mb含量与60 mg/kg亚硝酸盐腌制肉无显著性差异(P>0.05),且香肠的风味和组织结构没有受到影响。Luo Zhen等[28]从中式干腌火腿中分离得到7 株乳酸菌,并将新鲜猪肉在经超声破碎后的菌株提取液中浸泡1 min,真空包装后于4 ℃条件下贮藏。研究发现在唾液乳杆菌(Lactobacillus salivarius CCTCC M2010374)的提取液中检测到了NOS活性。经过6 d贮藏后,唾液乳杆菌组肉样具有最高的红度值,其高铁肌红蛋白含量最低。由此可知,唾液乳杆菌中的NOS具有稳定新鲜猪肉颜色的作用。
人们对其他乳酸菌NOS也做了大量研究。Kart等[29]从不同来源如生牛乳、无盐黄油、贝亚斯片、酸奶、泡菜和青贮饲料样品中分离得到1 534 株乳酸菌,并测定了它们产NO的能力。结果发现10 株乳酸菌菌株可将M e t-M b转换为N O-M b,即可产生N O分子。经鉴定,其中5 株为植物乳杆菌,3 株为乳酸片球菌,2 株为肠膜状明串珠菌葡聚糖亚种。研究同时测定了各菌株产生N O的能力。结果表明,不仅不同菌种产生N O的能力不同,同一属的不同菌株间也存在差异。乳酸片球菌(Pediococcus acidilactici)S2组产NO浓度最高,植物乳杆菌L. plantarum T119和乳酸片球菌P. acidilactici S3其次,这3 株乳酸菌均具有很强的产NO能力。此外,Karahan等[30]发现L. plantarum DSM 9842亦含有类NOS蛋白。
葡萄球菌属是发酵香肠常用的发酵剂。Morita等[31]研究发现,木糖葡萄球菌S. xylosus FAX-1可将MRS肉汤培养基中Met-Mb转换为六配位的NO-Mb。Li Peijun等[32]从中式发酵干肠中分离得到木糖葡萄球菌和戊糖片球菌(Pediococcus pentosacous)并将其接种到不添加亚硝酸盐的MRS肉汤培养基和生肉糜中,观察二者转化Met-Mb的能力。结果表明,在培养基中,接种木糖葡萄球菌的样品具有典型的NO-Mb的特征吸收光谱,体系呈现明亮的粉红色,与对照组和接种戊糖片球菌组相比,具有更高的a*值(P<0.05)。在生肉糜中,接种木糖葡萄球菌组的a*值达到了亚硝酸盐腌制组相同的效果。进一步采用UV-Vis,电子自旋共振和拉曼共振光谱3 种方法分析了生肉糜组中红色衍生物的成分,结果表明,木糖葡萄球菌转化高生成了五配位的NO-Mb,进而表明木糖葡萄球菌具有产生一氧化氮的NOS。
2.2 肉制品嫩度
有研究表明,NO对屠宰后肉的嫩度有改善作用。Cook等[33]向宰后2 h并去骨的热牛肉背最长肌中注射NO供体作为增强剂,并在随后2~6 d的成熟期间,观察到了肉嫩度的显著增强。研究同时发现,向肉中注射NOS抑制剂会使肉硬度增加,这主要是由于NO通过调节钙蛋白酶、组织蛋白酶和肌浆网中的Ryanodine受体通道,导致内质肌浆释放其中的钙离子ATP酶引起的。这与Cottrell等[34]的实验结果一致。因此,利用产NOS的发酵剂菌种生产发酵肉制品,细菌NOS催化合成的NO可用于改善发酵肉制品的嫩度品质。
2.3 抑菌和抗氧化作用
细菌NOS催化生成的NO具有抑菌作用,可用于提高食品安性。研究表明,NO分子能抑制芽孢杆菌、金黄色葡萄球菌和大肠杆菌的生长[35],这主要是由于NO与铁硫化合物反应形成铁-亚硝酰化物,后者的存在导致了诸如铁氧化还原蛋白等Fe-S-NO复合物的破坏[36]。而Fe-S蛋白在需氧和厌氧细菌的能量代谢中都有重要作用,因此推断其是NO和相应复合物抑菌作用的靶目标。此外,NO还可与RNA的还原酶是相关位点结合,以及攻击锌指类型(zinc fi nger-type)的DNA连接蛋白,影响到基因的调节作用,从而起到抑菌作用[37]。
在奶酪生产过程中,会丁酸梭状芽孢杆菌(Clostridium butyricum)发酵产气会导致奶酪中产生大的孔洞,造成质量缺陷。Beresford等[38]将亚硝酸盐应用于奶酪生产中,以抑制两种细菌的生长。研究同时发现,它对包括生孢子梭状芽孢杆菌(Clostridium sporogenes)和产气荚膜梭菌(Clostridium perfringens)在内的其他梭状芽孢杆菌也有较好的抑制效果。究其原因,正是由于NO分子与上述细菌体内丙酮酸-铁氧化还原蛋白酶的非血红素铁形成了复合物导致的。
此外,NO作为自由基受体,自身也具有抗氧化特性,可稳定不饱和脂质。在相同体系中,半胱氨酸-Fe2+具有很强的氧化性,可以促使β-胡萝卜素发生氧化,但半胱氨酸-Fe-NO不能[39]。因此,利用细菌NOS催化合成NO,可以作为食品中的抗氧化剂发挥作用。
2.4 益生作用
Bengmark等[40]认为具有催化L-精氨酸产生NO的益生乳杆菌在人类健康中起重要作用。植物乳杆菌作为益生菌具有分解L-精氨酸的功能,它不能降解除酪氨酸和L-精氨酸外的其他氨基酸,但却有6 条途径利用L-精氨酸,且每一条途径都有NO生成。尤其在厌氧贮藏的食品中,植物乳杆菌会逐渐发展成为优势菌。
L-精氨酸是胃肠(gastrointestinal,GI)途径中最重要NO供体。GI途径中由NOS释放的NO与一系列重要的功能有关,如抑菌作用、黏液分泌髓鞘形成、活力调节和内脏血液循环。胃中的L-精氨酸经NOS催化,产生的NO能有效控制白色念珠菌(Candida albicans)、大肠杆菌(Escherichia coli)、志贺杆菌(Shigella sp.)、沙门氏菌(Salmonella)和幽门螺旋杆菌(Helicobacter pylori)的生长。研究表明,人类特性的L. plantarum strains 299和299V,对黏膜的黏连性有保护作用,能够建立起生物保护盾以防止病原微生物的过度生长以及大肠杆菌内毒素的进入[40]。这一功能是通过L-精氨酸产NO途径实现的,因此由益生菌NOS催化的反应对人体健康有重要作用。
3 结 语
全基因组测序的应用大大加速了细菌NOS的探索。细菌NOS的研究使我们对NO在原核生物中的合成和功能有更多的了解,提出了一些理论上关于NO生化反应有趣的问题。细菌NOS将继续作为一个易于研究的课题揭示NO合成的详细机理。此外,细菌NOS的研究定会揭示NO在微生物中其他的生化途径和新功能。我们希望发现NOS在化学和生物上新的一面。
目前,已有一些关于细菌NOS在食品科学研究中的报道。然而,食品基质中NO的具体产生途径仍不明确,另外,如何实现产NOS菌株工业化的问题目前仍是食品工业中需要迫切解决的问题。此外,还应考虑产NOS菌株的安全性和对食品品质的影响问题,例如如何利用稳定而可控的方法产NO,以及评估含有NOS菌株作为食品发酵剂对人类健康的影响等[41]。
[1] NAPOLI C, PAOLISSO G, CASAMASSIMI A, et al. Effects of nitric oxide on cell proliferation: novel insights[J]. Journal of the American College of Cardiology, 2013, 62(2): 89-95.
[2] 杨彦鹏, 罗素新, 夏勇. 诱导型一氧化氮合酶在心肌缺血/ 再灌注损伤中的研究进展[J]. 心血管病学进展, 2012, 33(2): 278-281.
[3] LI Wenbing, CHEN Li, LU Changyuan, et al. Regulatory role of Glu546 in flavin mononucleotide heme electron transfer in human inducible nitric oxide synthase[J]. Inorganic Chemistry, 2013, 52(9): 4795-4801.
[4] CHEN Yijun, ROSAZZA J P. A bacterial, nitric oxide synthase from a Nocardia species[J]. Biochemical and Biophysical Research Communications, 1994, 203(2): 1251-1258.
[5] PATEL B A, CRANE B R. When it comes to antibiotics, bacteria show some NO-how[J]. Journal of Molecular Cell Biology, 2010, 2(5): 234-236.
[6] CHEN Yijun, ROSAZZA J. Purification and characterization of nitric oxide synthase (NOSNoc) from a Nocardia species[J]. Journal of Bacteriology, 1995, 177(17): 5122-5128.
[7] HONG I S, KIM Y K, CHOI W S, et al. Purification and characterization of nitric oxide synthase from Staphylococcus aureus[J]. FEMS Microbiology Letters, 2003, 222(2): 177-182.
[8] SALARD-ARNAUD I, STUEHR D, BOUCHER J L, et al. Spectroscopic, catalytic and binding properties of Bacillus subtilis NO synthase-like protein: comparison with other bacterial and mammalian NO synthases[J]. Journal of Inorganic Biochemistry, 2012, 106(1): 164-171.
[9] REECE S Y, WOODWARD J J, MARLETTA M A. Synthesis of nitric oxide by the NOS-like protein from Deinococcus radiodurans: a direct role for tetrahydrofolate[J]. Biochemistry, 2009, 48(23): 5483-5491.
[10] CRANE B R, SUDHAMSU J, PATEL B A. Bacterial nitric oxide synthases[J]. Annual Review of Biochemistry, 2010, 79: 445-470.
[11] RAFFERTY S. Nitric oxide synthases of bacteria and other unicellular organisms[J]. Open Nitric Oxide Journal, 2011, 3: 25-32.
[12] SUDHAMSU J, CRANE B R. Bacterial nitric oxide synthases: what are they good for?[J]. Trends in Microbiology, 2009, 17(5): 212-218.
[13] JONES M L, GANOPOLSKY J G, LABBÉ A, et al. Antimicrobial properties of nitric oxide and its application in antimicrobial formulations and medical devices[J]. Applied Microbiology and Biotechnology, 2010, 88(2): 401-407.
[14] AGAPIE T, SUSENO S, WOODWARD J J, et al. NO formation by a catalytically self-sufficient bacterial nitric oxide synthase from Sorangium cellulosum[J]. Proceedings of the National Academy of Sciences, 2009, 106(38): 16221-16226.
[15] ANDREAKIS N, D’ANIELLO S, ALBALAT R, et al. Evolution of the nitric oxide synthase family in metazoans[J]. Molecular Biology and Evolution, 2011, 28(1): 163-179.
[16] BRUNEL A, WILSON A, HENRY L, et al. The proximal hydrogen bond network modulates Bacillus subtilis nitric-oxide synthase electronic and structural properties[J]. Journal of Biological Chemistry, 2011, 286(14): 11997-12005.
[17] LIU Pulin, HUANG Qiaoyun, CHEN Wenli. Heterologous expression of bacterial nitric oxide synthase gene: a potential biological method to control biofilm development in the environment[J]. Canadian Journal of Microbiology, 2012, 58(3): 336-344.
[18] COHEN M F, LAMATTINA L, YAMASAKI H. Nitric oxide signaling by plant-associated bacteria[M]//HAYAT S, MORI M, PICHTEL J, et al. Nitric oxide in plant physiology. Weinheim, Germany: Wiley-VCH, 2010: 161-172.
[19] MESSNER S, LEITNER S, BOMMASSAR C, et al. Physarum nitric oxide synthases: genomic structures and enzymology of recombinant proteins[J]. Biochemical Journal, 2009, 418: 691-700.
[20] SINGH V K. Antioxidant functions of nitric oxide synthase in a methicillin sensitive Staphylococcus aureus[J]. International Journal of Microbiology, 2013, 2013: 1-6.
[21] van SORGE N M, BEASLEY F C, GUSAROV I, et al. Methicillinresistant Staphylococcus aureus bacterial nitric-oxide synthase affects antibiotic sensitivity and skin abscess development[J]. Journal of Biological Chemistry, 2013, 288(9): 6417-6426.
[22] GUSAROV I, SHATALIN K, STARODUBTSEVA M, et al. Endogenous nitric oxide protects bacteria against a wide spectrum of antibiotics[J]. Science, 2009, 325: 1380-1384.
[23] 李丽琴, 李潮光, 陈惠俏. 灭活乳酸菌对鲜肉的护色效果研究[J]. 时代报告: 学术版, 2012(6): 328-330.
[24] ARIHARA K, KUSHIDA H, KONDO Y, et al. Conversion of Metmyoglobin to Bright Red Myoglobin Derivatives by Chromobacterium violaceum, Kurthia sp., and Lactobacillus fermenturn JCM1173[J]. Journal of Food Science, 1993, 58(1): 38-42. [25] MORITA H, YOSHIKAWA H, SAKATA R, et al. Synthesis of nitric oxide from the two equivalent guanidino nitrogens of L-arginine by Lactobacillus fermentum[J]. Journal of Bacteriology, 1997, 179(24): 7812-7815.
[26] MøLLER J K, JENSEN J S, SKIBSTED L H, et al. Microbial formation of nitrite-cured pigment, nitrosylmyoglobin, from metmyoglobin in model systems and smoked fermented sausages by Lactobacillus fermentum strains and a commercial starter culture[J]. European Food Research and Technology, 2003, 216(6): 463-469.
[27] ZHANG Xue, KONG Baohua, XIONG Youling. Production of cured meat color in nitrite-free Harbin red sausage by Lactobacillus fermentum fermentation[J]. Meat Science, 2007, 77(4): 593-598.
[28] LUO Zhen, GASASIRA V, HUANG Yuhui, et al. Effect of Lactobacillus salivarius H strain isolated from Chinese dry-cured ham on the color stability of fresh pork[J]. Food Science and Human Wellness, 2013, 2(3/4): 139-145.
[29] KART A. The isolation of Lactobacillus from milk and milk products, silage and pickle and determination of their capability of nitric oxide formation[D]. Turkey Isparta: SD U Graduate School of Natural and Applied Sciences, 2002.
[30] KARAHANA A G, ÇAKMAKÇI M L, CICIOGLU-ARIDOGAN B, et al. Nitric oxide (NO) and lactic acid bacteria-contributions to health, food quality, and safety[J]. Food Reviews International, 2005, 21(3): 313-329.
[31] MORITA H, SAKATA R, NAGATA Y. Nitric oxide complex of iron (Ⅱ) myoglobin converted from metmyoglobin by Staphylococcus xylosus[J]. Journal of Food Science, 1998, 63(2): 352-355.
[32] LI Peijun, KONG Baohua, CHEN Qian, et al. Formation and identification of nitrosylmyoglobin by Staphylococcus xylosus in raw meat batters: a potential solution for nitrite substitution in meat products[J]. Meat Science, 2013, 93(1): 67-72.
[33] WARNER R, DUNSHEA F, PONNAMPALAM E, et al. Effects of nitric oxide and oxidation in vivo and postmortem on meat tenderness[J]. Meat Science, 2005, 71(1): 205-217.
[34] COTTRELL J J, MCDONAGH M, DUNSHEA F, et al. Inhibition of nitric oxide release pre-slaughter increases post-mortem glycolysis and improves tenderness in ovine muscles[J]. Meat Science, 2008, 80(2): 511-521.
[35] VALLANCE P, CHARLES I. Nitric oxide as an antimicrobial agent: does NO always mean NO?[J]. Gut, 1998, 42(3): 313-314.
[36] 董庆利, 屠康. 腌制肉中亚硝酸盐抑菌机理的研究进展[J]. 现代生物医学进展, 2006, 6(3): 48-52.
[37] LI Huihua, CAO Rong, WASSERLOOS K J, et al. Nitric oxide and zinc homeostasis in pulmonary endothelium[J]. Annals of the New York Academy of Sciences, 2010, 1203(1): 73-78.
[38] BERESFORD T P, FITZSIMONS N A, BRENNAN N L, et al. Recent advances in cheese microbiology[J]. International Dairy Journal, 2001, 11(4): 259-274.
[39] LANCASTER J R J. Nitric oxide: principles and actions[M]. San Diego: Elsevier, 1996.
[40] BENGMARK S. Ecological control of the gastrointestinal tract. The role of probiotic flora[J]. Gut, 1998, 42(1): 2-7.
[41] 李沛军, 孔保华, 郑冬梅. 微生物发酵法替代肉制品中亚硝酸盐呈色作用的研究进展[J]. 食品科学, 2010, 31(17): 388-391.
Bacterial Nitric Oxide Synthase and Its Application in Food Science: a Review
LUO Hui-ting1, KONG Bao-hua1,*, LI Pei-jun1,2, LI Mu-zi1
(1. College of Food Science, Northeast Agricultural University, Harbin 150030, China; 2. School of Biology and Food Engineering, Hefei University of Technology, Hefei 230009, China)
Nitric oxide synthase (NOS) is a regulatory enzyme ubiquitous in mammals that has an important catalytic function in producing nitric oxide. Its presence in bacteriahas been detected in recent decades. This paper summarizes the structure, biochemical characteristics and biological functions of bacterial NOS. Meanwhile, the application of bacterial NOS in food science is also discussed. Moreover, the future research and development trends are proposed.
nitric oxide synthase; bacteria; food science; application
TQ920.1
A
1002-6630(2014)17-0266-06
10.7506/spkx1002-6630-201417051
2013-09-21
国家自然科学基金面上项目(31271897);“十二 五”国家科技支撑计划项目(2012BAD28B02)
罗慧婷(1990—),女,硕士,研究方向为肉品加工与贮藏。E-mail:luohuiting900427@gmail.com
*通信作者:孔保华(1963—),女,教授,博士,研究方向为畜产品加工。E-mail:kongbh@163.com
