多不饱和脂肪酸对大鼠肠道菌群及脂肪代谢相关基因的影响
2014-01-21乔立君马文慧芦庭秀盖晓英葛银林
乔立君,郑 征,马文慧,芦庭秀,盖晓英,葛银林
多不饱和脂肪酸对大鼠肠道菌群及脂肪代谢相关基因的影响
乔立君,郑 征,马文慧,芦庭秀,盖晓英,葛银林*
(青岛大学医学院,生物化学与分子生物学教研室,山东 青岛 266021)
目的:研究多不饱和脂肪酸(polyunsaturated fat acids,PUFA)饮食对大鼠肠道菌群及相关脂肪因子的影响,探讨其作用机理。方法:将30 只5 周龄健康大鼠分为正常对照组、n-6 PUFA组和n-3 PUFA组,自由摄食饮水8 周,每周记录大鼠体质量,实验结束时取大鼠盲肠粪便和肝脏,用实时荧光定量聚合酶链式反应检测双歧杆菌(Bifi dobacterium,Bif)、乳酸杆菌(Lactobacillus,Lac)、肠道细菌Akkermansia muciniphila(Akk)和脂肪因子脂肪酸合成酶(fatty acid synthetase,FAS)、禁食诱导脂肪因子(fasting-induced adipose factor,FIAF)的水平;并将大鼠盲肠石蜡包埋、切片、苏木精-伊红染色测量其黏膜厚度。结果:n-3 PUFA组与正常对照组相比,肥胖程度和FAS水平明显降低(P<0.05),Bif、Lac、Akk和FIAF水平明显升高(P<0.05),肠道黏膜厚度明显增加;n-6 PUFA组大鼠的各项指标和正常对照组相比均无统计学差异。结论:n-3 PUFA饮食与n-6 PUFA饮食相比,可改变肠道菌群,抑制肥胖的发生和发展。
n-3多不饱和脂肪酸;肥胖;Akkermansia muciniphila;肠道黏膜
肥胖是指一定程度的明显超重与脂肪层过厚,是体内脂肪,尤其是甘油三酯积聚过多而导致的一种状态。由于食物摄入过多或机体代谢的改变而导致体内脂肪积聚过多,造成体质量过度增长并引起人体病理、生理改变或潜伏。历年来,肥胖一直是人们急需解决的问题。有不少研究证明,鱼油中的n-3多不饱和脂肪酸(polyunsaturated fat acids,PUFA)可对脂肪因子产生影响,有一定的减肥作用。n-3 PUFA,尤其是二十碳五烯酸(eicosapentaenoic acid,EPA)和二十二碳六烯酸(docosahexaenoic acid,DHA)具有很强的生理活性,对人和动物的多种疾病,如癌症等具有特殊的预防和治疗效果,是一种重要的免疫调理性营养素。n-3 PUFA作为 一种特殊的肠内营养素,可以减轻肠道黏膜损伤,促进肠道炎症愈合,对肠道具有保护作用,但关于其对肠道微生态影响方面的文献报道并不多。本实验通过实时荧光定量聚合酶链式反应(quantity real-time polymerase chain reaction,qRT-PCR)方法,观察n-3 PUFA对实验组大鼠肠道菌群和脂肪因子的影响,探讨鱼油对大鼠肠道生物屏障的影响,为n-3 PUFA作为防治肠道相关疾病的营养素提供新的理论依据。
1 材料与方法
1.1 动物、材料与试剂
SPF级Wistar雌性大鼠购自上海斯莱克实验动物有限责任公司。
标准实验动物饲料 济南康大饲料有限公司;脱脂甜奶粉 瑞士雀巢公司;脱脂大豆粉 青岛美辰食品公司;深海鱼油 美国康隆公司;维生素A、D胶丸青岛双鲸药业有限公司;其他试剂均为分析纯。
各组饲料配方参照本实验室饲料制备配比见表1,饲料制备后4 ℃低温保存。

表1 各组饲料成分配方Table 1 Ingredients of rat diets
1.2 仪器与设备
DW-86L626超低温冰箱、BCD-196TE冰箱 青岛海尔公司;SIGMA 1-13离心机 美国Sigma公司;PYXDHS隔水式电热恒温培养箱 上海跃进医疗器械厂;RG-3000荧光定量PCR仪 英国Corbett Research公司;RM2235切片机 德国莱卡公司。
1.3 方法
1.3.1 动物分组和实验设计
30 只SPF级5 周龄雌性Wistar大鼠,体质量100~120 g,随机分为正常对照组、n-3 PUFA组和n-6 PUFA组。正常对照组体质量为(116.40±0.10)g;n-3 PUFA组体质量为(109.33±0.28)g;n-6 PUFA组体质量为(115.62±0.52)g。每组分为3 笼,自由摄食饮水。实验动物房温度(22±5)℃,相对湿度(50±10)%,明暗周期12 h/12 h。每周记录每只大鼠的体质量。第8周末时注射质量分数为10%的水合氯醛,处死大鼠,记录每只大鼠肛门到鼻尖的长度作为体长,无菌条件下取大鼠肠道粪便分装于灭菌的5 mL离心管中,于-70 ℃保存。取大鼠肝脏于-70 ℃保存,取大鼠回肠、结肠、盲肠浸入体积分数为10%的甲醛固定24 h,进行石蜡包埋、切片,以备苏木精-伊红(hematoxylin-eosin,HE)染色。
1.3.2 粪便样品的处理及肠道细菌总DNA的提取
粪便样品处理参照参考文献[1]。处理好的样品于-20 ℃保存。
肠道细菌总DNA的提取采用十六烷基三甲基溴化铵法(hexadecyltrimethy ammonium bromide,CTAB)法提取,具体步骤参照参考文献[2]。提取的DNA于-20 ℃保存。
1.3.3 肝脏总RNA提取
称取50~100 mg肝脏组织,用Trizol(TaKaRa)提取,按试剂盒步骤进行。提取的总mRNA用Roche反转录试剂盒进行cDNA的合成。
1.3.4 聚合酶链式反应(polymerase chain reaction,PCR)引物
双歧杆菌(Bifidobacterium,Bif)、乳酸杆菌(Lactobacillus,Lac)引物参照参考文献[3],肠道细菌Akkermansia muciniphila(Akk)引物参照参考文献[4],由生工生物工程(上海)股份有限公司合成;禁食诱导脂肪因子(fasting-induced adipose factor,FIAF)和脂肪酸合成酶(fatty acid synthetase,FAS)引物由生工生物工程(上海)股份有限公司设计并合成,见表2。

表2 各引物序列Table 2 Sequence of primers used in this study
1.3.5 实时定量PCR
肠道菌群的实时定量PCR。25 μL反应体系包括:12.5 μL SYBR Premix Ex Taq(Roche),200 nmol/L引物,1 μL DNA样品。Bif、Lac反应条件为:95 ℃ 5 min,95 ℃ 15 s,58 ℃ 30 s,72 ℃ 30 s,共40 个循环,72 ℃延伸5 min,Akk退火温度为60 ℃。每个样本重复3 次,以2-ΔΔCt表示样本中mRNA的相对表达量。
以提取的DNA样本为模板,用各基因的特殊引物(表2)进行普通PCR,得到PCR产物经DNA片段纯化试剂盒纯化后与T载体连接,构建质粒转化大肠杆菌。质粒用DNA提取试剂盒提取后作为qRT-PCR的对照。
脂肪基因的实时定量PCR。25 μL反应体系包括:12.5 μL SYBR Premix Ex Taq(Roche),200 nmol/L引物,500 ng RNA样品。反应条件为:95 ℃ 5 min,95 ℃ 15 s,60 ℃ 30 s,72 ℃ 30 s,共40 个循环,72 ℃延伸5 min,每个样本重复2 次,以2ΔΔ-Ct表示样本中mRNA的相对表达量。
1.3.6 HE染色测量肠道黏膜厚度
取近结肠处约1 cm长,固定在体积分数为10%的甲醛溶液中24 h后,用磷酸盐缓冲液清洗24 h,分别浸入55%、65%、75%、85%、95%、100%乙醇中脱水,再放入二甲苯中,之后浸蜡包埋,切片进行HE染色。每个部位最少测量与黏液层垂直的20 个厚度值,随机选取每个结肠的5 个部位,用图像分析系统(Image-Pro Plus 6.3)测量。
1.4 数据处理
结果以x±s表示,采用单因素方差分析(One-Way ANOVA)对每周体质量增加量、体质量/体长等作统计学分析,用t检验进行各组间的两两比较。显著性水平设为P<0.05。
2 结果与分析
2.1 体质量、体长的测定结果

图1 3 组大鼠每周体质量平均增加量和体质量/体长Fig.1 Comparisons of average body weight and weight/length ratio between rats fed high fat diet and those fed n-3 or n-6 PUFA-containing diet or common diet
由图1可知, 3 组大鼠的每周体质量增加量的平均值(F=5.374,P=0.013<0.05)差异有统计学意义;n-3 PUFA组大鼠的每周体质量增加量的平均值显著低于正常对照组(P<0.05);n-3 PUFA组的体质量/体长值增加趋势缓慢。n-6 PUFA组和正常对照组之间无显著性差异。表明n-3 PUFA组大鼠的肥胖程度显著低于另外两组。
2.2 实时定量结果
2.2.1 肠道菌群结果

图2 3 组大鼠种肠道菌群的变化Fig.2 Changes in gut microbiota between rats fed high fat diet and those fed n-3 or n-6 PUFA-containing diet or common diet
由图2可知,n-3 P U FA组和正常对照组相比,Bif、Lac和Akk均显著增加,差异有统计学意义(t=2.229,P=0.047 6<0.05;t=2.653,P=0.021 0<0.05;t=1.680,P=0.001 3<0.05);而n-6 PUFA组的Bif虽也有所增加,但与正常对照组相比,二者之间仍无显著性差异(P=0.099 6);n-6 PUFA组中Akk变化量低于正常对照组,但没有统计学意义(P=0.121 2)。
2.2.2 肝脏脂肪代谢相关基因结果


图3 肝脏中2 种脂肪因子的变化Fig.3 Changes in liver adi pocytokines
由图3可知,3 个组FAS mRNA和FIAF mRNA之间的相对表达量差异有统计学意义(F=4.391,P=0.023 7<0.05;F=4.094,P=0.029 5<0.05);n- 3PUFA组FIAF与正常对照组相比表达量增加(P=0.040 3<0.05),与n-6 PUFA组相比无显著性差异(P=0.0572);n-3 PUFA组FAS表达量减少与正常对照组相比差异有统计学意义(P=0.041 1<0.05);而n-6 PUFA组FAS表达量增加,和正常对照组相比有显著性差异(P=0.010 3<0.05)。
2.3 肠道黏膜厚度
由图4可知,在100×显微镜下获取图片,用图像分析仪测量各组结肠肠道黏膜的厚度,差异有统计学意义(F=14.10,P<0. 01);n-3 PUFA组与正常对照组相比厚度增加(P=0.003 4<0.05);而n-6 PUFA组和正常对照组之间无显著性差异(P=0.056 0)。
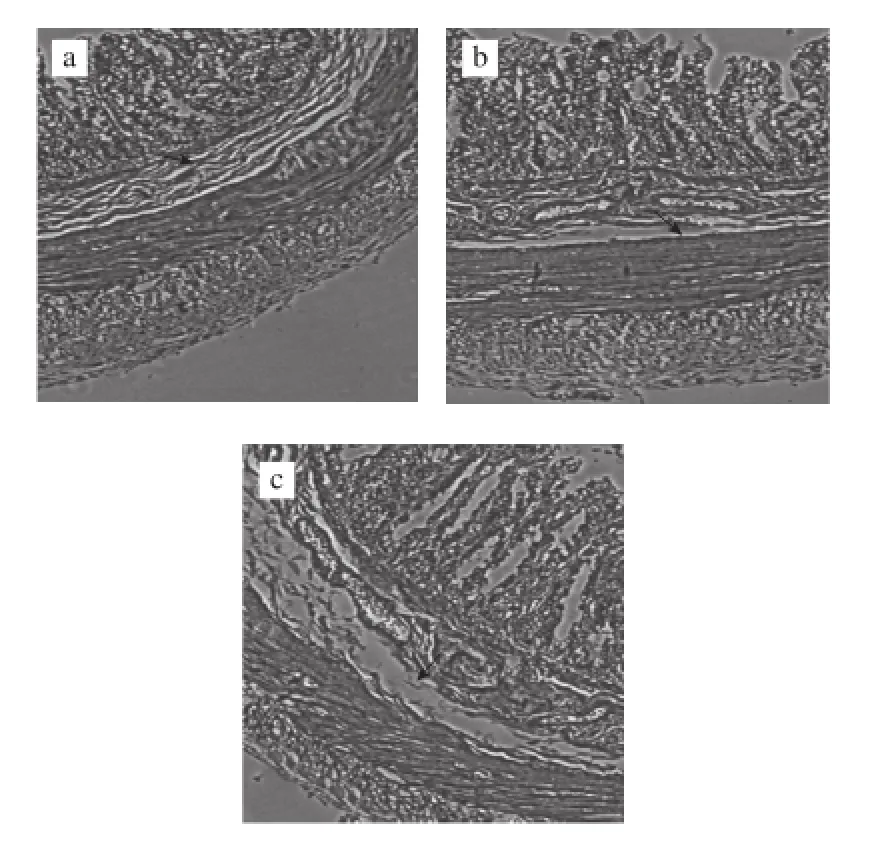
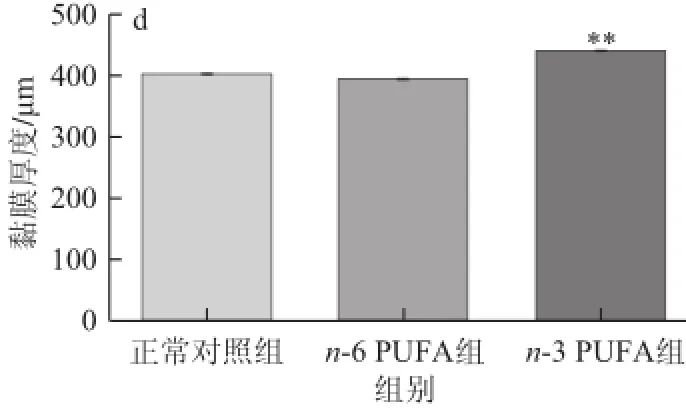
图4 3 组肠道黏膜厚度的比较Fig.4 Comparison of intestinal mucus thickness among three groups
3 讨 论
近年来,n-3 PUFA对健康的影响越来越受到人们的重 视。n-3 PUFA是一类重要的多不饱和脂肪酸,主要包括EPA、DHA、二十二碳五烯酸、二十碳四烯酸、α-亚麻酸(alpha-linolenic acid,ALA)。其中EPA和DHA的营养保健作用最有效。摄入一定量的EPA和DHA可以降低肥胖成年人体内的脂肪含量,促进脂肪的利用[5];增强2型糖尿病患者体内胰岛素的敏感性,缓解胰岛素抵抗性[6],显著降低糖尿病患者血清甘油三酯和血脂水平[7]。本实验中,长期给大鼠喂食添加n-3 PUFA的食物后,可有效地控制其肥胖的发生,降低其肥胖程度,说明EPA和DHA对大鼠有减肥作用,该结果与相关报道一致[5]。
肠道菌群结构对维持肠道内环境平衡起着非常重要的作用,人体是否健康与肠道内的益生菌群结构息息相关,因此,人体在正常情况下,菌群结构相对稳定,对宿主表现为不致病。相反,如果肠道菌群失调,会引起各种疾病。有研究指出,有益菌的比例在体格强健的人肠道内达到70%,普通人则是25%,便秘人群减少到15%,而在癌症病人肠道内的比例只有10%。近年来,随着相关研究论文的发表,肠道菌群与肠道内环境平衡和疾病的关系逐步清晰。有证据表明,肠道菌群可以调控脂肪代谢、引发低度慢性炎症[8]和破坏肠道屏障[9-11],可以导致胰岛素抵抗和肥胖症的发生[12-13]。肠道菌群对肠黏膜系统的机械屏障、免疫屏障与生物屏障有调控作用。肠道中的大肠杆菌可以通过上调紧密连接蛋白ZO-1的表达,减轻肠上皮的通透性[14]。乳酸杆菌可以对病原菌的定殖产生阻抗作用[15],能较好地恢复小鼠的肠黏膜免疫屏障功能[16]。双歧杆菌可以有效减少乳糜泻患者中由小麦醇溶蛋白引起的结肠上皮细胞的细胞膜皱褶[17],从而调控肠道的机械屏障。肠道菌群会随着饮食的变化而变化,研究表明,饮食是决定肠道菌群构成的最重要因素。因此,通过改变饮食,可以让引起肥胖、糖尿病[18]、冠心病[19]的菌群结构恢复正常,从而为预防、缓解甚至逆转这些疾病带来新的希望。本实验中,通过检测n-3、n-6 PUFA对大鼠肠道菌群的影响发现,n-3 PUFA可以增加肠道内一些益生菌如Bif、Lac、Akk的含量,从而影响大鼠肠道内 的菌群环境,改善大鼠的体内微环境,调控肠道的屏障功能。
Akk是一种革兰氏阴性菌,是疣微菌门的一种。近日,Akk被确定为驻留在黏液层的黏蛋白降解细菌,并且它在营养丰富的环境中的人类细菌中占主导地位[20]。最新研究表明,Akk是一种减肥细菌,益生元(低聚果糖)能促进其在肠 道内的丰富度。它通过增加肠道黏膜的厚度来提高肠道黏膜屏障功能,维持葡萄糖稳态和提高脂肪组织代谢。在饮食诱导的肥胖小鼠中Akk能改善代谢混乱,增加回肠中内源性大麻素的水平,抵消肥胖中饮食引起的结肠黏膜屏障的功能紊乱[18]。在本实验中,n-3 PUFA组大鼠的肠道黏膜厚度显著高于另外2 组,这可能与肠道菌群Akk的含量有关。进一步说明,n-3 PUFA可能通过改善肠道菌群,增加黏膜厚度,来提高肠道黏膜屏障功能。
FAS是脂肪酸合成的主要限制酶,它在乙酰辅酶A和丙二酸单酰辅酶A从头合成长链脂肪酸的过程中起催化作用。有研究指出,n-3 PUFA不仅能在蛋白水平抑制FAS的活性[21],而且还能在转录水平抑制FAS基因的表达[22-23]。另外,相关研究表明,肠道菌群作为内化了的环境因子,可以直接调控动物的基因表达,它们可以增强肝脏合成脂肪的基因FAS的活性,同时关闭肠道内抑制脂肪积累的基因FIAF[24]。FIAF也称为血管生成素样蛋白4,是过氧化物酶体增殖物激活受体的新靶点[25],是一种新的下丘脑调节器,它可以调节食物的摄取,从而影响体质量[26]。本实验中,n-3 PUFA组FAS表达量减少,FIAF表达量增加,可能一方面通过n-3 PUFA直接影响基因的转录,另一方面可能通过n-3 PUFA影响肠道菌群的量来间接影响基因的合成。这说明n-3 PUFA可能从多方面影响基因合成,从而达到减肥的目的。
综上所述,本实验讨论了n-3 PUFA对肠道菌群的影响及其对肥胖的抑制作用的可能途径。这些结果提示n-3 PUFA可能通过改变肠道菌群中的有益菌,特别是Akk,改善肠道微环境,增加肠黏膜厚度,提高肠道黏膜屏障功能,并通过控制脂肪代谢相关基因的表达来达到减肥的目的。同时,为人类使用这种肠道细菌用于预防或治疗肥胖症和其相关的代谢紊乱提供了新的治疗方法。
[1] 张雪雁, 李琳琳. 一种提取肠道细菌总基因组DNA的方法[J]. 新疆医科大学学报, 2007, 30(7): 722-724.
[2] van PASSEL M W J, KANT R, ZOETENDAL E G, et al. The genome of Akkermansia muciniphila, a dedicated intestinal mucin degrader, and its use in exploring intestinal metagenomes[J]. PLoS One, 2011, 6(3): e16876.
[3] CANI P D, BIBILONI R, KNAUF C, et al. Changes in gut microbiota control metabolic endotoxemia-induced inflammation in high-fat diet-induced obesity and diabetes in mice[J]. Diabetes, 2008, 57(6): 1470-1481.
[4] COLLADO M C, DERRIEN M, ISOLAURI E, et al. Intestinal integrity and Akkermansia muciniphila, a mucin-degrading member of the intestinal microbiota present in infants, adults, and the elderly[J]. Applied and Environmental Microbiology, 2007, 73(23): 7767-7770.
[5] MUNRO I A, GARG M L. Dietary supplementation with long chain omega-3 polyunsaturated fatty acids and weight loss in obese adults[J]. Obesity Research & Clinical Practice, 2013, 7(3): e173-e181.
[6] POPP-SNIJDERS C, SCHOUTEN J A, HEINE R J, et al. Dietary supplementation of omega-3 polyunsaturated fatty acids improves insulin sensitivity in non-insulin-dependent diabetes[J]. Diabetes Research (Edinburgh, Scotland), 1987, 4(3): 141-147.
[7] MONTORI V M, FARMER A, WOLLAN P C, et al. Fish oil supplementation in type 2 diabetes: a quantitative systematic review[J]. Diabetes Care, 2000, 23(9): 1407-1415.
[8] OSBORN O, OLEFSKY J M. The cellular and signaling networks linking the immune system and metabolism in disease[J]. Nature Medicine, 2012, 18(3): 363-374.
[9] CANI P D, AMAR J, IGLESIAS M A, et al. Metabolic endotoxemia initiates obesity and insulin resistance[J]. Diabetes, 2007, 56(7): 1761-1772.
[10] CANI P D, POSSEMIERS S, van de WIELE T, et al. Changes in gut microbiota control inflammation in obese mice through a mechanism involving GLP-2-driven improvement of gut permeability[J]. Gut, 2009, 58(8): 1091-1103.
[11] MUCCIOLI G G, NASLAIN D, BÄCKHED F, et al. The endocannabinoid system links gut microbiota to adipogenesis[J]. Molecular Systems Biology, 2010, 6(1). doi: 10.1038/msb.2010. 46.
[12] CANI P D, DELZENNE N M, AMAR J, et al. Role of gut microflora in the development of obesity and insulin resistance following high-fat diet feeding[J]. Pathologie Biologie, 2008, 56(5): 305-309.
[13] DING Shengli, CHI M M, SCULL B P, et al. High-fat diet: bacteria interactions promote intestinal inflammation which precedes and correlates with obesity and insulin resistance in mouse[J]. PLoS One, 2010, 5(8): e12191. doi:10.1371/journal.pone.0012191.
[14] ZYREK A A, CICHON C, HELMS S, et al. Molecular mechanisms underlying the probiotic effects of Escherichia coli Nissle 1917 involve ZO-2 and PKCzeta redistribution resulting in tight junction and epithelial barrier repair[J]. Cell Microbiol, 2007, 9(3): 804-816.
[15] LINDFORS K, BLOMQVIST T, JUUTI-UUSITALO K, et al. Live probiotic Bifidobacterium lactis bacteria inhibit the toxic effects induced by wheat gliadin in epithelial cell culture[J]. Clinical & Experimental Immunology, 2008, 152(3): 552-558.
[16] CANO P G, AGÜERO G, PERDIGON G. Adjuvant effects of Lactobacillus casei added to a renutrition diet in a malnourished mouse model[J]. Biocell, 2002, 26(1): 35-48.
[17] CANDELA M, PERNA F, CARNEVALI P, et al. Interaction of probiotic Lactobacillus and Bifidobacterium strains with human intestinal epithelial cells: adhesion properties, competition against enteropathogens and modulation of IL-8 production[J]. International Journal of Food Microbiology, 2008, 125(3): 286-292.
[18] EVERARD A, BELZER C, GEURTS L, et al. Cross-talk between Akkermansia muciniphila and intestinal epithelium controls dietinduced obesity[J]. Proceedings of the National Academy of Sciences, 2013, 110(22): 9066-9071.
[19] STOCK J. Gut microbiota: an environmental risk factor for cardiovascular disease[J]. Atherosclerosis, 2013, 229(2): 440-442.
[20] DERRIEN M, VAUGHAN E E, PLUGGE C M, et al. Akkermansia mucinip hila gen. nov., sp. nov., a human intestinal mucin-degrading bacterium[J]. International Journal of Systematic and Evolutionary Microbiology, 2004, 54(5): 1469-1476.
[ 21] CLARKE S D, HEMBREE J. Inhibition of triiodothyronine’s induction of rat liver lipogenic enzymes by dietary fat[J]. The Journal of Nutrition, 1990, 120(6): 625-630.
[22] CLARKE S D. Regulation of fatty acid synthase gene expression: an approach for reducing fat accumulation[J]. Journal of Animal Sci ence, 1993, 71(7): 1957-1965.
[23] 时皎皎, 糜漫天, 韦娜, 等. 不同脂肪酸构成比对大鼠血脂影响的研究[J]. 第三军医大学学报, 2007, 29(9): 824-827.
[24] BÄCKHED F, DING Hao, WANG Ting, et al. The gut microbiota as an environmental factor that regulates fat stora ge[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(44): 15718-15723.
[25] KERSTEN S, MANDARD S, TAN N S, et al. Characterization of the fasting-induced adipose factor FIAF, a novel peroxisome proliferatoractivated receptor target gene[J]. Journal of Biological Chemistry, 2000, 275(37): 28488-28493.
[26] KIM H K, YOUN B S, SHIN M S, et al. Hypothalamic Angptl4/Fiaf is a novel regulator of food intake and body weight[J]. Diabetes, 2010, 59(11): 2772-2780.
Effect of PUFA-Containing Diet on Gut Microbiota and Fat Metabolism-Related Genes in Rats
QIAO Li-jun, ZHENG Zheng, MA Wen-hui, LU Ting-xiu, GAI Xiao-ying, GE Yin-lin*
(Department of Biochemistry and Molecular Biology, College of Medical, Qingdao University, Qingdao 266021, China)
Purpose: To determine the effect of PUFA diet on gut microbiota and obesity-related cell factors in rats. Me thods: A total of 30 five-week-old healthy female rats were randomly divided into three groups: control group, n-6 PUFA-containing diet group and n-3 PUFA-containing diet group. The rats had free access to the feeds and water for eight weeks. Body weight was recorded once a week during the trail period and the levels of Bifi dobacterium (Bif), Lactobacillus (Lac), Akkermansia muciniphila (Akk) and obesity-related cell factors, fatty acid synthetase (FAS) and fasting-induced adipose factor (FIAF) were evaluated by qRT-PCR at the end of the trial. Results: The adiposity and FAS level in the n-3 PUFA-containing diet group were significantly lower than that in the control group (P < 0.05), and the levels of Bif, Lac, Akk and FIAF, and the thickness of the intestinal mucosa in the n-3 PUFA-containing diet model group were significantly higher than those in the control group (P < 0.05). Conclusion: An obvious change in gut microbiota was observed in rats fed n-3 PUFA-containing diet; meanwhile the occurrence and development of adiposity were inhibited.
n-3 PUFA; obesity; Akkermansia muciniphila; intestinal mucosa
R378
A
1002-6630(2014)17-0231-05
10.7506/spkx1002-6630-201417044
2013-10-12
山东省自然科学基金项目(ZR2010CM010)
乔立君 (1988—),女,硕士研究生,研究方向为基因治疗。E-mail:qlj19880728@163.com
*通信作者:葛银林(1957—),男,教授,博士,研究方向为基因诊断与治疗。E-mail:geyinlin@126.com
