基于响应曲面法的微囊化保加利亚乳杆菌高密度培养条件优化
2014-01-21闫颖娟周剑忠董明盛
闫颖娟,卢 俭,周剑忠,李 伟,董明盛,*
基于响应曲面法的微囊化保加利亚乳杆菌高密度培养条件优化
闫颖娟1,2,卢 俭1,3,周剑忠4,李 伟2,董明盛2,*
(1.忻州师范学院生物系,山西 忻州 034000;2.南京农业大学食品科技学院,江苏 南京 210095;3.南京卫岗乳业有限公司,江苏 南京 211100;4.江苏省农业科学院农产品加工研究所,江苏 南京 210014)
采用响应曲面法对微囊化保加利亚乳杆菌FMG-4高密度培养的培养基组成和培养条件进行优化,结果表明:最佳培养基配方为:在MRS培养基中添加乳清粉97.15 g/L、大豆蛋白粉10.00 g/L、酵母粉7.55 g/L、碳酸钙8.03 g/L、硫酸镁0.30 g/L、硫酸锰0.02 g/L。最优培养条件为:培养温度41.7 ℃、初始pH 6.9。此时保加利亚乳杆菌FMG-4细胞菌密度可达到3.18×1011CFU/g。
液芯微囊;响应曲面法;保加利亚乳杆菌;高密培养
酸奶发酵剂应具有较高的活力和稳定性。对筛选出来的乳酸菌进行高活性、高密度培养(high cell density culture,HCDC)是制备高效乳酸菌酸奶发酵剂的关键。目前我国大多数大型乳品加工企业采用国外进口的直投式酸奶发酵剂,其质量稳定、生产易行,菌体密度可达到1011CFU/g,但价格昂贵,生产成本大[1-3]。液芯微囊发酵剂是采用生物微囊化技术将发酵菌株包裹在球状微囊内,通过连续培养制备的微囊化发酵剂。从培养基中分离这种发酵剂无需经过超滤或冷冻离心,普通离心或微过滤即可进行,因此大大降低了生产成本,更重要的是可以减轻离心对菌体的伤害。另外,乳酸菌细胞包囊后还可以防止氧对菌体的损伤以及噬菌体感染,对乳酸菌细胞起到保护的作用[4-6]。
将微囊化的酸奶发酵剂进行高密度培养,是其能够应用于实际生产的关键。高密度培养是指在液体增菌培养液中,微生物细胞密度超过正常培养一个数量级以上,也被称为高密度发酵技术。HCDC技术广泛地应用于发酵工业中,通过这种培养方式可以降低设备投资,缩短生产周期,从而降低生产成本,提高商品化发酵剂的市场竞争力[7-9]。液芯微囊发酵剂的HCDC研究将为微囊化乳酸菌发酵剂的实际生产提供理论指导和技术支持。
1 材料与方法
1.1 菌种、培养基与试剂
保加利亚乳杆菌(Lactobacillus bulgaricus)FMG-4:本实验室保藏。
MRS培养基:磷酸二氢钾2.0 g、柠檬酸二铵2.0 g、无水乙酸钠5.0 g、硫酸锰0.25 g、蛋白胨10.0 g、酵母浸膏5.0 g、牛肉浸膏10.0 g、葡萄糖20.0 g、硫酸镁0.58 g、吐温-80 1.0 mL、蒸馏水1 000 mL,pH 6.8~7.0,121 ℃灭菌20 min。
海藻酸钠 ISP美国国际特品公司;脱脂奶粉、低蛋白乳清粉(乳糖含量80%,蛋白质含量3%) 新西兰纽迪希亚公司;大豆蛋白粉(蛋白质含量60%) 镇江市尚谷食品有限公司;黄原胶、壳聚糖、蔗糖(食品级) 上海万疆生物技术有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
自制液芯微囊化细胞无菌制备装置;HG303-4A型电热干燥培养箱 南京实验仪器厂;LRH-150型生化培养箱 上海益恒实验仪器有限公司;THZ-D台式恒温振荡器 太仓市实验设备厂;XW-80型旋涡混合器 上海医科大学仪器厂;S-3000N扫描电子显微镜 日本日立公司;DZKW-4电子恒温水浴锅 上海科析试验仪器厂。
1.3 方法
1.3.1 液芯微囊的制备
将甘油管保存的保加利亚乳杆菌FMG-4用MRS液体培养基活化2 次,发酵液离心收集菌体,加入少许生理盐水悬浮菌泥,再将其倒入质量浓度为15 g/L的氯化钙溶液和质量浓度为3 g/L的黄原胶溶液的混合液中制成菌悬液。采用自制液芯微囊无菌制备装置,将上述菌悬液逐滴滴入磁力搅拌的质量浓度为8.8 g/L的海藻酸钠溶液中反应一段时间,然后用适量的蒸馏水稀释海藻酸钠溶液。从稀释液中过滤出海藻酸钙液芯微囊,将获得的海藻酸钙液芯微囊洗涤后,转移到质量浓度为10 g/L的氯化钙溶液中进行20 min硬化处理,之后用蒸馏水洗掉其表面残留的氯化钙,然后将微囊放入预配好的质量浓度为3 g/L的壳聚糖溶液中浸泡。浸泡一定时间后滤出微囊,再次使用蒸馏水进行冲洗,最后将制得的海藻酸钙液芯微囊成品保存在配制好的生理盐水中。图1为液芯微囊的制备过程[10-12]。

图1 微囊制备流程Fig.1 Flow chart of liquid-core microcapsule preparation
1.3.2 微囊化酸奶发酵乳酸菌的高密度培养
将制备好的包裹有保加利亚乳杆菌的液芯微囊,按照5%的接种量加入到预配好的MRS液体增菌培养基中,在40 ℃恒温培养箱中静置培养48 h,之后将液体增菌培养基更换,采用同样的方法连续培养5个批次。培养结束后,将液芯微囊滤出,残留液芯微囊外的菌体采用无菌水进行洗涤,然后采取化学破囊法将液芯微囊破碎释放,最后通过平板计数法测试每克液芯微囊内的菌体数量。
1.3.3 响应曲面法优化培养条件
1.3.3.1 响应曲面法优化培养基配方
使用Design Expert软件,以MRS培养基为基础,采用部分重复因子设计方法[13-15]和最陡爬坡试验,研究乳清粉、大豆蛋白粉、酵母粉、碳酸钙、硫酸镁、硫酸锰等组分添加量对微囊化乳酸菌高密度培养的影响。从中筛选出显著影响组分因子,通过响应曲面设计建立细胞密度的模型方程。
1.3.3.2 响应曲面法优化培养条件
采用使用Design Expert软件,对培养条件(培养温度和初始pH值)进行优化,建立细胞密度的模型方程[16]。
1.3.4 高密度培养后微囊内外菌体扫描电镜观察
将高密度培养后微囊,置于2.5%的戊二醛溶液中固定12 h,用磷酸盐缓冲液冲洗3 次,每次10 min,再分别用50%、70%、90%的乙醇梯度脱水15 min,然后用100%乙醇脱水3 次,每次30 min。用叔丁醇置换3次,每次30 min。将样品放入临界点干燥仪中用液态二氧化碳进行临界点干燥,用双面胶带将样品黏到样品台上,用离子溅射仪给样品镀上10 nm金膜,最后用S-3000N型扫描电子显微镜观察并拍照。
2 结果与分析
2.1 微囊化保加利亚乳杆菌的培养基优化
2.1.1 部分重复因子设计法筛选关键因子
通过Design Expert软件,对乳清粉(X1)、大豆蛋白粉(X2)、酵母粉(X3)、碳酸钙(X4)、硫酸镁(X5)、硫酸锰(X6)等关键因子进行筛选,其试验设计及结果见表1。通过对试验数据进行逐步回归分析,得到保加利亚乳杆菌细胞密度(Y)的回归方程为:Y = 10.52+0.25X1-0.035X2+0.14 X3+0.15 X4-0.007 5 X5+0.010X6。
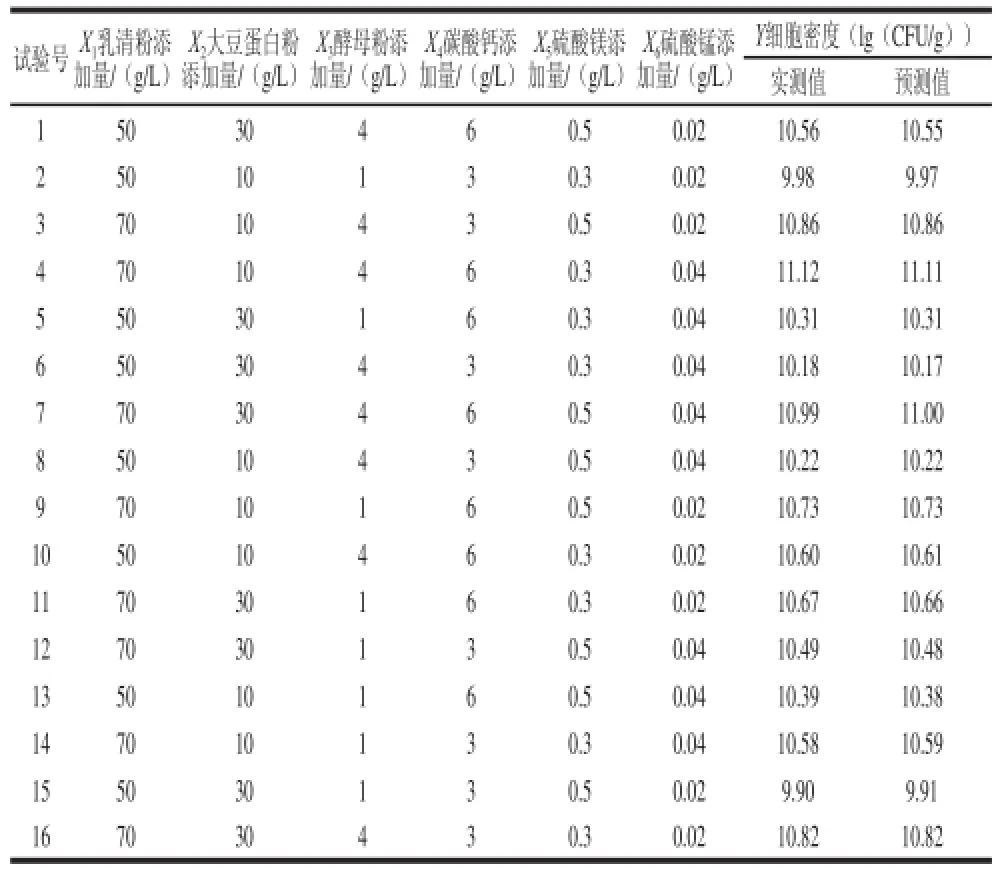
表1 部分重复因子设计方案及结果Table 1 Experimental design and results of fractional factorial design (FFD)

表2 保加利亚乳杆菌细胞密度回归方程方差分析Table 2 ANOVA for the regression equation of L. bulgaricus counts

表3 保加利亚乳杆菌细胞密度回归方程系数及其显著性检验Table 3 Regression coefficients and their significance for L. bulgaricus counts
对该回归方程进行方差分析(表2),该模型具有极显著性水平足够拟合试验数据。由回归方程系数及显著性检验(表3)可知,培养基中乳清粉、酵母粉和碳酸钙添加量是极显著影响因素(P<0.01),乳清粉、酵母粉、碳酸钙添加量对乳酸菌细胞密度具有显著正相关效应,大豆蛋白粉添加量与乳酸菌细胞密度呈负相关效应,而硫酸镁、硫酸锰添加量与乳酸菌细胞密度无相关性,期望值变化较小,因此从经济性角度考虑,取硫酸镁、硫酸锰的最小值,分别为0.3、0.02 g/L。
2.1.2 最陡爬坡试验
由于大豆蛋白粉、硫酸镁、硫酸锰添加量对乳酸菌细胞密度影响不显著,而乳清粉、酵母粉、碳酸钙添加量3 个因素与乳酸菌细胞密度呈显著正相关,因此保持前者3 组值不变,根据乳清粉、酵母粉、碳酸钙添加量3个因素回归方程系数的比例关系,设定步长进行试验,试验设计方案及结果见表4。试验组4对应的乳酸菌细胞密度最大,为1.38×1011CFU/g,因此将试验组4选作后续试验的中心点。

表4 最陡爬坡试验设计方案及结果Table 4 Steepest ascent experimental design and results
2.1.3 响应曲面法优化培养基配方
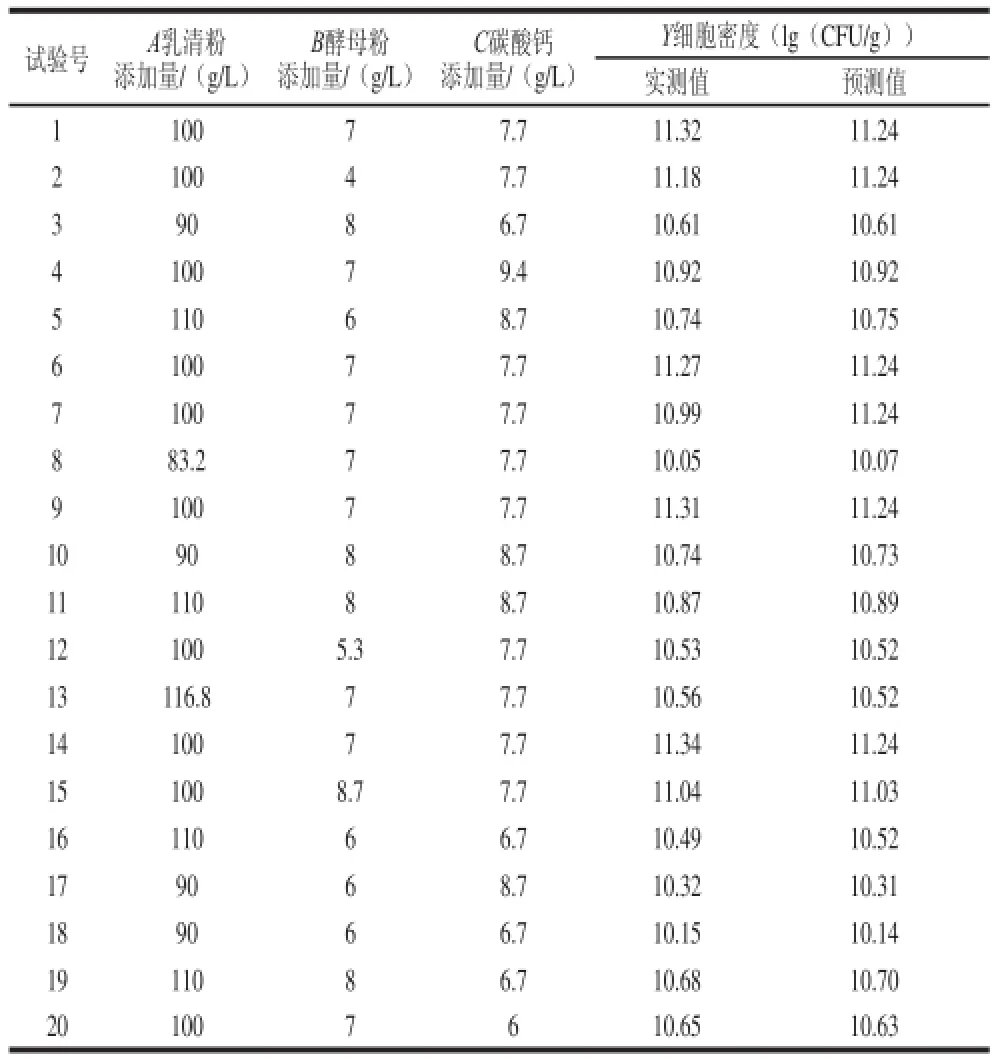
表5 培养基优化中心组合设计方案及结果Table 5 Central composite design with experimental and predicted results of L. bulgaricus counts for optimization of medium components
根据最陡爬坡试验结果,以试验组4为中心点进行中心组合试验,试验设计方案及结果见表5。以乳清粉(A)、酵母粉(B)、碳酸钙(C)添加量为自变量,以细胞密度(Y)为因变量对试验数据进行二次多项式回归拟合,得到二次多项式方程为:Y = 11.24+ 0.13A+0.15B+0.087C-0.33A2-0.16B2-0.16C2-0.070AB+0.018AC-0.012BC。对模型进行方差分析(表6)可知,模型具有极显著性(P<0.001),判定系数R2= 0.967 2,即该模型可以解释96.72%乳酸菌细胞密度的变化,失拟项不显著(P>0.05),表明该模型方程对数据拟合情况较好。由回归方程系数显著性检验(表7)可知,3 个主效应因素均为显著影响因素(P<0.05)。

表6 保加利亚乳杆菌细胞密度二次多项模型方差分析Table 6 ANOVA for the fitted quadratic polynomial model for L. bulgaricus counts
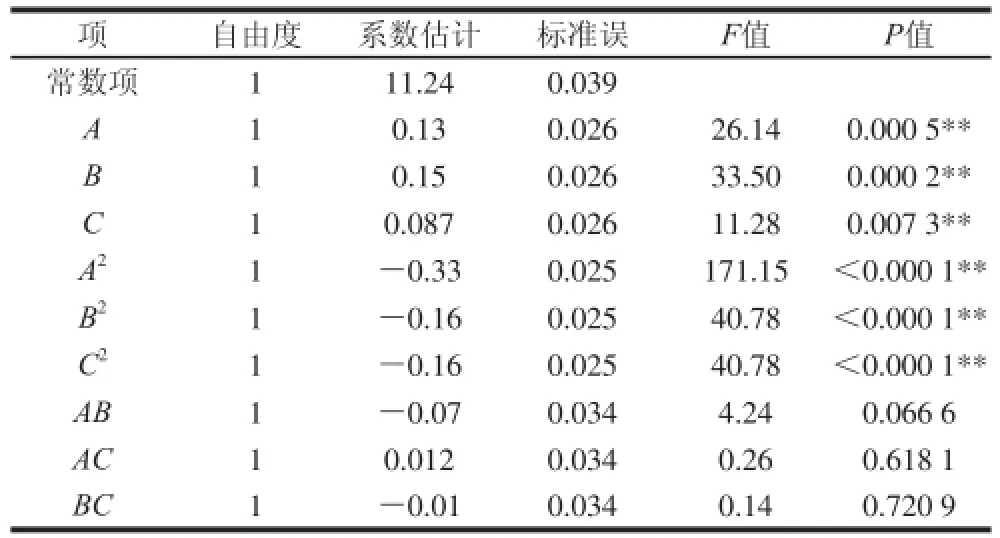
表7 保加利亚乳杆菌细胞密度模型方程系数显著性检验Table 7 Regression coefficients and their significance for L. bulgaricus counts
响应曲面和等高线图见图2~4,由图2可知,乳清粉和碳酸钙的交互作用对细胞密度的影响不显著,当乳清粉添加量小于95 g/L时,乳酸菌细胞密度随着其添加量的增加呈快速上升的趋势;当大于95 g/L时,细胞密度反而呈下降趋势。碳酸钙的变化对细胞密度的影响比乳清粉小,当碳酸钙添加量小于7.9 g/L时,随着碳酸钙添加量的增加,细胞密度略有增加,而当碳酸钙添加量大于7.9 g/L时,细胞密度随其添加量的增加而减少,这可能是因为培养基中添加适量碳酸钙可以起到增加液芯微囊的机械强度、缓冲环境pH值的作用,为酸奶发酵乳酸菌提供良好的生长环境,但过量时反而不利于乳酸菌细胞的生长[17-19]。图3与图4变化趋势相同,酵母粉和乳清粉、碳酸钙添加量的交互作用对细胞密度的影响均显著,当酵母粉添加量小于7.2 g/L时,随着酵母粉添加量的增加,细胞密度呈增加趋势且增幅较大,而当酵母粉添加量大于7.2 g/L时,变化趋于平缓。

图2 乳清粉和碳酸钙添加量及其交互作用对保加利亚乳杆菌细胞密度影响的响应面和等高线图Fig.2 Response surface and contour plots for the interactive effect of whey power and CaCO3concentration on L. bulgaricus counts

图3 乳清粉和酵母粉添加量及其交互作用对保加利亚乳杆菌细胞密度影响的响应面和等高线图Fig.3 Response surface and contour plots for the interactive effect of whey power and yeast powder concentration on L. bulgaricus counts

图4 酵母粉和碳酸钙添加量及其交互作用对保加利亚乳杆菌细胞密度影响的响应面和等高线图Fig.4 Response surface and contour plots for the interactive effect of yeast powder and CaCO3concentration on L. bulgaricus counts
将乳清粉、酵母粉、碳酸钙的添加量取值范围分别设定在90~110、6~8、6.7~8.7 g/L,并将细胞密度设定为目标最大值,根据软件给出的10 组最优组合(表8),从经济角度考虑,选取第4组的组合,即培养基配方为:乳清粉97.15 g/L、大豆蛋白粉10 g/L、酵母粉7.55 g/L、碳酸钙8.03 g/L、硫酸镁0.3 g/L、硫酸锰0.02 g/L。

表8 培养基优化的10 组最优组合Table 8 Optimal medium formulations
2.2 响应曲面法优化培养条件
表9是利用中心组合试验对温度和初始pH值进行优化的设计方案及结果。对试验数据进行二次多项回归拟合,得到乳酸菌细胞密度预测值(Y)对自变量培养温度(A)和初始pH值(B)的多元回归方程为Y = 10.98-0.20A-0.01B-0.35 A2-0.46B2+0.035AB。

表9 培养条件的中心组合设计及试验结果Table 9 Central composite design with experimental and predicted results of L. bulgaricus counts for optimization of culture conditions
对该模型方程进行方差分析(表10),结果表明该模型极显著(P<0.01),R2= 0.993 7,表明该模型能解释99.37%细胞密度的变化,失拟项不显著(P>0.05),说明细胞密度的实测值和预测值之间拟合度较好,因此该方程作为酸奶发酵乳酸菌的细胞密度模型是合适的。

表10 细胞密度二次多项模型方差分析Table 10 ANOVA for the fitted quadratic polynomial model for L. bulgaricus counts
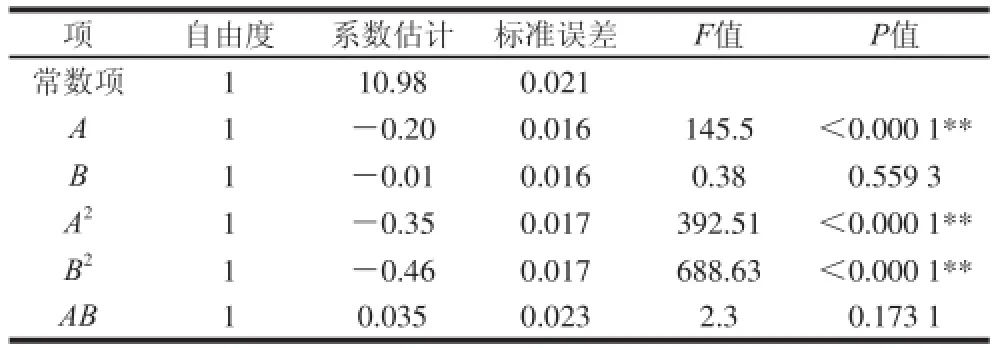
表11 细胞密度模型方程系数显著性检验Table 11 Regression coefficients and their significance for L. bulgaricus counts
由方程系数及其显著性检验结果可知(表11),初始pH值对细胞密度影响不显著,而温度对其影响显著。由响应曲面及等高线(图5)可知,当培养温度在40~42 ℃时,细胞密度随着培养温度的升高而增加,当温度大于42 ℃时细胞密度出现负增长;从等高线图可以看出,培养温度和初始pH值的交互作用不显著。

图5 培养温度和初始pH值及其交互作用影响保加利亚乳杆菌细胞密度的响应曲面图及等高线图Fig.5 Response surface and contour plots for the interactive effect of culture temperature and pH on L. bulgaricus counts
将培养温度和初始pH值分别设定在40~44 ℃和6.6~7.2,用乳酸菌细胞密度作为靶向最大值,通过实验软件进行优化处理,得到的10 组最优组合培养条件见表12,根据实验结果,微囊化保加利亚乳杆菌最优的培养条件选择第6组,即培养温度为41.7 ℃,初始pH值为6.9。

表12 培养条件的10 组最优组合Table 12 Optimal combinations of culture conditions
2.3 微囊化酸奶发酵乳酸菌高密度培养
用优化的培养基在41.7 ℃、初始pH 6.9条件下对游离乳酸菌和微囊化乳酸菌分别进行连续5 批增殖培养,结果见图6。微囊内乳酸菌细胞密度在第1批和第2批的增殖培养过程中极显著增加(P<0.01),第3批发酵结束时达到3.18×1011CFU/g,之后液芯微囊内细胞密度变化不显著(P>0.05),而游离条件下乳酸菌细胞密度在所有培养批次中变化均不显著(P>0.05)。

图6 微囊化酸奶发酵乳酸菌连续培养过程中囊内细胞密度的变化Fig.6 Change in L. bulgaricus counts in liquid-core capsules during continuous culture
2.4 高密度培养后微囊内外菌体扫描电镜

图7 液芯微囊内(A)和外(B)菌体扫描电镜图(×1 000)Fig.7 SEM images (× 1 000) of high-density cultured cells inside (A) and outside (B) liquid-core microcapsules
由图7可知,囊内保加利亚乳杆菌菌体粗壮,形态良好,菌体分布均匀,密度较高,而囊外表面菌体密度较少,说明液芯微包囊可以对菌体起到较好的保护作用。
3 结 论
随着商品发酵剂应用的迅速增加,发酵剂的经济性成为一个重要研究指标,为了实现这个目标,在实践中需要针对每个特定过程建立相应的高效发酵模式。因此,大规模培养技术和工艺在工业化实践中就显得日趋重要。高密度培养技术不仅是生产高质量浓缩型菌体和代谢产物的重要环节,也是能否以低成本实现规模生产的关键性因素[20-21]。
微生物培养基及培养条件在HCDC培养过程中占有极其重要的地位。本实验采用响应曲面设计优化了用于微囊化保加利亚乳杆菌高密度培养的培养基配方:以MRS为基础培养基,添加乳清粉97.15 g/L、大豆蛋白粉10.00 g/L、酵母粉7.55 g/L、碳酸钙8.03 g/L、硫酸镁0.30 g/L、硫酸锰0.02 g/L。高密度培养微囊化保加利亚乳杆菌的最优条件为:培养温度41.7 ℃、初始pH 6.9。此时保加利亚乳杆菌FMG-4细胞菌密度可达到3.18×1011CFU/g。
[1] BURGAIN J, GAIANI C, LINDER M, et al. Encapsulation of probiotic living cells: from laboratory scale to industrial applications[J]. Journal of Food Engineering, 2011, 104(4): 467-483.
[2] VO T N, KASPER F K, MIKOS A G. Strategies for controlled delivery of growth factors and cells for bone regeneration[J]. Advanced Drug Delivery Reviews, 2012, 64(12): 1292-1309.
[3] NAZZARO F, ORLANDO P, FRATIANNI F, et al. Microencapsulation in food science and biotechnology[J]. Current Opinion in Biotechnology, 2012, 23(2): 182-186.
[4] 包永华, 董明盛. 液芯海藻酸钙包囊固定化技术[J]. 中国酿造, 2008, 27(21): 14-17.
[5] LIU Shanna, HAN Ye, ZHOU Zhijiang. Lactic acid bacteria in traditional fermented Chinese foods[J]. Food Research International, 2011, 44(3): 643-651.
[6] DESAI K G H, PARK H J. Recent development in microencapsulation of foods ingredients[J]. Drying Technology, 2005, 23(7): 1361-1394.
[7] HANSEN E B. Commercial bacterial starter cultures for fermented foods of the future[J]. International Journal of Food Microbiology, 2002, 78(1/2): 119-131.
[8] RIESENBERG D, GUTHKE R. High-cell-density cultivation of microorganisms[J]. Applied Microbiology and Biotechnology, 1999, 51: 422-430.
[9] 刘子宇, 李平兰, 郑海涛, 等. 微生物高密度培养的研究进展[J]. 中国乳业, 2005(12): 47-51.
[10] 周剑忠, 卢俭, 李莹, 等. 液芯微胶囊制备条件优化[J]. 江西农业学报, 2009, 21(8): 138-141.
[11] 张志辰, 王英, 董明盛, 等. 壳聚糖-海藻酸钠液芯微胶囊机械强度优化研究[J]. 江苏农业科学, 2010(1): 268-269.
[12] 陈国, 姚善泾. CMC-NaCS/PDM DACC微胶囊的制备及传质性能研究[J]. 化学反应工程与工艺, 2005, 21(2): 166-170.
[13] LI Chan, BAI Jinghua, CAI Zhaoling, et al. Optimization of a cultural medium for bacteriocin production by Lactococcus lactics using response surface methodology[J]. Journal of Biotechnology, 2002, 93(1): 27-34.
[14] de VOS P, BUCKO M, GEMEINER P, et al. Multiscale requirements for bioencapsulation in medicine and biotechnology[J]. Biomaterials, 2009, 30(13): 2559-2570.
[15] BOTTEHER H, SOLTMANN U, MERTIG M, et al. Biocers: ceramics with incorporated microorganisms for biocatalytic, biosorptive and functional materials development[J]. Journal of Materials Chemistry, 2004, 14: 2176-2188.
[16] 李冀新, 张超, 高虹. 固定化细胞技术应用研究进展[J]. 化学与生物工程, 2006, 23(6): 5-7.
[17] 刘袖洞, 何洋, 刘群, 等. 微胶囊及其在生物医学领域的应用[J]. 科学通报, 2000, 45(23): 2746-2783.
[18] 王勇, 解玉冰, 马小军. 壳聚糖/海藻酸钠生物微胶囊的研究进展[J].生物工程进展, 1999, 19(2): 33-37.
[19] SUN Zhijie, LÜ Guojun, LI Shuangyue. Different role of microenvironment in microencapsulation for improved cell tolerance to stress[J]. Applied Microbiology and Biotechnology, 2007, 75: 1419-1427.
[20] 刘袖洞, 于炜婷, 王为, 等. 海藻酸钠和壳聚糖聚电解质微胶囊及其生物医学应用[J]. 化学进展, 2008, 20(1): 71-77.
[21] 薛伟明, 于炜婷, 刘袖洞, 等. 载细胞海藻酸钠/壳聚糖微胶囊的化学破囊方法研究[J]. 高等学校化学学报, 2004, 25(7): 1342-1346.
Optimization of High Cell Density Culture Conditions for Microencapsulated Lactobacillus bulgaricus by Response Surface Methodology
YAN Ying-juan1,2, LU Jian1,3, ZHOU Jian-zhong4, LI Wei2, DONG Ming-sheng2,*
(1. Department of Biology, Xinzhou Teachers University, Xinzhou 034000, China; 2. College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China; 3. Nanjing Weigang Dairy Co. Ltd., Nanjing 211100, China; 4. Institute Agro-product Processing, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China)
In this study, the medium composition and culture conditions for microencapsulated Lactobacillus bulgaricus FMG-4 were optimized using response surface methodology. The results showed that the optimal medium for high cell density culture of microencapsulated Lactobacillus bulgaricus FMG-4 was an MRS medium supplemented with 97.15 g/L whey powder, 10.00 g/L soy protein powder, 7.55 g/L yeast powder, 8.03 g/L calcium carbonate, 0.30 g/L magnesium sulfate and 0.02 g/L manganese sulfate. The optimal culture conditions were 41.7 ℃ and an initial pH of 6.9. Under the optimized culture conditions, the density of L. bulgaricus FMG-4 reached 3.18×1011CFU/g.
liquid core microcapsule; response surface methodology; Lactobacillus bulgaricus; high cell density culture
TS201.3
A
1002-6630(2014)17-0153-07
10.7506/spkx1002-6630-201417030
2014-01-08
“十二五”国家科技支撑计划项目(2013BAD18B01-4);国家高技术研究发展计划(863计划)项目(2011AA100903);中央高校基本科研业务费专项资金项目(KYZ201419);国家农业科技成果转化资金项目(2012GB23600639);江苏高校优势学科建设工程资助项目
闫颖娟(1985—),女,硕士研究生,研究方向为食品生物技术。E-mail:sxxzyyj@163.com
*通信作者:董明盛(1961—),男,教授,博士,研究方向为食品微生物与生物技术。E-mail:dongms@njau.edu.cn
