抗氧化肽HDHPVC和HEKVC的反应动力学及抗氧化能力评价方法
2014-01-21蒋海萍廖丹葵孙建华童张法
蒋海萍,廖丹葵,孙建华,童张法
抗氧化肽HDHPVC和HEKVC的反应动力学及抗氧化能力评价方法
蒋海萍,廖丹葵*,孙建华,童张法
(广西大学化学化工学院,广西 南宁 530004)
研究抗氧化肽His-Asp-His-Pro-Val-Cys(HDHPVC)、His-Glu-Lys-Val-Cys(HEKVC)和谷胱甘肽(glutathione,GSH)清除1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基的反应动力学特性。3 种抗氧化肽的二级反应动力学常数k2、抗氧化还原能力(antiradical power,ARP)及化学计量数等结果表明,其清除DPPH自由基能力的排列顺序为HEKVC<HDHPVC<GSH。通过比较3 种抗氧化肽在稳定状态及固定30 min反应时间条件下清除DPPH自由基能力检测方法的差异,发现3 种抗氧化肽均属于慢反应动力学行为,固定30 min反应时间所测得的半数有效浓度(median effective concentration,EC50)比稳态条件下测得值偏大3~5 倍。该研究表明HDHPVC和HEKVC是一种优良的天然抗氧化肽。
His-Asp-His-Pro-Val-Cys;His-Glu-Lys-Val-Cys;DPPH自由基;抗氧化;动力学
抗氧化肽是介于蛋白质和氨基酸之间的肽类,可从动植物等蛋白中提取,具有有效的抑制或减缓自由基及其所产生的氧化连锁反应的活性功能。一般用于评价体外抗氧化能力的方法主要分为抑制脂质过氧化法(硫氰酸铁法、过氧化值法和共轭二烯法等)、清除自由基法(2,2’-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2’-azinobis(3-ethylbenzothi azoline-6-sulfonic acid)ammonium salt,ABTS)法、氧化自由基吸收能力(oxygen radical absorption capacity,ORAC)法、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)法、O2-·法和·OH法等)及金属离子螯合能力法3 类[1]。其中,DPPH分子结构中含有未成对电子,可以接受由抗氧化物质提供的H原子,其分子结构变为DPPH-H而导致反应体系颜色变浅或变为黄色,吸收值随之减弱或消失,可以定量反映出物质清除DPPH自由基能力[2-3]。因此,DPPH法常被用于检测固定反应时间条件下的DPPH自由基剩余百分比含量,间接反映物质的抗氧化能力[4-5]。
由于抗氧化物质与DPPH自由基反应中可能存在各种不同的反应动力学行为,抑或由于反应的可逆性[6],生成物DPPH-H发生逆反应转化成DPPH自由基而导致不完全反应。Bondet等[6]研究表明丁香酚清除DPPH自由基反应的动力学及其可逆性;Goupy[7]、Cevallos-Casals[8]、Friaa[9]等分别研究了酚类抗氧化剂及VE与DPPH自由基之间的不同反应动力学行为;王俊等[10]研究发现聚烯烃抗氧化剂对DPPH自由基具有良好的清除作用,属于一级反应;赵慧芳等[11]比较了VC、2,6-二叔丁基-4-甲基苯酚、色素和黑莓果实水提物分别与DPPH自由基之间的反应动力学,发现不同抗氧化物与DPPH自由基的反应历程差异较大。因此,有关DPPH自由基与各抗氧化物质间的氢原子转移反应动力学的研究越来越受关注。
然而,DPPH自由基和抗氧化物的反应动力学与DPPH自由基浓度之间存在非线性关系,这将大大影响到由传统方法检测的半数有效浓度(EC50)值的精确度[12]。且此法对光、氧气及杂质均敏感[13];并依赖于所采用的溶剂体系[14]。因此,通过采用两种不同检测方法比较研究抗氧化肽与DPPH自由基反应,对正确的利用DPPH法评价抗氧化物的自由基清除能力具有重要意义。
本实验运用DPPH法研究从蓝圆鲹鱼肉蛋白水解物中获得的新型抗氧化肽His-Asp-His-Pro-Val-Cys(HDHPVC)、His-Glu-Lys-Val-Cys(HEKVC)的反应动力学过程,并与固定反应时间的传统检测方法进行比较研究。
1 材料与方法
1.1 材料与试剂
蓝圆鲹鱼肉蛋白经碱性蛋白酶水解,酶解产物(抗氧化肽His-Asp-His-Pro-Val-Cys (HDHPVC)和His-Glu-Lys-Val-Cys (HEKVC))经分离纯化鉴定获得氨基酸序列结构[15],由上海吉尔生化有限公司合成(经高效液相色谱法鉴定其纯度98%以上)。
1,1-二苯基-2-三硝基苯肼(DPPH) 美国Sigma-Aldrich公司;还原型谷胱甘肽(L-glutathione reduced,GSH) 北京拜尔迪生物技术有限公司;甲醇(色谱纯) 美国Fisher公司。
1.2 仪器与设备
BS-110S型电子分析天平 北京赛多利斯天平有限公司;HH-S型恒温水浴锅 江苏省金坛市医疗仪器厂;UV-2550型紫外分光光度计 日本Shimadzu公司。
1.3 方法
1.3.1 DPPH自由基反应性质研究及标准曲线的绘制
取浓度为0.05 mmol/L的DPPH 50%甲醇溶液及GSH-DPPH 50%甲醇反应液分别于300~800 nm波长范围内扫描吸收峰。
精确称取DPPH标准品4.9 mg,用50%甲醇溶液配制浓度为0.5 mmol/L的DPPH标准品母液,分别稀释至0.0125~0.1 mmol/L不同浓度范围,于515 nm波长处测定吸光度。
1.3.2 固定30 min反应时间测定抗氧化肽对DPPH自由基的清除能力
将0.5 mL待测样品置于试管中,加入0.5 mL DPPH溶液(0.1 mmol/L,溶于甲醇),振荡混匀,室温下放置30 min后,于515 nm波长处测其吸光度(As),对照为DPPH甲醇溶液在测定波长处的吸光度(A0),待测样品与甲醇的混合液在测定波长处的吸光度(A1)。自由基清除率按照公式(1)[16]计算。
1.3.3 抗氧化肽清除DPPH自由基的反应动力学
将0.5 mL不同浓度的抗氧化肽样品置于试管中,加入0.5 mL DPPH溶液(0.1 mmol/L,溶于甲醇)启动反应并计时,于515 nm波长处测其吸光度随时间的连续变化趋势。
DPPH甲醇体系中,抗氧化物质[AH]与[DPPH·]之间的氢原子转移反应如方程(2)所示,其中反应活性较差的[A·]则可能同时与[DPPH·]和[A·]发生副反应如方程(3)和(4)所示[17-18]。

方程(2)的反应级数取决于反应物的浓度。本实验中总反应溶液的[DPPH·]浓度固定为0.05 mmol/L。假定在反应初始阶段(1~2 min),不发生可逆反应与副反应,当c[DPPH·]<<c[AH],该反应方程式可以看作为拟一级反应,由式(5)可计算出拟一级反应速率常数值kobsd。

式中:[DPPH·]0表示DPPH自由基在t=0时的浓度/(mmol/L);kobsd表示拟一级反应速率常数/s-1,可以由式(5)计算得到;[DPPH·]t表示DPPH自由基在t min时的浓度/(mmol/L)。
同时,由方程式(2)可以得到:

由式(6)可知一级反应速率常数与抗氧化物的浓度成线性关系,由此可求得二级反应速率常数k2。
活性保持率指在某一反应时刻,未参与反应的DPPH自由基浓度占初始总浓度的百分比[19]。
1.3.4 抗氧化能力参数计算
半数有效浓度(median effective concentration,EC50)是指清除反应达到平衡状态时,清除50%的DPPH自由基所需要的抗氧化物的浓度。为了更清楚的表达,通常采用抗氧化还原能力(antiradical power,ARP)来表示抗氧化能力,可由式(7)计算。ARP值越大,则物质的抗氧化能力越强。

化学计量数是评价物质抗氧化能力的重要参数之一,数值上表示清除100%的DPPH自由基所消耗的抗氧化物质的有效浓度。
2 结果与分析
2.1 DPPH自由基反应性质
采用紫外分光光度计扫描D P P H甲醇溶液及GSH-DPPH甲醇溶液在300~800 nm之间的吸光度曲线,如图1所示。

图1 DPPH及添加了GSH的DPPH溶液的吸收波长扫描图Fig.1 Absorption spectra of DPPH and GSH-DPPH in methanol/water
由图1可知,DPPH甲醇溶液和GSH-DPPH甲醇溶液在515 nm波长附近都有强吸收峰,而GSH-DPPH甲醇溶液中由于加入了抗氧化剂GSH,与DPPH自由基反应并消耗掉部分DPPH自由基,导致溶液紫色变浅或变为黄色,其在515 nm波长附近的吸收峰强度相应地减弱或消失。
DPPH自由基浓度与吸光度之间标准曲线方程如式(8)所示,其中R2=0.999 4,说明二者之间线性关系良好。

式中:c为DPPH自由基浓度/(mmol/L)。
2.2 抗氧化肽与DPPH自由基的反应进程
以GSH作为对照物,不同浓度的抗氧化肽(GSH:0.05、0.1、0.2、0.3、0.4 mmol/L;HEKVC:0.1、0.2、0.4、0.6 mmol/L;HDHPVC:0.05、0.1、0.15、0.2 mmol/L)与DPPH自由基(0.05 mmol/L)反应的进程曲线如图2所示。


图2 不同浓度抗氧化肽GSH、HEKVC和HDHPVC与DPPH自由基的反应动力学曲线Fig.2 Kinetic behavior of GSH, HEKVC and HDHPVC for the scavenging of DPPH radical
由图2可知,未参加反应的DPPH自由基浓度随着反应的不断进行而逐渐减少。在反应开始的前10 min,剩余DPPH自由基浓度显著下降,随后呈现缓慢降低趋势,直至反应完全并达到平衡状态。同时,随着抗氧化肽浓度的增大,反应达到平衡状态所需要的时间越来越短。即添加的抗氧化肽越多,其与DPPH自由基反应的速度就越快。其中,当抗氧化物的添加浓度较低时(谷胱甘肽与DPPH自由基的浓度比为1~2,HEKVC与DPPH自由基的浓度比为2~4,HDHPVC与DPPH自由基的浓度比为1),即使反应时间延长至120 min,反应也未达到平衡。但是若适当增大抗氧化肽的浓度,其反应平衡时间可缩至30~60 min之间。根据各抗氧化物达到平衡状态所需要的时间,可将其按反应动力学性质分为慢(>1 h)、中(30 min~1 h)、快(<30 min)3 种[20]。由于上述3 种抗氧化物在不同浓度条件下达到反应平衡所需要的时间均处于30 min~2 h范围或>2 h,因此它们均归属于慢反应动力学行为。
2.3 二级反应速率常数
二级反应速率常数k2通常被认为与抗氧化物质的自由基清除能力有关,是抗氧化物质清除DPPH自由基能力的另一种体现形式[21]。k2越大,即物质的反应速率越快,其清除自由基能力越强。各抗氧化肽的拟一阶反应速率常数kobsd与抗氧化物浓度的定量关系如图3所示,由式(6)可得到3 种物质的k2值。
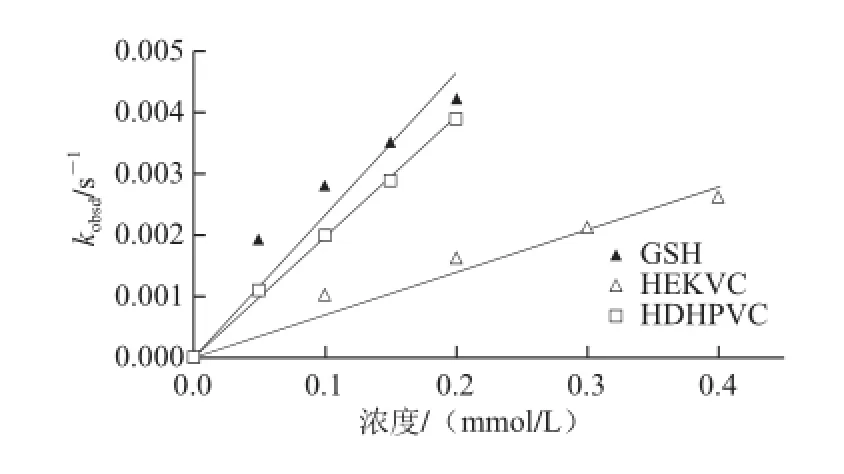
图3 拟一阶反应速率常数kobsd与抗氧化物浓度的关系Fig.3 Plot of pseudo first order rate constant (kobsd) versus antioxidant concentration

表1 抗氧化肽与DPPH自由基反应的二阶速率常数Table 1 Second-order rate constants for the reaction between DPPH radical and antioxidative peptides
由表1可知,R2值可以看出3 种抗氧化肽的拟一阶速率常数与浓度之间的线性关系均良好。同时,对照物GSH的二级速率常数最大,HDHPVC次之,HEKVC的速率常数最小。即各抗氧化物清除DPPH自由基能力大小顺序为GSH>HDHPVC>HEKVC。
2.4 EC50、ARP和化学计量数

图4 抗氧化物GSH、HDHPVC、HEKVC在稳定状态下的EC50Fig.4 EC50of GSH, HDHPVC and HEKVC for scavenging DPPH free radicals at the steady state
由图4可知,抗氧化物GSH、HDHPVC、HEKVC在稳定状态下的EC50值分别为0.12、0.18、0.29 mmol/L,其大小顺序为HEKVC>HDHPVC>GSH。同时,ARP值为GSH>HDHPVC>HEKVC,EC50值越低,则ARP值越大,也就是说物质的抗氧化能力越强。因此,对照物GSH的抗氧化能力最强,HEKVC最弱。

表2 抗氧化动力学参数Table 2 Kinetic parameters of GSH, HDHPVC and HEKVC
由表2可知,对照物GSH的化学计量数最低,即理论上只需要0.24 mmol/L的GSH就可以清除100%的DPPH自由基。HDHPVC的化学计量数略高于GSH,为0.36 mmol/L;HEKVC的最大,为0.58 mmol/L。同时,抗氧化肽HDHPVC和HEKVC还原DPPH自由基能力均弱于GSH,同等条件下分别还原了2.78和1.72 分子的DPPH自由基,低于对照物GSH (4.17分子的DPPH自由基),说明其抗氧化能力大小顺序为HEKVC<HDHPVC<GSH,与前述测得的ARP结果相吻合。
2.5 稳态与固定反应时间(30 min)条件下的EC50值比较本实验对HDHPVC和HEKVC两种抗氧化肽在稳定状态及固定30 min反应时间条件下求得的EC50值进行比较,如表3所示。

表3 稳态与固定30 min反应时间下EC50值的比较Table 3 EC50at the steady state at 30 min of reaction time
由表3可知,当固定反应时间30 min时测得HDHPVC的EC50值为31.0 μmol/L,是稳态下的5 倍;同理HEKVC在固定30 min条件下的EC50值是稳态下的4.7 倍;对照物GSH在固定30 min条件下的EC50值也比稳态的大,约3.4 倍。各抗氧化肽于固定30 min反应时间下测得的EC50值均比稳态条件下的大3~5 倍,这可能是由于3 种抗氧化肽均属于慢反应动力学类型,不同浓度的抗氧化物与DPPH自由基反应达到平衡所需要的时间在10 min至16 h不等。在固定30 min反应时间的条件下,HDHPVC、HEKVC及GSH与DPPH自由基反应远未达到稳定状态,因此运用固定30 min反应时间的方法所测得的EC50值比稳态条件下测得的EC50值偏大数倍,但3 种抗氧化肽之间抗氧化能力大小比较趋势一致。
3 结 论
抗氧化肽HDHPVC与DPPH自由基反应的二级反应速率常数k2为2.0×10-5L/(μmol·s),稍逊于对照物GSH(k2为2.3×10-5L/(μmol·s)),约是HEKVC(k2为0.7×10-5L/(μmol·s))的3倍。其次,3 种抗氧化肽均属于慢反应动力学性质,其在固定30 min反应时间的方法所测得的EC50值(HDHPVC和HEKVC分别为31.0 μmol/L和67.7 μmol/L)比稳态条件下测得的EC50值(HDHPVC和HEKVC分别为9 μmol/L和14.5 μmol/L)偏大3~5 倍。因此,可以考虑运用两种方法测得值之间的相差倍数作为校正系数,在固定反应时间(30 min)实验结果的基础上,校正得到其稳态下的EC50值,以便能更准确地反映物质的抗氧化能力。该研究结果表明抗氧化肽HDHPVC和HEKVC具有一定的体外抗氧化能力,是一种优良的天然抗氧化肽。同时,对其进行的相关动力学性质研究反映了不同物质清除DPPH自由基反应之间的差异,对准确评价物质的抗氧化能力具有一定的指导意义。
[1] 李华, 李佩洪, 王晓宇, 等. 抗氧化检测方法的相关性研究[J]. 食品与生物技术学报, 2008, 27(4): 6-11.
[2] MISHRA K, OJHA H, CHAUDHURY N K. Estimation of antiradical properties of antioxidants using DPPH· assay: a critical review and results[J]. Food Chemistry, 2012, 130(4): 1036-1043.
[3] SUJA K P, JAYALEKSHMY A, ARUMUGHAN C. Free radical scavenging behavior of antioxidant compounds of sesame (Sesamum indicum L.) in DPPH· system[J]. Journal of Agricultural and Food Chemistry, 2004, 52(4): 912-915.
[4] 彭长连, 陈少薇, 林植芳, 等. 用清除有机自由基 DPPH 法评价植物抗氧化能力[J]. 生物化学和生物物理进展, 2000, 27(6): 658-661.
[5] LARRAURI J A, CHANCHEZ-MORENO C, SAURA-CALIXTO F. Effect of temperature on the free radical scavenging capacity of extracts from red and white grape pomace peels[J]. Journal of Agricultural and Food Chemistry, 1998, 46(7): 2694-2697.
[6] BONDET V, BRAND-WILLIAMS W, BERSET C. Kinetics and mechanisms of antioxidant activity using the DPPH radical method[J]. Lebensmittel - Wissenschaft + Technologie, 1997, 30(6): 609-615.
[7] GOUPY P, DUFOUR C, LOONIS M, et al. Quantitative kinetic analysis of hydrogen transfer reactions from dietery polyphenols to the DPPH radical[J]. Journal of Agricultural and Food Chemistry, 2003, 51(3): 615-622.
[8] CEVALLO-CASALS B A, CISNEROS-ZEVALLOS L. Stoichimetric and kinetic studies of phenolic antioxidants from andean corn and redfleshed sweetpotato[J]. Journal of Agricultural and Food Chemistry, 2003, 51(11): 3313-3319.
[9] FRIAA O, BRAULT D. Kinetics of the reaction between the antioxidant trolox and the free radical DPPH· in semi-aqueous solution[J]. Organic & Biomolecular Chemistry, 2006, 4(12): 2417-2423.
[10] 王俊, 史春霞, 李翠勤, 等. DPPH法研究聚烯烃抗氧化剂的抗氧化反应动力学[J]. 石油学报: 石油加工, 2012, 28(6): 973-977.
[11] 赵慧芳, 方亮, 吴文龙, 等. 黑莓品种Boysen果实水提物和色素对DPPH反应动力学特性及清除能力研究[J]. 植物资源与环境学报, 2011, 20(1): 10-16.
[12] AYSE K, BERAAT O, SAMIM S. Review of methods to determine antioxidant capacities[J]. Food Analytical Methods, 2009, 2(1): 41-60.
[13] OZCELIK B, LEE J H, MIN D B. Effects of light, oxygen, and pH on the absorbance of 2,2-diphenyl-1-picrylhydrazyl[J]. Journal of Food Science, 2003, 68(2): 487-490.
[14] HUANG Dejian, OU Boxin, PRIOR R L. The chemistry behind antioxidant capacity assays[J]. Journal of Agricultural and Food Chemistry, 2005, 53(6): 1841-1856.
[15] JIANG Haiping, TONG Tianzhe, LIAO Dankui, et al. Purification and characterization of antioxidative peptides from round scad (Decapterus maruadsi) muscle protein hydrolysate[J]. Food Chemistry, 2014, 154: 158-163.
[16] ALMA M H, MAVI A, YILDIRIM A, et al. Screening chemical composition and in vitro antioxidant and antimicrobial activities of the essential oils from Origanum syriacum L. growing in Turkey[J]. Biological Pharmaceutical Bulletin, 2003, 26(12): 1725-1729.
[17] BRAND-WILLIAMS W, CUVELIER M E, BERSET C. Use of free radical method to evaluate antioxidant activity[J]. Lebensmittel-Wissenschaft + Technologie, 1995, 28(1): 25-30.
[18] SHEN Liang, ZHANG Hongyu, JI Hongfang. A thermodynamic inverstigation of DPPH radical-scavenging mechanisms of folates[J]. Journal of Molecular Structure: THEOCHEM, 2008, 856: 119-123.
[19] CHENG Zhihong, MOORE J, YU Liangli. High-throughput relative DPPH radical scavenging capacity assay[J]. Journal of Agricultural and Food Chemistry, 2006, 54(20): 7429-7436.
[20] 李铉军, 崔胜云. 抗坏血酸清除DPPH自由基的作用机理[J]. 食品科学, 2011, 32(1): 86-87.
[21] 郑大贵, 叶青, 叶红德. DPPH法评价 VC、异VC及其衍生物的抗氧化性能力[J]. 食品工业科技, 2008, 29(4): 113-116.
Kinetic Studies of DPPH Radical Scavenging Activity of Antioxidative Peptides HDHPVC and HEKVC
JIANG Hai-ping, LIAO Dan-kui*, SUN Jian-hua, TONG Zhang-fa
(School of Chemistry and Chemical Engineering, Guangxi University, Nanning 530004, China)
The kinetic behavior of two antioxidative peptides, His-Asp-His-Pro-Val-Cys (HDHPVC) and His-Glu-Lys-Val-Cys (HEKVC), as well as glutathione (GSH) for their DPPH radical scavenging activity was investigated. Three kinetic parameters of the two antioxidative peptides, including second-order rate constant (k2), antiradical power (ARP) and stoichiometry were calculated and compared with those of GSH. Results showed that the antioxidative capacity was sequenced as HEKVC<HDHPVC<GSH. All of them were considered to belong to slow kinetics behavior and showed a 3-5 folds higher EC50than at the steady state. It is concluded that HDHPVC and HEKVC are excellent natural antioxidants.
His-Glu-Lys-Val-Cys; His-Glu-Lys-Val-Cys; DPPH free radical; antioxidant; kinetics
TS218;TS201.2
A
1002-6630(2014)17-0109-05
10.7506/spkx1002-6630-201417022
2013-09-11
广西自然科学基金重点项目(2012GXNSFDA053004);广西理工科学实验中心重点项目(LGZX201208)
蒋海萍(1986—),女,博士研究生,研究方向为功能活性物质提取。E-mail:hpjiang2011@sina.com
*通信作者:廖丹葵(1967—),女,教授,博士,研究方向为精细化工、生物制品分离纯化、生物功能材料。
E-mail:liaodk@gxu.edu.cn
