应用多重PCR-液相悬浮芯片技术检测转基因水稻品系
2014-01-18黄文胜邓婷婷李富威
黄文胜,傅 凯,邓婷婷,李富威,刘 昊,陈 颖
(中国检验检疫科学研究院,北京 100123)
应用多重PCR-液相悬浮芯片技术检测转基因水稻品系
黄文胜,傅 凯,邓婷婷,李富威,刘 昊,陈 颖*
(中国检验检疫科学研究院,北京 100123)
开展转基因水稻的多重聚合酶链式反应(polymerase chain reaction,PCR)液相芯片检测方法研究。针对科丰6号(KF6)、科丰8号(KF8)、华恢1号(BT63)、克螟稻(KMD1)、M12、T1C-19、T2A-1、LL62和LL601九种转基因水稻的侧翼序列,设计合成了在生物素标记的多重PCR扩增引物与固定在荧光编码微球上的探针,建立了2 个多重PCR-液相芯片检测体系,可同时检测出这9 种转基因水稻成分。结果表明,9 种转基因水稻的引物和探针都具有较高的特异性,各组引物/探针之间无交叉扩增和非特异杂交,且在多重PCR-液相芯片检测中9 种转基因水稻品系的相对检测灵敏度达到0.1%水平,符合欧盟和其他国家有关转基因产品标识的要求。本方法的检测效率和准确性均高于传统方法,可作为进出口转基因产品和国内转基因检测的有效方法。
多重PCR;液相芯片;转基因水稻;检测
转基因水稻研发进展迅速,各国科学家累计将超过30 种外源基因转入各个亚种的水稻中。迄今为止,全球已有5 种转基因水稻获准田间种植,如抗草丁膦转基因水稻LL62、LL601分别于1999年和2006年在美国获准种植。然而,许多国家对转基因产品有市场准入要求,未获允许不得生产和销售。但在粮食生产加工和流通环节难免发生转基因大米污染,如2005年绿色和平组织在湖北发现转基因水稻非法种植和销售,2006年欧盟从中国米制品中检出“BT63”成分,2007年欧盟从进口美国长粒米中检出转基因大米LL601等,这些污染事件给相关出口国造成重大损失。我国的米和米制品年出口额达数亿美元,同时我国也是重要的大米进口国,2012年从越南、泰国、印度、巴基斯坦等进口稻谷和大米236.9万t[1-3]。为防止转基因大米非法进出口,我国出入境检验检疫部门依法对进出口大米和米制品进行转基因检验[4-5]。当前多数国家采用聚合酶链式反应(polymerase chain reaction,PCR)技术检测转基因大米成分,同时探索液相芯片和等温扩增等相关方法[6-10]。王渭霞等[11-12]应用实时定量PCR检测抗虫转基因水稻科丰6号,灵敏度达0.1%。但PCR方法的检测通量较低,为提高检测效率,Fantozzi[9]和Chois[13]等首先将液相芯片技术应用于转基因作物的筛选检测,特异性和效率高于PCR方法。液相芯片技术以荧光编码微球为基础,微球有直径约5.6 μm的聚苯乙稀塑料微球和6.5 μm的磁性微球两种类型,其表面带有大量的活性基团,可与核酸探针、抗原、抗体等分子偶联。微球在生成过程中带上红色和橙色两种突光染料,两种染料分别有10 个区分的不同配比赋予了微球100 种不同的颜色,产生了 100 种不同光谱学指纹的微球体,每种微球特异性的偶联针对目的DNA序列的寡核苷酸探针,就可以标记100 种不同的探针分子,液相芯片的检测系统内置两束波长不同激光发射器,其中一束激光用来激发荧光微球自身的荧光物质,根据探测到的荧光微球自身发出的荧光强度来决定探针分子的特异性(定性);另一束激光用来激发报告分子所携带的荧光物质,通过对报告分子发出荧光强度的测量,对待检生物分子进行定量或半定量检测[14-15]。
本实验采用多重PCR-液相芯片技术检测转基因水稻品系中外源基因端与水稻基因组DNA的连接区的的侧翼序列,旨在建立转基因水稻品系特异性的液相芯片高通量检测方法,以满足出入境检验和国内转基因监管执法的需要。
1 材料与方法
1.1 材料、试剂与仪器
非转基因水稻购自北京市场;KF6、KF8、BT63、KMD1、M12、T2A-1、T1C-19等转基因水稻种子为中国检验检疫科学研究院所保存;LL62、LL601 美国油脂化学协会。
HotStarTaq®DNA Polymerase 德国Qiagen公司;dNTPs 日本Takara公司;1-乙基-(3-二甲基氨基丙基)碳化二亚胺盐酸盐(1-(3-dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride,EDC)、2-吗啉乙磺酸(2-morpholinoethanesulfonic acid,MES)、十二烷基磺酸钠(sodium dodecyl sulfonate,sds)、Tween-20、四甲基氯化铵(tetramethylammonium chloride,TMAC)美国Sigma公司;链霉亲和素-藻红素(streptavidinphycoerythrin,SA-PE) 上海Invitrogen公司;羧基化微球 美国Bio-Rad公司。
Veriti PCR仪 美国AB公司;DYY-6C电泳仪;MixMate混匀仪 德国Eppendorf公司; Bio-PlexTM200液相芯片检测仪、Vacuum Pump真空抽滤仪 美国Bio-Rad公司;Nano Drop 3300核酸测定仪 美国Thermo Fisher公司。
1.2 方法
1.2.1 引物与探针
基于外源基因与水稻基因组之间的连接区域序列,利用Primer Premier 5.0引物设计软件分别设计多对KF6、KF8、T1C-19、T2A-1、BT63、KMD1、M12、LL62和LL601等水稻品系特异性检测引物,并对引物进行筛选和优化。引物长度一般为18~25 个碱基,引物G+C含量尽可能在40%~60%之间,为了使得液相芯片的杂交效率提高,目的扩增片段最好在100~300 bp之间,下游引物5’端进行生物素标记,目的是与链霉亲和素化的藻红蛋白反应,带标记的单链扩增片段必须与偶联微球的捕获探针互补,探针长度最好为18~24 bp左右,G+C含量应在40%~60%之内,探针必须有一定的空间与目的片段杂交,且有氨基与羧基化的荧光微球偶联,所以在5’端进行氨基修饰的C12手臂的标记(5’Minolinker C12),同时针对每条探针设计反向互补探针(验证探针),且5’端进行生物素标记,用于验证偶联效率[15]。引物代号、序列和标记等详细信息见表1。所有引物/探针由上海英骏生物公司合成。

表1 转基因水稻品系检测使用的引物和探针Table1 Primers and probes used in this study
1.2.2 DNA提取及PCR扩增
水稻基因组DNA的提取采用CTAB分步沉淀法,CTAB 法试剂配制及操作步骤参照Dietrieh Made方法。提取的DNA用Nano Drop核酸测定仪进行质量浓度和纯度的测定,最后质量浓度统一调整为10 ng/μL,用于后续单重PCR和多重PCR反应。
单重PCR扩增反应体系(20 μL):10×HotStarTaq Buffer 2.5 μL,2.5 mmol/L dNTP 2.0 μL,MgCl2(25 mmol/L)1.0 μL,DNA模板(10 ng/μL)5.0 μL,上下游引物(10 μmol/L)各0.5 μL,HotStart酶(10 U/μL)0.2 μL,加灭菌双蒸水补足体积至20 μL。以水代替DNA模板作为空白对照,以阴性水稻DNA为模板作为阴性对照。PCR反应的扩增条件为:95 ℃ 预变性 10 min;95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸30 s,共35 个循环,72 ℃延伸5 min。反应结束后,取5 μL PCR产物于2%琼脂糖凝胶上电泳,观察结果。其余4 ℃保存备用。
1.2.3 液相芯片的检测
1.2.3.1 微球的偶联
微球偶联按照Bio-Rad公司的标准操作程序进行:将微球涡旋30 s、超声振荡30 s后,取50 μL(6.25×106个)微球于离心管中,离心去上清液;用50 μL 0.1 mol/L MES(pH 4.5)重悬微球,使微球充分分散,加入一定量探针。制备新鲜的EDC溶液(10 mg/mL),加入2.5 μL EDC至加有探针的微球混合物中,充分混匀,室温避光孵育30 min,然后再加入2.5 μL新鲜配制的EDC溶液,室温孵育30 min。用1 mL 0.02% Tween-20和1 mL 0.1% SDS各洗涤一次,最后用50 TE缓冲液重悬微球,4 ℃避光保存。
1.2.3.2 液相芯片杂交
杂交体系中各组分为PCR纯化产物1.0 μL,1.5×TMAC 33.0 μL,按需要加入偶联有不同基因探针的荧光编码微球0.5 μL,用1×TE补足反应体系总体积至50 μL。
液相芯片杂交按照公司推荐步骤进行:杂交通常在PCR仪上进行。先95 ℃变性5 min,然后55℃杂交10 min;杂交完的样品转到96 孔滤板进行真空抽滤;将SA-PE用TE稀释到4 ng/μL,每孔加入50 μL,先在混匀仪上以1 100 r/min避光振荡1 min,然后以550 r/min室温孵育5 min;抽干滤孔板,然后用TE洗两次,最后用125 μL TE进行重悬。在液相芯片检测仪按要求校正和校准后,放入样品板,对样品进行荧光检测。
1.2.3.3 引物、探针特异性检测
将9 个品系的转基因水稻DNA稀释至10 ng/μL,设置阴性与空白对照,进行常规PCR反应(3次实验重复);反应结束后,取5 μL PCR扩增产物于2%琼脂糖凝胶上电泳,观察电泳结果,统计9 个品系特异性引物的交叉扩增情况。为测试液相芯片品系特异性探针相互之间的交叉反应,将9 种偶联不同探针的荧光编码微球依次与每种品系的PCR扩增产物混合,进行杂交反应检测,统计9 个品系特异性探针的交叉反应的信号强度。
1.2.3.4 引物、探针的灵敏度检测
用CTAB法分别提取9种转基因水稻与非转基因水稻的DNA,并用纯水将基因组DNA分别稀释到10 ng/μL。将各个品系的转基因水稻的DNA进行10 倍梯度稀释,以此为模板进行PCR扩增,对扩增产物进行凝胶电泳和液相芯片杂交分析,确定针对该品系的绝对灵敏度。将各个品系的转基因水稻的DNA(100%)与非转基因水稻DNA以不同比例稀释,从而得到不同百分含量的转基因水稻DNA,以此为模板进行PCR扩增,对扩增产物进行凝胶电泳和液相芯片杂交分析确定针对该品系的相对灵敏度。
1.2.3.5 多重PCR-液相芯片品系检测
根据9个品系的引物/探针的交叉反应情况、PCR扩增效率及PCR-液相芯片检测的信号强度,将9个品系引物分为2组,进行多重PCR-液相芯片检测。第1组为KF6、KF8、LL62和LL601分;第2组为T1C-19、T2A-1、BT63、KMD1和M12。多重PCR扩增反应体系(20 μL)为:10×HotStar Taq Buffer 2.5 μL,2.5 mmol/L dNTP 2.0 μL,25 mmol/L MgCl21.0 μL,HotStar酶0.2 μL,引物(适宜浓度),最后加双蒸水补足体积至20 μL。多重PCR反应程序和液相芯片检测程序同单重PCR。
1.3 数据处理
参考Bio-Rad公司推荐方法及相关文献[17-18]处理本实验相关数据。液相芯片中特定探针(微球)的定性临界值的确定:根据日常实验的统计结果,将探针(微球)的检测空白对照(以水为模板)PCR产物的校正后的荧光强度中位值(mean fluorescence intensity blank,MFIB)的5 倍确定为定性临界值,如待测样品PCR产物的校正后的荧光强度中位值(mean fluorescence intensity samples,MFIS)≥5×MFIB,则判定为样本检测结果阳性,如果3×MFIB≤MFIS<5×MFIB,则判定为可疑阳性,如果MFIS<3×MFIB,则判定为检测结果为阴性;根据日常实验中获得的经验,设定液相芯片检测的质控条件为:MFIB<50,且阴性对照的荧光强度中位值(mean fluorescence intensity negative,MFIN)<5×MFIB,否则说明PCR试剂或DNA提取过程存在交叉污染。
2 结果与分析
2.1 引物、探针的特异性
转基因水稻品系特异性引物的单重PCR电泳检测结果如图1所示。9 对引物均可扩出预期长度的外源片段,且仅在对应的转基因水稻品系样本中扩增出目的片段,无交叉扩增现象。结果表明所设计的9 对引物的特异性符合检测要求。
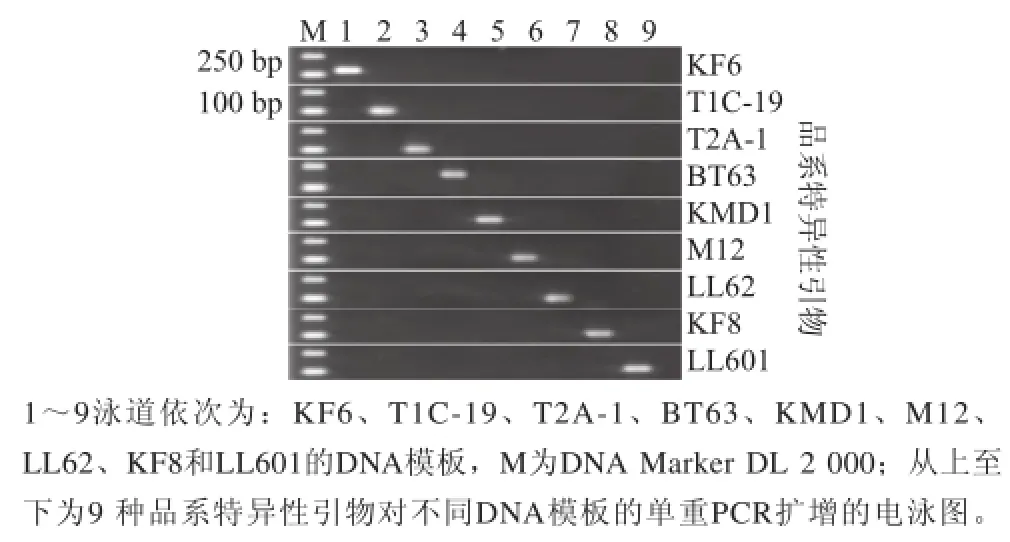
图1 检测引物的特异性Fig.1 Specificity test of primers for the detection of 9 GM rice lines
9 种品系检测探针的特异实验结果见表2。除个别探针外,大多数探针的阴性对照和空白对照(以水为模板)的MFI值相近,一般在5~10之间,表明液相芯片检测的本底信号极低。9 个水稻品系的检测探针同非靶标品系PCR产物的杂交信号强度接近阴性对照和空白对照,而各探针的靶标品系的MFI值达到846~2 837,是空白对照的90~300 倍,证明这些探针的特异性较强,且荧光信号值较高,符合品系检测要求。

表2 检测探针的特异性Table2 Specificity of probes for the detection of 9 GM rice lines
2.2 单重PCR-液相芯片检测的绝对灵敏度
以10 ng/μL的样品DNA作为检测起始质量浓度,10 倍梯度稀释5 次,每个质量浓度作3 个平行,以水作为空白对照,进行PCR扩增。取各质量浓度的PCR产物1 μL进行液相芯片杂交检测,MFI值见表3。按照空白对照MFI值的5 倍作为定性检测的临界值进行结果判读,9 个品系的绝对灵敏度均能达到0.01 ng/μL;其中KF6、T1C-19、T2A-1、KMD1和LL62这5 个品系的绝对灵敏度能达到0.001 ng/μL。说明PCR-液相芯片检测的灵敏度比PCR-凝胶电泳要高1~2 个数量级。表3也说明该体系中模板质量浓度为1 ng/μL时,探针结合效率及信号强度可达到饱和。因此,当模板质量浓度上升为10 ng/μL时其MFI值出现波动甚至部分品系的MFI值有小幅度下降的现象出现。

表3 单重PCR-液相芯片检测体系的绝对灵敏度Table3 Absolute sensitivity of simplex-PCR-liquid array
2.3 多重PCR-液相芯片检测
若待测样品只需检测1 种或数种转基因水稻品系,则单重PCR-液相芯片检测可以满足需要,若需同时检测5 种以上品系,则单重PCR方法过于繁琐。为在多靶标检测时减少PCR反应的数量,将9 种水稻品系分为2 组,进行多重PCR扩增。为使各组的每对品系特异性引物同时达到相近扩增效率,对多重PCR体系中各品系特异性引物的使用量进行优化,优化后的引物浓度见表4。
在每组多重PCR体系中加入相应的水稻品系的DNA各10 ng,作为PCR扩增模板,阴性对照以50 ng阴性水稻DNA作为模板,空白对照以纯水为模板,进行多重PCR扩增。取多重PCR产物1 μL,进行相应的液相芯片的检测,实验重复3 次,取3 次的平均值,两组多重PCR-液相芯片检测结果见图2。结果显示,2 组多重PCR的各品系探针的阳性样品MFI值都在500以上,阴性和空白对照MFI值都在20以下。BT63的品系探针杂交信号在多重PCR检测中相对较弱,其他探针都有较强的杂交信号。说明5重PCR-液相芯片检测相互之间无显著干扰,多重引物扩增的灵敏度和探针杂交的特异性与单重PCR-液相芯片检测近似。

图2 转基因水稻品系多重PCR液相芯片检测Fig.2 Detection of 9 GM rice lines with multiplex PCR-liquid chip method
2.4 多重PCR-液相芯片检测的相对灵敏度

图3 MPCR液相芯片检测体系的相对灵敏度实验(1%)Fig.3 Relative sensitivity of multiplex PCR-liquid array (the simulated GM mixture containing 1% of each event)

图4 MPCR液相芯片检测体系的相对灵敏度实验(0.11%)Fig.4 Relative sensitivity of multiplex PCR-liquid array (the simulated GM mixture containing 0.1% of each event)

图5 MPCR液相芯片检测体系的相对灵敏度实验(0.01%)Fig.5 Relative sensitivity of multiplex PCR-liquid array (the simulated GM mixture containing 0.01% of each event)
以非转基因水稻DNA作为基质,掺入不同比例的相应品系转基因水稻的DNA(10 ng/μL),配成1%、0.1%和0.01% 3 个百分含量的模拟添加样品,每个水平各设3 个平行,且每个品系特异性引物/探针各自设立阴性和空白对照(以水为模板),进行MPCR-液相芯片检测。9 个品系的多重PCR-液相芯片检测结果见图3~5(MFI值均为3 次重复的平均值)。
按照结果判读标准,品系KF6、LL62、LL601和T1C-19的相对灵敏度为0.01%,KF8、BT63、KMD1、M12、T2A-1的相对灵敏度达0.1%。由于欧盟及日韩等国转基因标识的阈值都远高于0.1%,因此,各品系转基因水稻的PCR-液相芯片检测灵敏度均符合相关国家和地区的要求。
3 结 论
本实验开展了9 种转基因水稻品系的多重PCR-液相芯片检测方法研究,与传统的固态芯片相比,液相芯片技术具有高通量、特异灵敏、快速灵活等优点,由于微球直径小,近似液相的反应体系有利于提高反应速度[16-17];而且每种探针都使用数千个微球同时进行杂交检测,检测结果的稳定性、重复性都得到了很大提高;检测通量大,由于多种微球在同一个体系反应,理论上可同时检测100 个靶标基因。液相芯片在食品安全和检验检疫上有很好的应用前景[18-20]。
本实验建立的9 种转基因水稻品系的多重PCR-液相芯片检测方法,特异性良好,最低检测限达到0.1%,与传统低密度固相芯片检测方法相比,操作更简便,结果可信度更高,适用于进出口大米及米制品中转基因成分的高通量检测,也符合国内转基因监管的检测要求。
[1] 陈浩, 林拥军, 张启发. 转基因水稻研究的回顾与展望[J]. 科学通报, 2009, 54(18): 2699-2717.
[2] 朱祯. 转基因水稻研发进展[J]. 中国农业科技导报, 2010, 12(2): 9-16.
[3] 李黎红, 叶卫军, 郭龙彪. 我国转基因水稻研究进展和商业化前景分析[J]. 中国稻米, 2012, 18(6): 1-4.
[4] HUANG J K, HU R F, ROZELLE S, et al. Insect-resist ant GMO rice in farmers’ fields: assessing productivity and health efects in China[J]. Science, 2005, 308: 688-690.
[5] 张明辉, 高学军, 于艳波, 等. 转基因农产品定量检测研究进展[J/ OL]. 中国科技论文在线, http://www.paper.edu.cn.
[6] THEANJUMPOL P, RIPON S, KARABOON S, et al. Aromatic Thai rice identification by near-infrared reflectance spectroscopy[R]. Tropentag: Stuttgart-Hohenheim, 2005.
[7] 成晓维, 王小玉, 胡松楠, 等. 可视芯片检测大豆、水稻和玉米中的转基因成分[J]. 现代食品科技, 2013, 29(3): 654-659.
[8] GERMINI A, ROSSI S, ZANETTI A, et al. Development of a peptide nucleic acid array platform for the detection of genetically modified organisms in food[J]. Agricultral Food Chemistry, 2006, 53(10): 3958-3962.
[9] FANTOZZI A, ERMOLLI M, MARINI M, et al. Innovative application offluorescent microsphere based assay for multiple GMO detection[J]. Food Anal Methods, 2008, 1: 10-17.
[10] 邱良焱, 肖有玉, 刘佳, 等. 多重PCR法检测转Bar、Bt基因双抗稻米[J].食品科学, 2013, 34(6): 139-142.
[11] 王渭霞, 赖凤香, 洪利英, 等. 应用多重PCR技术快速检测抗虫转基因水稻[J]. 中国测试, 2009, 35(6): 97-101.
[12] 王渭霞, 赖凤香, 洪利英, 等. 实时定量PCR检测转基因水稻科丰6号插入拷贝数和转基因含量[J]. 农业生物技术学报, 2012, 20(1): 9-15.
[13] CHOI S H. Hexaplex PCR assay and liquid bead array for detection of stacked genetically modified cotton event 281-24-236×3006-210-23[J]. Analytical Bioanal Chemistry, 2011, 401: 647-655.
[14] 杨洋, 汤华. 液相芯片技术在检验医学和生物医学中的应用[J]. 中国生物化学与分子生物学报, 2007, 23(4): 256-261.
[15] 程涛. 4 种转基因玉米液相芯片检测方法的建立[D]. 南京: 南京师范大学, 2012.
[16] DUNBAR S A. Applications of Luminex®xMAP technology for rapid, high-throughput multiplexed nucleic acid detection[J]. Clinica Chimica Acta, 2006, 363(1/2): 71-82.
[17] 郭喜玲, 葛以跃, 崔仑标, 等. 流感及H5N1亚型禽流感病毒液相检测芯片的制备[J]. 热带医学杂志, 2010, 10(10): 1156-1159.
[18] 郭斌, 祁洋, 尉亚辉. 转基因植物检测技术的研究进展[J]. 中国生物工程杂志, 2010, 30(2): 120-126.
[19] MAHONY J, CHO NG S, MERANTE F, et al. Development of a respiratory virus panel test for detection of twenty human respiratory viruses by use of multiplex PCR and a fluid microbead-based assay[J]. Journal of Clinical Microbiology, 2007, 45(9): 2965-2970.
[20] LEE W M, GRINDLE K, PAPPAS T, et al. High-throughput, sensitive, and accurate multiplex PCR-microsphere flow cytometry system for large-scale comprehensive detection of respiratory viruses[J]. Journal of Clinical Microbiology, 2007, 45(8): 2626-2634.
Development of Multiplex PCR Coupled with Liquid Bead Array for the Detection of Nine Genetically Modified Rice Events
HUANG Wen-sheng, FU Kai, DENG Ting-ting, LI Fu-wei, LIU Hao, CHEN Ying*
(Chinese Academy of Inspection and Qurantine, Beijing 100123, China)
A multiplex PCR assay coupled with liquid bead array was developed for simultaneous identification of nine genetically modified rice (Oryzae sativa) lines. Based on the junction sequences between host plant genome DNA and the exogenous gene of the GM rice events (BT63, KF6, KF8, M12, KMD1, T1C-19, T2A-1, LL601, and LL62), the eventspecific primers and probes were designed for each event. In addition, in order to reduce the number of PCR reactions, two multiplex PCR systems were adopted and optimized by adjusting the concentration of each primer. Detection specificity was provided by capture probes designed for each GMO rice event which were covalently attached to florescent coding beads. The PCR amplicons were biotin-labeled and directly hybridized with the capture probes on the beads, and then the beads were detected according to protocol of Bio-Rad. The sensitivity of the assay was evaluated and the results indicated that the limit of detection was around 0.1% for 9 events. With improved detection efficiency and accuracy, the detection system complied with the requirements of current regulations in EU, Japan and China for the thresholds for the labeling of GMO, and could be applied in the enforcement of GM regulation in China.
multiplex PCR; liquid bead array; transgenic rice; detection
TS201.6
A
1002-6630(2014)20-0158-06
10.7506/spkx1002-6630-201420032
2013-11-25
国家科技重大专项(2014ZX08012-001);国家质检总局科技计划项目(2014IK083)
黄文胜(1967—),男,研究员,硕士,研究方向为食品质量安全。E-mail:hwscaiq@163.com
*通信作者:陈颖(1972—),女,研究员,博士,研究方向为食品质量安全。E-mail:chenyingcaiq@163.com
