高效液相色谱法测定永川豆豉中的6 种有机酸
2014-01-18叶秀娟索化夷阚建全
叶秀娟,郑 炯,2,*,索化夷,2,阚建全,2
(1.西南大学食品科学学院,重庆 400715;2.农业部农产品贮藏保鲜质量安全风险评估实验室(重庆),重庆 400715)
高效液相色谱法测定永川豆豉中的6 种有机酸
叶秀娟1,郑 炯1,2,*,索化夷1,2,阚建全1,2
(1.西南大学食品科学学院,重庆 400715;2.农业部农产品贮藏保鲜质量安全风险评估实验室(重庆),重庆 400715)
建立高效液相色谱法同时测定永川豆豉中酒石酸、苹果酸、乳酸、醋酸、柠檬酸和琥珀酸6 种有机酸含量的方法。通过色谱条件的优化,确定永川豆豉中6 种有机酸含量测定的最佳色谱条件:色谱柱为Agilent ZORBAX SB-Aq(4.6 mm×250 mm,5 μm),流动相为0.01 mol/L磷酸氢二铵(pH 2.5)和甲醇溶液,流速0.6 mL/min、柱温30 ℃、检测波长220 nm。在此条件下,上述6 种有机酸可得到很好的分离和测定。该方法各种酸的线性范围为0.001~1.000 mg/mL,标准曲线相关系数均在0.999 9以上,精密度检测相对标准偏差为0.07%~0.36%(n=5),重复性检测相对标准偏差为0.97%~3.04%(n=5),回收率在94.89%~104.28%之间。该方法简单、快捷、准确、重复性好,可应用于永川豆豉中6 种有机酸的同时快速测定。
永川豆豉;高效液相色谱法;有机酸;测定
豆豉是以整粒大豆或豆瓣为原料,经浸泡、蒸煮、制曲、发酵等工序加工而成的,具有极高营养价值和医疗价值的大豆发酵食品。豆豉历史悠久、风味独特,是佐餐调味的佳品,富含大豆多肽、异黄酮、皂苷、低聚糖、溶栓酶等多种功能性成分[1],因其具有抗氧化[2]、降压[3]、降血糖[4]等多种保健功能而深受人们喜爱。豆豉按其发酵微生物的不同,主要可分为曲霉型、毛霉型、根霉型和细菌型,其中毛霉型豆豉以重庆的永川豆豉为代表。永川豆豉起源于300多年前[5],外观光亮油黑,味道清香回甜,富含人体所需的18 种氨基酸及独特的营养保健功能成分。
有机酸的测定通常采用滴定法、分光光度法、气相色谱法、薄层色谱法、酶法等[6-8],然而各种方法都存在一定的局限性,如化学法预处理步骤较多、易受干扰,且所用时间较长;酶法每次只能测定一种有机酸;薄层色谱法只能定性和半定量,测量精度较差;气相色谱法仅适用于测定挥发性有机酸,且需衍生处理,操作繁琐,准确度较低等。近年来,高效液相色谱(highperformance liquid chromatography,HPLC)法因具有分离效率高、准确度和精密度好等优点被越来越多地用于快速检测领域。目前,国内外有关豆豉的研究主要集中在大豆异黄酮[9-10],豆豉的营养和生理功能[11-15]以及发酵微生物的分离鉴定[16-18]等方面,而有关豆豉中有机酸的研究较少[19]。有机酸是永川豆豉中主要的呈味及风味物质,其含量的多少与豆豉的风味密切相关。因此,本实验拟建立HPLC同时测定永川豆豉中酒石酸等6 种有机酸的分析方法,并对有机酸组分及含量进行检测,以期为永川豆豉风味特性和发酵品质的研究提供有益参考。
1 材料与方法
1.1 材料与试剂
实验所用材料为永川豆豉食品有限公司经天然制曲发酵而成的永川毛霉型豆豉,原料大豆产地为吉林省。
酒石酸、柠檬酸、苹果酸、醋酸、乳酸、琥珀酸标准品 美国Sigma公司;磷酸氢二铵、磷酸(分析纯)成都市科龙化工试剂厂;甲醇(色谱纯) 天津市四友精细化学品有限公司。
1.2 仪器与设备
LC-20A高效液相色谱仪(含二极管阵列检测器)日本岛津公司;ZORBAX SB-Aq(4.6 mm×250 mm,5 μm)色谱柱 美国Agilent公司;Milli-Q超纯水仪美国密理博公司;KQ-100B型超声波清洗机 昆山市超声仪器有限公司;Centrifuge5810高速离心机 德国Eppendorf公司;PB-10标准型pH计 德国赛多利斯公司。
1.3 方法
1.3.1 色谱条件
色谱柱:A g i l e n t Z O R B A X S B-A q(4.6 mm×250 mm,5 μm);检测器:二极管阵列检测器;流动相A为磷酸氢二铵,并用H3PO4调节pH值,流动相B为甲醇;梯度洗脱(洗脱条件:0~20 min,5%~30%B;20~25 min,30%~50%B;25~30 min,50%B;30~35 min,50%~5%B;35~45 min,5%B);流速为0.6 mL/min;检测波长为220 nm;进样量10 μL;柱温30 ℃。
1.3.2 样品处理
参照杨君等[20]的方法并加以改进。准确称取切细的2.5 g豆豉,研磨后转入到100 mL离心管中,加入50 mL超纯水,于超声波清洗机中提取30 min,使有机酸充分浸出,冷却后4 000 r/min离心20 min,上清液过滤到100 mL的容量瓶中,残渣加入25 mL超纯水再提取,合并上清液,用超纯水定容至刻度。待测液用0.22 μm滤膜过滤,将滤液置于2 mL的进样瓶中待色谱测定。
1.3.3 标准曲线绘制
分别精密称取酒石酸、苹果酸、乳酸、醋酸、柠檬酸、琥珀酸各50 mg,用超纯水溶解并定容至25 mL容量瓶中,摇匀,得2.00 mg/mL的混合有机酸标准母液。分别吸取各标准混合母液,用超纯水稀释成1.000、0.500、0.200、0.100、0.020、0.010、0.001 mg/mL系列混合标准溶液。将系列混合标准溶液经0.22 μm微孔滤膜过滤至2 mL进样瓶中,进样,以峰面积(X)对质量浓度(Y)求回归方程和相关系数。
1.3.4 样品测定
将处理后的样品提取液进行HPLC分析,进样量为10 μL,采用外标法定量。
1.4 数据处理
使用SPSS 16.0、Microcal Origin 7.5等软件进行图表的绘制和相关数据的处理。
2 结果与分析
2.1 有机酸测定色谱条件的优化
2.1.1 流动相pH值对有机酸保留时间的影响
设置流速为0.8 mL/min、柱温30 ℃,以0.01 mol/L磷酸氢二铵为流动相,用1.0 mol/L磷酸调节pH值,考察不同pH值(2.1、2.3、2.5、2.7、2.9)条件下有机酸的分离情况,如图1所示。

图1 流动相pH值对有机酸保留时间的影响Fig.1 Effect of mobile phase pH on the retention times of organic acids
由图1可知,琥珀酸、柠檬酸的保留时间随pH值的增大而呈下降趋势,乳酸呈升高趋势,而醋酸、苹果酸、酒石酸则基本保持不变;pH值较低,6 种酸的峰总体分离度较好,然而出峰时间较长,随着pH值增高,6 种酸的出峰时间总体缩短,但分离效果却越来越差。pH值为2.1和2.3时尽管6 种酸的分离度均较好,但由于出峰时间较长加之pH值过低容易对色谱柱造成影响,故综合考虑,当使用pH值为2.5的0.01 mol/L磷酸氢二铵作为流动相时,6 种有机酸的分离效果较好。这一实验结果与谭丽贤[21]采用固相萃取-HPLC法测定酱油中有机酸的最佳优化条件基本一致。
2.1.2 流速对有机酸保留时间的影响
设定柱温30 ℃,以0.01 mol/L磷酸氢二铵溶液(固定pH 2.5)为流动相,考察流速分别为0.5、0.6、0.7、0.8、1.0 mL/min时6 种有机酸的分离情况,如图2所示。

图2 流速对有机酸保留时间的影响Fig.2 Effect of flow rate on the retention times of organic acids
由图2可知,当流速为0.5 mL/min时,6 种酸的出峰时间间距加大,有利于峰的分离,但保留时间整体靠后,导致分析时间延长,且各峰出现明显的拖尾现象;随着流速的增大,分析时间明显缩短,然而6 种酸的分离程度却越来越差,且柱压升高不利于色谱柱的保护与长期使用。当流速为0.8 mL/min时,醋酸、乳酸两者的峰形开始出现重叠,影响了分离效果。综合分离效果及分析效率,最终确定0.6 mL/min的流速进行后续实验。
2.1.3 柱温对有机酸保留时间的影响
以0.01 mol/L磷酸氢二铵溶液(用1.0 mol/L磷酸调节pH 2.5)为流动相,固定流速0.6 mL/min不变,在25、30、35、40、45 ℃ 5 个柱温条件下分别进行测定,如图3所示。

图3 柱温对有机酸保留时间的影响Fig.3 Effect of column temperature on the retention times of organic acids
由图3可知,柱温对琥珀酸及柠檬酸的影响较大;随着柱温的升高,各有机酸组分的出峰时间均提前,除乳酸和醋酸的分离度越来越高外,其余各种酸的分离度均越来越低。40 ℃时6 种酸的分离程度已不及35 ℃时,25 ℃时醋酸、乳酸、苹果酸三者的分离度不高且分析时间过长,30 ℃和35 ℃条件下各种酸的分离度最好,然而考虑到温度过高会对有机酸的挥发产生影响,故选择30 ℃作为最佳的柱温条件。江勇等[22]采用HPLC法测定酱油中的有机酸,优化后固定柱温为30 ℃进行测定,与本实验柱温优化结果相一致(图4)。
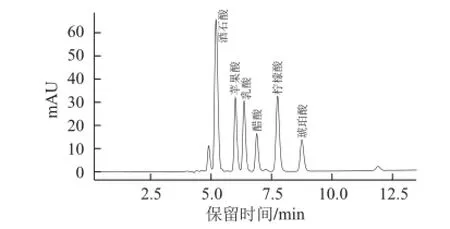
图4 有机酸混合标样的高效液相色谱图Fig.4 HPLC chromatograms of organic acid standards
2.2 线性范围
将质量浓度在0.001~1.0 mg/mL范围内的系列混标溶液进行HPLC分析,对各测得值进行相关系数分析和线性回归分析,结果见表1。结果表明:6 种酸的相关系数(R2)都为0.999 9,说明各种有机酸组分的峰面积和有机酸组分质量浓度的线性相关性很好,在此条件下可以很好地测定有机酸的含量。当信噪比为3时,6 种有机酸的检测限结果见表1。

表1 有机酸测定的线性相关性Table1 Linear equations with correlation coefficients and linear ranges, and limits of detection for six organic acids
2.3 精密度
将0.2 mg/mL的混标连续进样5 次,根据所得峰面积分别计算精密度,酒石酸、苹果酸、乳酸、醋酸、柠檬酸、琥珀酸的相对标准偏差(relative standard deviations,RSD)范围在0.07%~0.36%之间,表明该方法的精密度良好,结果见表2。

表2 方法的精密度实验(n=5)Table2 Results of precision experiments (n=5)
2.4 重复性
精密称取同一份均匀混合的豆豉样品5 份,按1.3.2节方法制备供试品溶液,按上述色谱条件进样10 μL,测得酒石酸、苹果酸、乳酸、醋酸、柠檬酸、琥珀酸的平均含量为4.940、9.165、13.169、8.406、10.100、18.484 mg/g,RSD分别为0.97%、0.98%、1.23%、2.66%、3.04%、1.76%,均在5%以内,表明该方法的重复性均达到分析的要求,结果见表3。

表3 方法的重复性实验(n=5)Table3 Results of repeatability experiments (n=5)
2.5 回收率
准确称取切细的2.0 g豆豉,按1.3.2节方法制备样品提取液,准备同一样品提取液6 份(酒石酸、苹果酸、乳酸、醋酸、柠檬酸和琥珀酸的质量浓度分别为0.093 4、0.183 8、0.255 6、0.157 8、0.192 4、0.364 0 mg/mL),将不同质量浓度的各种有机酸标样加入至每份提取液中,充分混匀后,使得6 种有机酸添加的质量浓度分别为0.500、0.200、0.200、0.200、0.200、0.500 mg/mL,经0.22 μm滤膜过滤后进样检测,平行测定6 次,根据加入的标准样品质量浓度与检出的质量浓度计算回收率,结果见表4。由表4可知,各种有机酸组分的回收率为94.89%~104.28%,均符合分析方法的要求。

表4 有机酸测定的回收率实验(n=6)Table4 Recovery rates of six organic acids in spiked samples (n=6)
2.6 永川豆豉样品的测定
在优化的色谱条件下对永川豆豉样品进行测定,分析其有机酸的组成和含量。结果见表5,色谱图见图5。

表5 永川豆豉中各种有机酸组分含量Table5 Contents of organic acids in Yongchuan douchi
由表5可知,在建立的提取分离条件下,所测6 种有机酸中琥珀酸的含量最高,为19.061 mg/g,其次是乳酸,为13.159 mg/g,柠檬酸、苹果酸、醋酸3 种有机酸的含量相近,分别为10.223、9.100、8.382 mg/g,酒石酸含量最低,为4.859 mg/g。这一结果表明,在本实验建立的HPLC测定方法下永川豆豉中的主要有机酸为琥珀酸和乳酸。熊骏[19]利用紫外-分光光度法对云南传统发酵豆豉中乳酸、苹果酸、酒石酸、柠檬酸和草酸5 种有机酸的含量进行分析,结果表明乳酸的含量最高,而酒石酸含量较低,与本实验结果具有一定的相似性。但本实验建立的HPLC方法具有能同时测定样品中6 种有机酸,且测定时间较短等优点,是一种能够应用于豆豉中有机酸测定的快速检测方法。
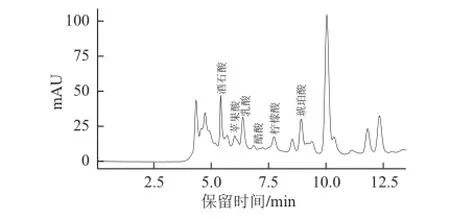
图5 永川豆豉有机酸的高效液相色谱图Fig.5 HPLC chromatograms of organic acids in Yongchuan douchi
3 结 论
本实验采用Agilent ZORBAX SB-Aq色谱柱,通过色谱条件的优化,并经过最低检测限、精密度、重复性、回收率等方法学的考察,最终建立了一种HPLC同时测定永川豆豉中6 种有机酸的分析方法,该方法具有快速、简便、准确和重复性好等优点。应用此方法测定出永川豆豉中6 种有机酸的含量大小依次为:琥珀酸>乳酸>柠檬酸>苹果酸>醋酸>酒石酸。因此,HPLC同时测定永川豆豉中6 种有机酸方法的建立能够为其他豆豉中有机酸的分析提供有益参考。
[1] 索化夷, 卢露, 吴佳敏, 等. 永川豆豉在传统发酵过程中基本成分及蛋白酶活性变化[J]. 食品科学, 2011, 32(1): 177-180.
[2] WANG Dong, WANG Lijun, ZHU Fengxue, et al. In vitro and in vivo studies on the antioxidant activities of the aqueous extracts of douchi (a traditional Chinese salt-fermented soybean food)[J]. Food Chemistry, 2008, 107(4): 1421-1428.
[3] LI Fengjuan, YIN Lijun, LU Xin, et al. Changes in angiotensinⅠ-converting enzyme inhibitory activities during the ripening of douchi (a Chinese traditional soybean product) fermented by various starter cultures[J]. International Journal of Food Properties, 2010, 13(3): 512-524.
[4] CHEN Jing, CHENG Yongqiang, YAMAKI K, et al. Anti-alphaglucosidase activity of Chinese traditionally fermented soybean (douchi)[J]. Food Chemistry, 2007, 103(4): 1091-1096.
[5] 李婷婷, 索化夷, 郑炯. 顶空-固相微萃取-气质联用分析永川豆豉中挥发性成分[J]. 中国调味品, 2013, 38(12): 86-90.
[6] 张龙翔, 张庭芳, 李令媛. 生化实验方法技术[M]. 北京: 高等教育出版社, 1981: 115-118.
[7] 朱晓兰, 高芸, 苏庆德. 毛细管气相色谱法测定番茄中的非挥发性有机酸、高级脂肪酸和低分子量糖类[J]. 食品科学, 2004, 25(9): 152-157.
[8] 雷东锋. 现代生物化学与分子生物学仪器与设备[M]. 北京: 科学出版社, 2006: 222.
[9] FERREIRA M P, OLIVEIRA M C N, MANDARINO J M G, et al. Changes in the isoflavone profile and in the chemical composition of tempeh during processing and refrigeration[J]. Pesquisa Agropecuaria Brasileira, 2011, 46(11): 1555-1561.
[10] 索化夷, 骞宇, 卢露, 等. 永川豆豉传统发酵过程中的大豆异黄酮变化[J]. 食品科学, 2012, 33(8): 270-273.
[11] REYES-BASTIDAS M, REYES-FERNANDEZ E Z, LOPEZCERVANTES J, et al. Physicochemical, nutritional and antioxidant properties of tempeh flour from common bean (Phaseolus vulgaris L.)[J]. Food Science and Technology International, 2010, 16(5): 427-434.
[12] CHANG C T, HSU C K, CHOU S T, et al. Effect of fermentation time on the antioxidant activities of tempeh prepared from fermented soybean using Rhizopus oligosporus[J]. International Journal of Food Science and Technology, 2009, 44(4): 799-806.
[13] WATANABE N, FUJIMOTO K, AOKI H. Antioxidant activities of the water-soluble fraction in tempeh-like fermented soybean (GABA-tempeh)[J]. International Journal of Food Science and Nutrition, 2007, 58(8): 577-587.
[14] CUEVAS-RODRIGUEZ E O, VERDUGO-MONTOYA N M, ANGULO-BEJARANO P I, et al. Nutritional properties of tempeh flour from quality protein maize (Zea mays L.)[J]. LWT-Food Science and Technology, 2006, 39(10): 1072-1079.
[15] AZEKE M A, FRETZDORFF B, BUENING-PFAUE H, et al. Nutritional value of African yambean (Sphenostylis stenocarpa L.): improvement by solid substrate fermentation using the tempeh fungus Rhizopus oligosporus[J]. Journal of the Science of Food and Agriculture, 2007, 87(2): 297-304.
[16] CHEN Tingtao, XIONG Shunqiang, JIANG Shuying, et al. Molecular identification of microbial community in Chinese douchi during postfermentation process[J]. Food Science and Biotechnology, 2011, 20(6): 1633-1638.
[17] CHEN Tingtao, WANG Mengjuan, JIANG Shuying, et al. Investigation of the microbial changes during koji-making process of douchi by culturedependent techniques and PCR-DGGE[J]. International Journal of Food Science and Technology, 2011, 46(9): 1878-1883.
[18] CHEN Tingtao, JIANG Shuying, XIONG Shunqiang, et al. Application of denaturing gradient gel electrophoresis to microbial diversity analysis in Chinese douchi[J]. Journal of the Science of Food and Agriculture, 2012, 92(10): 2171-2176.
[19] 熊骏. 云南传统发酵豆豉由来乳酸菌中主要有机酸的分析及其抑菌效果研究[D]. 昆明: 昆明理工大学, 2011.
[20] 杨君, 贺云川, 何家林, 等. 榨菜腌制过程中有机酸变化[J]. 食品科学, 2012, 33(19): 182-187.
[21] 谭丽贤. 固相萃取-高效液相色谱法测定酱油中的7 种有机酸[J]. 现代食品科技, 2012, 28(7): 871-874.
[22] 江勇, 倪永年, 朱惠芳. HPLC测定酱油中的有机酸及其聚类分析[J].南昌大学学报: 理科版, 2010, 34(5): 471-475.
Determination of Six Organic Acids in Yongchuan Douchi, a Chinese Traditional Fermented Soybean Product, by HPLC
YE Xiu-juan1, ZHENG Jiong1,2,*, SUO Hua-yi1,2, KAN Jian-quan1,2
(1. College of Food Science, Southwest University, Chongqing 400715, China; 2. Laboratory of Quality and Safety Risk Assessment for Agro-products on Storage and Preservation (Chongqing), Ministry of Agriculture, Chongqing 400715, China)
A high performance liquid chromatographic (HPLC) method was established for the simultaneous determination of organic acids in yongchuan douchi, a Chinese traditional fermented soybean product. The optimal chromatographic conditions were determined. An Agilent ZORBAX SB-Aq (4.6 mm × 250 mm, 5 μm) column was used to separate the organic acids. The mobile phase was a mixture of 0.01 mol/L (NH4)2HPO4(pH 2.5) and methanol solution at a flow rate of 0.6 mL/min. The column temperature and UV detection wavelength were set as 30 ℃ and 220 nm, respectively. The six organic acids were successfully separated and determined under the chosen experimental conditions. The calibration curves for all these organic acids displayed a good linear relationship with correlation coefficients above 0.999 9 and precision relative standard deviations (RSDs) of 0.07%-0.36% (n = 5) and repeatability RSD of 0.97%-3.04% (n = 5). The recovery rates of the six organic acids were in the range of 94.89%-104.28%. The method is convenient, rapid, accurate, reproducible and applicable to determine organic acids in yongchuan douchi.
yongchuan douchi; high performance liquid chromatographic (HPLC); organic acid; determination
TS207.3
A
1002-6630(2014)20-0114-05
10.7506/spkx1002-6630-201420023
2014-01-17
国家自然科学基金青年科学基金项目(31201411)
叶秀娟(1991—),女,硕士研究生,研究方向为食品化学与营养学。E-mail:yexiujuan127@gmail.com
*通信作者:郑炯(1982—),男,讲师,博士,研究方向为食品化学、果蔬加工。E-mail:zhengjiong_swu@126.com
