插田泡花色苷的振荡提取及抗氧化活性
2014-01-18蒋华梅石登红王向前苟先美殷亮平杨光琴
蒋华梅,石登红,王向前,苟先美,殷亮平,杨光琴
(1.贵阳学院化学与材料工程学院,贵州 贵阳 550005;2.贵阳学院生物与环境工程学院,贵州 贵阳 550005;3.贵阳学院图书馆,贵州 贵阳 550005)
插田泡花色苷的振荡提取及抗氧化活性
蒋华梅1,石登红2,王向前3,苟先美1,殷亮平1,杨光琴1
(1.贵阳学院化学与材料工程学院,贵州 贵阳 550005;2.贵阳学院生物与环境工程学院,贵州 贵阳 550005;3.贵阳学院图书馆,贵州 贵阳 550005)
采用乙醇振荡提取插田泡果实花色苷,通过正交试验筛选花色苷提取的最佳条件,同时对插田泡花色苷的抗氧化活性进行研究。结果显示,体积分数85%乙醇溶液(pH 3)按料液比1∶30(g/mL)在50 ℃条件下振荡提取1 h,同样条件下样品再重复提取,振荡时间 1 h,花色苷提取量达211.05 mg/100 g。在实验范围内,花色苷对2,2’-联氮-双(3-乙基苯并噻吡咯啉-6-磺酸)(2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS)、二苯代苦味肼基(1,1-diphenyl-2-picrylhydrazyl radical 2,2-diphenyl-1-(2,4,6-trinitrophenyl)hydrazyl,DPPH)、羟自由基(·OH)均有较强的清除能力,清除率随质量浓度的升高而增大,呈正线性相关;花色苷对不同自由基的抑制能力大小依次为·OH(IC50=1.71 μg/mL)>ABTS+·(IC50=2.27 μg/mL)>DPPH自由基(IC50=3.44 μg/mL),抑制能力均远高于阳性对照VC和二丁基羟基甲苯。结果表明,插田泡花色苷具有显著的抗氧化活性,是一种值得开发的天然抗氧化剂和功能性食品资源。
插田泡;花色苷;振荡提取;抗氧化
插田泡(Rubus coreanus Maq.)为蔷薇科悬钩子属植物,又名大乌泡、倒生根、两头草、两头忙等。插田泡果实富含VC、超氧化物歧化酶、蛋白质、氨基酸、糖、钾、钙、镁、磷等多种营养成分[1-2],具有较高的营养价值。此外,插田泡中还含有插田泡苷[3]、花色苷等生物活性物质。花色苷属黄酮类物质,安全无毒,可食用,可作为甜味剂、天然色素等食品添加剂;花色苷还具有消除人体内自由基延缓衰老、抗辐射、抗氧化、抗癌、抗炎、调节免疫力等功效,在食品、化妆品和医药领域有巨大的发展潜力[4-8]。悬钩子属植物中花色苷的研究仅见关于红树莓、黑莓、树莓、灰白毛莓等报道[9-13],有关插田泡果实花色苷 的提取条件及抗氧化性研究较少。本实验以野生插田泡果实为材料,研究插田泡花色苷的乙醇振荡提取条件及抗氧化活性,探讨其提取条件及抗氧化效果。
1 材料与方法
1.1 材料与试剂
野生插田泡果实采自贵州安顺紫云,采摘时间为2013年6月,精选成熟的紫黑色果实洗净后冷冻储存,实验前于室温解冻。
无水乙醇、体积分数95%乙醇、盐酸、醋酸、VC、质量分数30%双氧水、过硫酸钾、邻二氮菲、硫酸亚铁铵等均为国产分析纯;二丁基羟基甲苯(butylated hydroxytoluene,BHT)(食品级) 上海笛柏化学品技术有限公司;2,2’-联氮-双(3-乙基苯并噻吡咯啉-6-磺酸)(2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS)、二苯代苦味肼基(1,1-diphenyl-2-picrylhydrazyl radical 2,2-diphenyl-1-(2,4,6-trinitrophenyl)hydrazyl,DPPH) 美国Sigma公司。
1.2 仪器与设备
CP-214型电子分析天平 美国奥豪斯公司;UV-2550型紫外-可见分光光度计(配备32BitPC汉化软件)日本岛津公司;SHA-B型恒温水浴振荡器 江苏金坛市华欧实验仪器厂。
1.3 方法
1.3.1 最大吸收波长的测定
准确称取2.0 g插田泡果实于室温解冻,研钵研碎,转移到250 mL具塞锥形瓶中,加入盐酸酸化的体积分数75%乙醇溶液(pH 3)40 mL,于35 ℃振荡器中振荡浸提1 h,抽滤,收集滤液。滤液在400~800 nm范围内进行扫描,确定花色苷的最大吸收波长。
1.3.2 花色苷含量的检测方法
1.3.2.1 提取工艺
插田泡果实解冻,准确称取1 g,研碎。不同条件下水浴振荡提取,抽滤,收集滤液。滤渣同样条件下重复提取1 次,抽滤,收集、合并滤液,滤液用提取溶剂定容至100 mL即为插田泡花色苷提取液。
1.3.2.2 花色苷含量的测定及计算方法(pH示差法)
参照红树莓、蓝莓、黑加仑花色苷[9,14-15]测定方法,稍做改动。准确吸取滤液2 mL与6 mL盐酸缓冲液(pH 1.0)混合,摇匀;再准确吸取滤液2 mL与6 mL醋酸缓冲液(pH 4.5)混合,摇匀。分别用相应的缓冲液为空白对照,于最大吸收波长处测吸光度,按照公式(1)计算花色苷含量:

式中:X为插田泡花色苷含量/(mg/100 g);ΔT为ApH1和ApH4.5的吸光度差值;V为插田泡花色苷提取液的总体积/mL;F为稀释倍数;M为矢车菊素-3-葡萄糖苷的摩尔质量,449 g/mol;ε为矢车菊素-3-葡萄糖苷的摩尔消光系数,29 600 L/(mol·cm);m为样品质量/g;b为比色皿厚度,1 cm。
1.3.3 单因素试验
按1.3.2节方法,在其他条件固定的情况下,分别研究酸化乙醇(体积分数55%、65%、75%、85%、95%)、料液比(1∶10、1∶20、1∶30、1∶40、1∶50)、振荡温度(30、40、50、60、70 ℃)、振荡时间(0.5、1.0、1.5、2.0、2.5 h)、酸化乙醇pH值(pH 1、2、3、4、5)5 个单因素对插田泡果实花色苷含量的影响。
1.3.4 正交试验
依据乙醇体积分数、料液比、振荡温度、振荡时间、酸化乙醇pH值5 个影响因素的单因素试验结果设计正交试验(表1),以确定花色苷提取的最佳条件,样品同样条件下提取2 次。
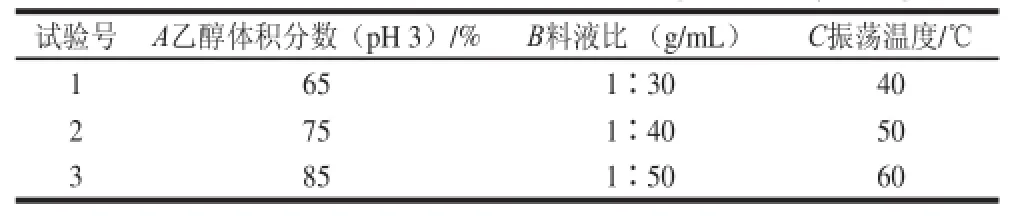
表1 正交试验因素水平表Table1 Factors and levels use d in orthogonal array design
1.3.5 花色苷提取液抗氧化活性
1.3.5.1 ABTS溶液配制
试剂一:准确称取0.096 0 g ABTS,用蒸馏水定容至25 mL容量瓶,浓度为7 mmol/L;试剂二:准确称取0.378 4g K2S2O8,用蒸馏水定容至10 mL容量瓶,浓度为140 mmol/L。
准确移取5 mL试剂 一至10 mL容量瓶中,加入88 μL试剂二,混匀,避光过夜12~16 h之内测定,该溶液即为ABTS储备液。在测定时间内移取一定体积的ABTS储备液,用体积分数75%乙醇溶液稀释100 倍,在732 nm波长处测吸光度在(0.7±0.2)范围内。按上述1∶100的比例配制ABTS溶液即可用于抗氧化活性测定。
1.3.5.2 ABTS+·清除率的测定
参照尹震花等[11]对黑莓果实ABTS+·清除率测定的方法,并稍做改动。分别准确吸取正交试验8号样品溶液0、10、20、30、40、50、60、70、80、90、100、110、120、130、140、150 μL于10 mL比色管中,用体积分数75%乙醇迅速定容至0.5 mL,分别加入2.5 mL ABTS溶液,振摇10 s以上,避光静置10 min,用体积分数75%乙醇作空白对照,于742 nm波长测吸光度,采用公式(2)计算清除率:

式中:A0为空白对照吸光度;A样为样品吸光度。
1.3.5.3 DPPH自由基清除率的测定
参照王振斌等[16]对蜂巢DPPH自由基清除率测定的方法,并稍做改动。分别准确吸取正交试验8号样品溶液0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0 mL于10 mL比色管中,用体积分数75%乙醇溶液定容至4 mL,振荡摇匀,分别 加入4 mL 0.3 mmol/L的DPPH溶液,振荡摇匀,空白对照为体积分数75%乙醇,常温避光反应1 h后于523 nm波长处测吸光度,采用公式(3)计算清除率:

式中:A0为空白对照吸光度,A样为样品吸光度。
1.3.5.4 羟自由基(·OH)清除率的测定
参照包玉敏等[17]对蒙药材中·OH清除率测定的方法,并稍做改动。取17 支10 mL比色管,分别加入0.20 mL 7.5 mmol/L邻二氮菲、0.20 mL 7.5 mmol/L硫酸亚铁铵溶液,1.00 mL Tris-HCl(pH 7.47)缓冲溶液;在2~17号比色管中加1.00 mL 7.5 mmol/L过氧化氢;在3~17号比色管中分别加入正交试验8号样品溶液0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4、1.5 mL;用蒸馏水定容至刻度,在37 ℃水浴中反应1 h,冷水冷却,以蒸馏水为参比,在508 nm波长处测吸光度,采用公式(4)计算清除率。

式中:A样品为加入样品溶液吸光度;A未损为未加H2O2体系吸光度;A损为加入H2O2体系吸光度。
1.3.5.5 半数清除率
根据抗氧化剂的不同质量浓度和清除率求出一元线性方程及相关系数,计算清除率为50%时所需抗氧化剂的质量浓度,即为半数清除率(half elimination ratio,IC50)值。
2 结果与分析
2.1 最大吸收波长的测定
由图1可知,插田泡花色苷在515 nm波长处有最大吸收,因此单因素试验及正交试验都在此波长条件下测定花色苷吸光度。

图1 插田泡花色苷扫描图Fig.1 Scanning spectrum of Rubus coreanus Maq. anthocyanins
2.2 单因素试验
2.2.1 乙醇体积分数对提取效果的影响

图2 乙醇体积分数对提取效果的影响Fig.2 Effect of ethanol concentration on the extraction yield of anthocyanins
如图2所示,随着乙醇体积分数增加,花色苷提取量逐渐增大,当乙醇体积分数大于85%时,提取量降低,这与贾娜[15]、Patil[18]、Vatai[[19]等的研究结果相似,可能是由于增加有机溶剂体积分数降低了亲水性花色苷的提取率,导致总花色苷提取量降低。为提高花色苷的提取量并节约试剂成本,选用体积分数65%、75%、85%乙醇作为水平条件。
2.2.2 料液比对提取效果的影响

图3 料液比对提取效果的影响Fig.3 Effect of solid-to-liquid ratio on the extraction yield of anthocyanins
如图3所示,随着提取液用量的增大,花色苷提取量相应增加,当料液比为1∶40时提取量达到最大,之后,提取量降低。这是由于料液比1∶40时,插田泡花色苷已提取完全。此外,料液比1∶30、1∶40时提取量相差不大。考虑花色苷的提取量,因此选择料液比1∶30、1∶40、1∶50作为水平条件。
2.2.3 振荡温度对提取效果的影响

图4 振荡温度对提取效果的影响Fig.4 Effect of extraction temperature on the extraction yield of anthocyanins
如图4所示,花色苷提取量在30~50 ℃之间随温度升高而逐渐增大,振荡温度超过50 ℃时花色苷的提取量开始下降,这可能是由于50 ℃以上部分花色苷分解损失而导致提取量下降。因此,选择振荡温度40、50、60 ℃作为水平条件。
2.2.4 振荡时间对提取效果的影响

图5 振荡时间对提取效果的影响Fig.5 Effect of extraction time on the extraction yield of anthocyanins
如图5所示,振荡时间达到1 h时花色苷提取量最高,提取量随振荡时间延长先增大后减小,可能由于花色苷类物质长时间暴露在外,导致被氧化破坏。考虑提取量随时间变化的曲线起伏较平缓,为提高效率及缩短提取周期,最终选择1 h作为正交试验的振荡时间。
2.2.5 酸化乙醇pH值对提取效果的影响

图6 乙醇pH值对提取效果的影响Fig.6 Effect of ethanol with different acidities on the extraction yield of anthocyanins
如图6所示,花色苷提取量随酸化乙醇pH值的增大而增加,当pH 3时,提取量最大,之后提取量随pH值的增大而下降,说明适宜酸度对花色苷类物质有保护作用,酸度过高或过低都将导致花色苷稳定性降低。有学者认为根本原因是酸度过高(如pH 1)花色苷易发生水解反应,酸度过低(如pH 4.5)利于花色苷降解,以脱水假碱形式存在[20]。考虑花色苷的稳定性及提取量,选择酸度pH 3作为正交试验乙醇溶液的酸度。
2.3 正交试验
根据以上单因素试验结果,选择乙醇体积分数、料液比、振荡温度为考察因素,设计正交试验表,结果见表2、3。

表2 插田泡花色苷提取正交试验设计及结果Table2 Arrangement and experimental results of orthogonal array design

表3 正交试验方差分析结果Table3 Analysis of variance for the orthogonal array design results
由表2可知,各因素极差顺序大小为RC>RA>RB,影响插田泡果实花色苷提取率的主次顺序为振荡温度(C)>乙醇体积分数(A)>料液比(B);由A因素k3>k2>k1、B因素k1>k3>k2、C因素k2>k1>k3,可知插田泡花色苷提取的最佳条件为:A3B1C2,即乙醇体积分数85%、料液比1∶30、振荡温度50 ℃,此最佳提取条件未出现于表2中。对最佳提取条件A3B1C2进行验证实验,得到花色苷含量为211.05 mg/100 g,略高于正交试验最高含量209.01 mg/100 g。由表3方差分析可知,3 个因素对花色苷提取率的影响差异不显著。
2.4 插田泡花色苷提取物抗氧化活性
2.4.1 对ABTS+·的清除作用
由表4可知,插田泡花色苷对ABTS+·的清除能力(IC50=2.27 μg/mL)均强于阳性对照VC(IC50=12.11 μg/mL)和BHT(IC50=15.01 μg/mL)。由图7可知,随着插田泡花色苷、VC、BHT质量浓度的增加,对ABTS+·的清除率随之增大,清除率与质量浓度均呈正效关系,其中花色苷的清除效果尤为显著。当花色苷、VC、BHT质量浓度分别为4.280、21.134、26.443 μg/mL时,清除率分别达到90.17%、82.70%、92.04%,再增加质量浓度,清除率变化不大,说明对ABTS+·的清除率达到饱和。同等质量浓度条件下,花色苷对ABTS抑制作用远大于VC和BHT。质量浓度低于25 μg/mL时抑制ABTS+·的能力大小为:花色苷>VC>BHT。经统计分析,花色苷、VC、BHT清除率与质量浓度的回归方程分别为:Y=15.601 6X+14.647 3(r=0.948 4)、Y=3.214 2X+11.081 1(r=0.939 9)、Y=3.016 9 X+4.702 5(r =0.974 2),均呈线性相关。

表4 花色苷、VC、BHT的IICC50值Table4 IC50 values of anthocyanins from Rubus coreanus Maq., VC and BHT

图7 花色苷、VC、BHT对ABBTTSS+·的清除作用Fig.7 ABTS radical scavenging activity of anthocyanins from Rubus coreanus Maq., VC and BHT
2.4.2 对DPPH自由基的清除作用
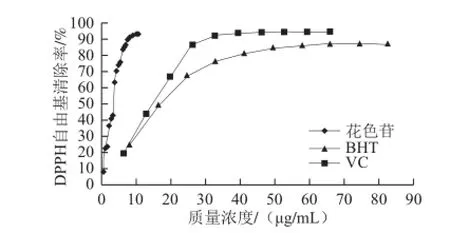
图8 花色苷、VC、BHT对DPPH自由基的清除作用Fig.8 DPPH radical scavenging activity of anthocyanins from Rubus coreanus Maq., VC and BHT
由表4可知,插田泡花色苷对DPPH自由基的清除能力(IC50=3.44 μg/mL)均强于阳性对照VC(IC50=10.78 μg/mL)和BHT(IC50=12.51 μg/mL)。由图8可知,插田泡花色苷、VC、BHT具有非常强的清除DPPH自由基的能力,清除能力均随质量浓度增大而快速增强,呈正效关系。花色苷的清除效果尤为显著。当花色苷、VC、BHT质量浓度分别为:8.560、46.232、57.845 μg/mL时,清除率分别达到92.25%、94.28%、86.20%,再增加质量浓度,清除率变化微小,对DPPH自由基的抑制能力达到饱和。同等质量浓度条件下,花色苷的清除能力远高于VC和BHT。质量浓度高于8.264 μg/mL时清除能力大小为花色苷>VC>BHT。花色苷、VC、BHT清除率与质量浓度的回归方程分别为:Y=8.247 6X+21.659 6(r =0.928 4)、Y=1.096 0X+38.187 7(r =0.826 6)、Y=0.699 5X+41.251 4(r =0.841 4),均呈线性相关。
2.4.3 对·OH的清除作用

图9 花色苷、VC、BHT对·OH的清除作用Fig.9 Hydroxyl radical scavenging activity of anthocyanins from Rubus coreanus Maq., VC and BHT
由表4可知,插田泡花色苷对·OH的清除能力(IC50=1.71 μg/mL)远强于阳性对照VC(IC50= 32.36 μg/mL)和BHT(IC50=48.15 μg/mL)。由图9可知,插田泡花色苷具有非常强的清除·OH能力,在质量浓度为2.568 μg/mL时清除率达91.93%,在质量浓度为3.210 μg/mL时清除率高达98.14%,清除能力随质量浓度增大而迅速增强。VC、BHT对·OH也具有较高的清除率,均呈正效关系。相同质量浓度条件下,花色苷对·OH的抑制能力远大于阳性对照VC、BHT。在质量浓度为24.791 μg/mL时,BHT对·OH的清除率为-1.70%;质量浓度增至65 μg/mL,BHT和VC的清除率达到一致;质量浓度增至68 μg/mL,BHT的清除率达到100%。花色苷、VC、BHT清除率与质量浓度的回归方程分别为:Y=35.471 7X-10.624 1(r=0.985 0)、Y=1.140 5X+13.095 2(r =0.982 9)、Y=2.099 6X-51.095 8(r=0.979 0),均呈线性相关。
3 结 论
经正交试验优化可得乙醇振荡提取插田泡果实花色苷的最佳提取条件是:体积分数85%乙醇溶液(pH3)、料液比1∶30(g/mL)、振荡温度50 ℃,振荡时间1 h,同样条件下样品再重复提取1次。在此条件下,插田泡花色苷提取量为211.05 mg/100 g。
抗氧化实验表明:插田泡果实花色苷对ABTS+·、DPPH自由基和·OH均有很强的清除作用。当质量浓度为4.280 μg/mL时对ABTS+·的清除率达90.17%,当质量浓度为8.025 μg/mL时对DPPH自由基的清除率达90.74%,当质量浓度为2.568 μg/mL时对DPPH自由基的清除率达91.93%。花色苷对3 种自由基的清除能力大小为·OH(IC50=1.71 μg/mL)>ABTS+·(IC50=2.27 μg/mL)>DPPH自由基(IC50=3.44 μg/mL),均远高于阳性对照VC和BHT,原因可能与插田泡中花色苷的结构及乙醇提取液中复杂的其他化合物有关。插田泡果实中具体抗氧化活性成分种类、结构及作用机理还有待深入研究。
[1] 王芳. 福建插田泡果肉营养成分分析[J]. 安徽农业科学, 2009, 37(36): 17944-17945.
[2] LIM J W, JEONG J T, SHIN C S. Component analysis and sensory evaluation of Korean black raspberry (Rubus coreanus Mique) wines[J]. International Journal of Food Science & Technology, 2012, 47(5): 918-926.
[3] OHTANI K, MIyAJIMA C, TAKAHASI T, et al. A dimeric triterpeneglycoside from Rubus coreanus[J]. Phytochemistry, 1990, 29(10): 3275.
[4] WOONG L J, JOO H H, SOO S C. Polyphenol compounds and antiinflammatory activities of Korean black raspberry (Rubus coreanus Miquel) wines produced from juice supplemented with pulp and seed[J]. Journal of Agricultural and Food Chemistry, 2012, 60(20): 5121-5127.
[5] SEO Y C, CHOI W Y, KIM J S, et al. Effect of ultra high pressure processing on immuno-modulatory activities of the fruits of Rubus coreanus Miquel[J]. Innovative Food Science and Emerging Technologies , 2011, 12(3): 207-215.
[6] 刘岱琳, 林纪伟, 张静泽, 等. 天然植物中花色苷的研究应用现状[J].食品研究与开发, 2010, 31(9): 240-244.
[7] 林晓霞, 朱寿民. 中药花色素类成分抗癌研究进展[J]. 中国中药杂志, 2005, 30(15): 1147-1150.
[8] CASTANEDA-OVANDO A, PACHECO-HERNANDEZ M D, PAEZ-HERNANDEZ M E, et al. Chemical studies of anthocyanins: a review[J]. Food Chemistry, 2009, 113(4): 859-871.
[9] 肖军霞, 黄国清, 仇宏伟, 等. 红树莓花色苷的提取及抗氧化活性研究[J]. 食品科学, 2011, 32(8): 15-18 .
[10] 陈亮, 辛秀兰, 王彦辉, 等. 红树莓花色苷含量测定及成分分析[J].食品与发酵工业, 2011, 37(5): 166-169.
[11] 尹震花, 王佳佳, 顾海鹏, 等. 黑莓 (萨尼) 果实体外抗 氧化活性研究[J].天然产物研究与开发, 2013, 25(4): 530-532.
[12] 王睿婷, 王鑫, 张富敏, 等. 树莓的抗氧化活性与主要化学成分的相关分析[J]. 沈阳药科大学学报, 2013, 30(11): 901-905.
[13] 陈斌, 于华忠, 谷伏安. 灰白毛莓红色素的开发研究[J]. 中国野生植物资源, 1997, 16(4): 1-5.
[14] BUCKOW R, KASTELL A, TEREFE N S, et al. Pressure and temperature effects on degradation kinetics and storage stability of total anthocyanins in blueberry juice[J]. Journal of Agricultural and Food Chemistry, 2010, 58(18):10076-10084.
[15] 贾娜, 孔保华, 张洪涛. 黑加仑花色苷的提取及抗氧化活性研究[J].食品科学, 2011, 32(16): 162-166.
[16] 王振斌, 孙平, 王林, 等. 蜂巢醋液态发酵工艺及其抗氧化活性研究[J].食品工业科技, 2012, 33(16): 236-239.
[17] 包玉敏, 康大伟, 张力, 等. 蒙药材悬钩子木中黄酮类化合物含量测定及体外抗氧化性研究[J]. 内蒙古民族大学学报: 自然科学版, 2011, 26(1): 14-15; 20.
[18] PATIL G, MADHUSUDHAN M C, BABU B R, et al. Extraction, dealcoholization and concentration of anthocyanin from red radish[J]. Chemical Engineering and Processing: Process Intensification, 2009, 48(1): 364-3 69.
[19] VATAI T, SKERGET M, KNEZ Z, et al. Extraction and formulation of anthocyanin-concentrates from grape residues[J]. Journal of Supercritical Fluids, 2008, 45(1): 32-36.
[21] 方忠祥, 倪元颖, 唐建成. 紫肉甘薯中花色苷热降解动力学研究[J].食品工业科技, 2004, 25(3): 111-113.
Mechanical Shaking Extraction and Antioxidant Activity of Anthocyanins from Rubus coreanus Maq. Fruits
JIANG Hua-mei1, SHI Deng-hong2, WANG Xiang-qian3, GOU Xian-mei1, YIN Liang-ping1, YANG Guang-qin1
(1. College of Chemistry and Material Engineering, Guiyang University, Guiyang 550005, China; 2. College of Biological and Environmental Engineering, Guiyang University, Guiyang 550005, China; 3. Library of Guiyang University, Guiyang 550005, China)
Mechanical shaking extraction with ethanol was applied to extract anthocyanins from the fruits of Rubus coreanus Maq., and the optimal extraction conditions were determined by orthogonal array design. An extraction temperature of 50 ℃and 1 h extraction repeated twice using a 30-fold volume of 85% ethanol aqueous solution containing hydrochloric acid (pH 3) as the extraction solvent provided optimum extraction of anthocyanins. An anthocyanin yield of 2 11.05 mg/100 g was achieved. In addi tion, the ant hocyanins from fres h fruits of Rubus coreanus Maq. were evaluated f or their antioxidant activity. It was found that the anthocyanins displayed dose-dependent reducing power and strong abilities to scavenge hydroxyl, 1,1-diphenyl-2-picrylhydrazyl (DPPH) and 2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphonate) (ABTS) free radicals in decreasing order with linear concentration dependence in the concentration range investi gated here. The IC50values for hydroxyl, DPPH and ABTS free radicals were 1.71, 2.27 and 3.44 μg/mL, respecti vely, indicating much higher free radical scavenging activity than VC and BHT as positive controls. The se r esults demonstrate that anthocyanins from Rubus coreanus Maq. possess potent antioxidant activity and thus deserve to be used as natural antioxidants and functional foods.
Rubus coreanus Maq.; anthocyanins; mechanical shaking extraction; antioxidant activity
O623.54;O629.9
A
1002-6630(2014)20-0067-06
10.7506/spkx1002-6630-201420014
2014-02-06
贵州省科技厅、贵阳学院联合基金项目(黔科合J字LKG[2013]13号);贵州省教育厅2013年教学内容和课程体系改革重点项目(黔教高发[2013]446号);贵州省科技厅、贵阳学院联合基金项目(黔科合J字LKG[2013]04号);贵阳学院院级科研项目(201207)
蒋华梅(1976—),女,副教授,硕士,研究方向为天然产物化学。E-mail:857346695@qq.com
