乳佐剂免疫机制的研究进展
2014-01-03赵兰华李映波
赵兰华 李映波
乳剂(emulsion)是主要由水相、油相、乳化剂和助乳化剂组成的透明液体。国内外对乳佐剂已有广泛研究,包括物理性质、稳定性、佐剂效果和安全性。乳佐剂的广阔应用前景促使科研工作者深入研究其增强免疫的机制,以期为新产品开发,标准质控及临床应用提供可靠的依据。
一、乳佐剂的研究现状
目前乳佐剂主要用于流感、利什曼病、疟疾等严重疫情的储备佐剂。其中水包油型乳佐剂MF-59TM,已被30多个国家用于季节性三价灭活流感疫苗,为继铝佐剂之后被批准的人用佐剂之一;AS03已达到欧盟认证,批准用于人体;利什曼病疫苗LEISH-F3+GLA-SEⅠ期临床试验已在华盛顿和印度启动,现有主要乳佐剂见表1。
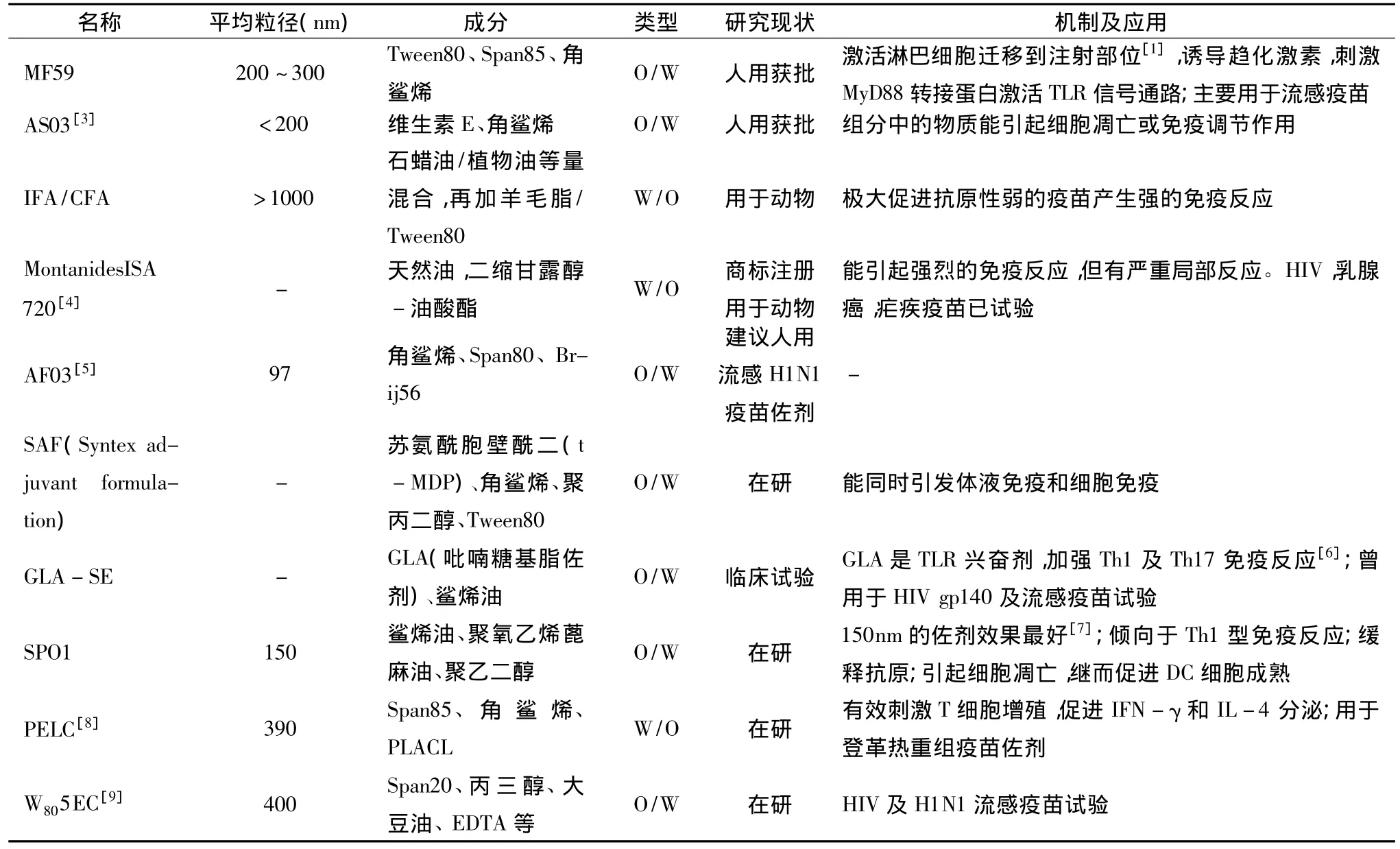
表1 现有主要佐剂
二、乳佐剂的特征及优势
粒径大小是微观颗粒的最重要性质和评价指标之一。依据纳米概念的定义,严格意义上将粒径10~100nm的乳剂称为纳米乳(nano-emulsion),粒径100~1000nm的称为微乳(micro-emulsion)。颗粒的胞内运输方式具有显著的粒径依赖性,较小粒径的颗粒在作为疫苗佐剂时更具有潜在的优势。最新获欧盟药品管理局认可的HumenzaTM流感H1N1型O/W佐剂AF03由赛诺菲巴斯德公司生产,粒径小于100nm,可通过 0.2μm 的滤膜,为纳米乳佐剂[5]。而有研究将一些粒径在100~1000nm范围内的乳剂也称为纳米乳,如Hamouda将平均粒径400nm的乳佐剂 W805EC 称为纳米乳[9]。Makidon 等[10]将一种平均粒径479nm的O/W型乳佐剂称为纳米乳nano-emulsion。这样容易混淆概念,这两个粒径范围的乳剂应该加以严格区分。乳佐剂一般具有以下特征。
1.均匀性好,运载并保护抗原:乳佐剂均匀性好,能有效包裹或吸附抗原。口服接种能提高抗原在胃肠道中的稳定性,保护抗原免受蛋白酶降解;鼻腔免疫时能加强抗原迁移[11]。Shahiwala等发现一种由角鲨烯,Tween80,Span80组成的 W/O/W乳剂,口服比鼻腔免疫抗体水平更高,提示乳佐剂在不同免疫部位中的作用机制,可能与保护抗原免受降解有关。
2.增加抗原表面积及大小,改变免疫应答的类型:目前,乳佐剂作为佐剂的最佳粒径大小仍存争议。普遍认为,佐剂颗粒的大小影响免疫反应的类型。Kanchan和Panda发现200~600nm大小的颗粒容易通过淋巴结利用抗原递呈细胞(antigen presenting cells,APCs)激发Th1型细胞免疫反应,而2~8μm的颗粒则是由巨噬细胞的吞噬或胞饮作用运输至淋巴结,激发体液免疫。Yu等[7]在研究SPO1微乳佐剂时发现150nm的颗粒佐剂效果最好,认为该种粒子既能有效吸附抗原又能激发吞噬细胞的识别,而100nm以下的颗粒不能捕获抗原,200nm以上则不稳定或不引发理想的免疫应答。Oyewumi等[12]甚至提出将500nm作为一个分水岭,因为500nm以上和小于500nm的粒子激发完全不同的免疫反应。乳佐剂虽然大小分布相对均匀,但其粒径仍是一个范围,以现阶段的研究资料,要提出一个完全精确区分佐剂效果的界值相对还很难。
3.缓释抗原:Kim等口服免疫牛后发现,大于5μm的颗粒聚集于派氏集合淋巴结,缓慢迁移至淋巴输出管,小于5μm的颗粒则释放至淋巴器官,散布于淋巴系统各处,由此认为乳佐剂能延长抗原或多肽的半衰期,使抗原与淋巴系统有充分的接触时间,产生持久免疫应答。Yu等[7]用体内成像技术观察SPO1包裹H1N1疫苗鼻腔免疫后追踪疫苗的分散速度,发现单独疫苗组12h疫苗已分布于小鼠全身各处淋巴结,24h后已基本被全部吸收,而SPO1包裹疫苗组则24h后才观察到大量分布于腹股沟淋巴结,由此证明了SPO1微乳佐剂缓释抗原的作用。然而缓释抗原与免疫增强或持久应答是否有关并无研究论证。最近,Yang等[13]的研究认为乳佐剂颗粒的分散性并不是抗原分散和缓释的直接原因,且抗原的的缓释或乳佐剂分散类型与其增强免疫原性是无关联的。
4.稳定性好:乳佐剂是透明液体,物理稳定性好且易过滤,经热压灭菌或离心不分层,易于制备和保存,适合大规模生产。Fox等[14]用不同油相制备的乳剂室温下粒径约为100nm,放置6个月粒径基本不变,若放在37℃或60℃环境中粒径随保存时间增大,因此乳佐剂的稳定性并非绝对,有相对稳定的保质条件和保质期。
三、乳佐剂增强免疫的机制
机体免疫系统分为2个部分:天然免疫(natural immunity)和适应性免疫(adaptive immunity)。天然免疫是保护人类或动物免受病原体侵害的第一道屏障。适应性免疫主要由抗原特异性的T、B淋巴细胞及其抗体分子所组成。20世纪80年代以来,科学家陆续发现某些矿物盐或水包油乳剂能诱导巨噬细胞或树突状细胞(dendritic cells,DCs)产生趋化因子,于注射部位募集淋巴细胞,引起单核细胞的分化及巨噬细胞的激活,增强抗原递呈作用,表明乳佐剂能从天然免疫和适应性免疫两方面促进机体自我保护,主要表现在以下几个方面:
1.诱导产生高水平的抗体:抗体是B淋巴细胞产生对机体最直接的保护力。B细胞受抗原刺激后,分化为浆细胞,产生大量特异性抗体,后者通过多种方式介导体液免疫应答,如产生中和作用、调理作用、激活补体、介导ADCC作用等。Baldwin等[15]研制了一种由角鲨烯、甘油、卵磷脂,普朗尼克F68组成的O/W型纳米乳佐剂SE(平均粒径95nm)及一种类似MF59的微乳佐剂(平均粒径125~150nm)作为IPV佐剂产生了理想的中和抗体水平。Leclercq等[16]设计的由Span80、IPM、1、2-丙二醇组成的纳米乳佐剂(平均粒径22.64nm)混合狂犬疫苗产生的比铝佐剂高但比弗氏佐剂低的IgG抗体水平,ED50检测时发现这种乳佐剂能产生比铝佐剂和弗氏佐剂更强的血清保护力。有资料证明抗体水平可能与乳佐剂改变抗原表面积和免疫应答类型有关,也可能与乳佐剂中某些成分有关。Fox等[14]发现鲨烯油相比其他油相更易刺激浆细胞的成熟及抗体水平的升高,因此认为此乳佐剂配方倾向于鲨烯油或甘油三辛酸酯等更利于刺激抗体产生的油相。此前Asa等提出鲨烯油佐剂能增强疫苗免疫阳性率,提高抗体水平。AS03中的维生素E具有免疫调节作用,因此,乳佐剂的效果不仅与其物理性质有关,也可能与某些组分的免疫调节作用有关。
2.促进DC细胞分化成熟及抗原递呈:DC细胞是天然免疫与获得性免疫间的一座桥梁,既能非特异识别和递呈抗原,又能分泌大量细胞因子。MF59乳佐剂能加速细胞分化成DC细胞,成熟的DC细胞提供T细胞发育的理想环境,因为其分泌的炎性或抗炎性因子的平衡决定Th细胞的发育类型,所以在某种程度上DC细胞能决定初始T细胞的发育的数量和表型;乳佐剂 SPO1能上调 MHCⅡ,共刺激分子CD80、CD86等表达,由此表明其促进 DC细胞成熟[7]。这种促进作用在破伤风、狂犬病、HBV、HAV疫苗中也表现出比铝佐剂更强的佐剂效果,另外,Yang等认为乳佐剂中含有的表面活性剂如Tween及Span等能不同程度诱导细胞凋亡,且细胞凋亡水平越高的佐剂效果越好。原因在于凋亡细胞导致外源性抗原的交叉致敏,同时危险信号引发局部炎症和DC细胞成熟。而Makidon等[10]则在这种凋亡机制研究中首次发现乳佐剂鼻腔免疫能引发钙网蛋白相关的上皮细胞凋亡,从而在黏膜组织中引发广泛的细胞因子和趋化因子反应。因此,乳佐剂能在某种程度上决定淋巴细胞的发育类型,并通过钙网蛋白相关信号通路引发细胞凋亡,进一步触发细胞因子及趋化因子的分泌及交叉致敏反应。
抗原递呈细胞(antigen presenting cells,APCs)是指能摄取和在细胞内加工处理抗原,并将抗原信息递呈给T淋巴细胞的细胞,DC是目前发现的抗原递呈功能最强的APC。乳佐剂包裹的抗原颗粒以其微粒性质,成为巨噬细胞和 DC的首选吞噬目标[17]。Yang等[13]发现GLA-SE作为一种优良的皮下免疫佐剂候选物,能加强胰岛细胞中CD1a+/langerin+的迁移,刺激皮肤DC细胞功能,促进抗原递呈。典型的乳佐剂MF59由Tween 80,Span85和角鲨烯乳剂组成,是一种O/W型乳佐剂(平均粒径<250nm),通过激活肌肉组织中的单核细胞、巨噬细胞,DC细胞,诱导趋化激素,导致免疫细胞迁移到注射部位,信号放大后吞噬细胞流入,抗原被递呈到淋巴结。最近,Seubert等[18]的研究更深入阐释了MF59的佐剂作用是由于MyD88转接蛋白的作用激活TLR信号通路,与Nlpr3炎性小体无关,解释了其与铝佐剂不同的免疫增强机制[19]。
3.介导CD4+T细胞反应,分泌大量细胞因子:CD4+T细胞活化后主要可分化为Th1、Th2,二者之间存在相互制约或促进作用。决定Th1和Th2细胞分化取向的因素有遗传因素、抗原的性质、种类、剂量、免疫途径、细胞膜表面分子等,尤为重要的是抗原递呈水平的微环境。乳佐剂增强免疫的原因可能与增强CD4+T细胞相关反应有关。W/O/W型乳佐剂PELC,由Span 85及鲨烯共聚物组成,肌内注射免疫小鼠可以有效地节省流感疫苗抗原的用量,通过刺激T细胞增殖,促进 IFN-γ和 IL-4分泌。Behzad等[6]将GLA-SE与流感疫苗SVV结合能激活成年人外周血单核细胞 (PBMC),促进TNF-α IL-6 IL-12及INF-γ分泌,抑制IL-10产生,表明GLASE倾向诱导Th1型免疫反应。Daifalla等以利GLA-SE包裹什曼原虫重组蛋白,发现 GLA-SESODB1组比单独SODB1及CpG寡脱氧核苷酸(Cp-GODN)佐剂组INF-γ和IL-10水平均高得多,认为GLA-SE介导了偏向Th1型的免疫反应。Chiang等[8]以登革热病毒D1EDⅢ结构为抗原,IFN-γ和IL-4分泌水平约为铝佐剂组的3倍,单独疫苗组的20倍左右。多数乳佐剂倾向于Th1型免疫反应,并不能完全证明乳佐剂佐剂激发的就是Th1型细胞免疫。在对Montinade ISA720及ISA206的研究中发现,此二者在不同遗传背景的小鼠趋向不同的反应类型,因此乳佐剂引发的免疫反应类型与其粒径大小及实验动物遗传背景有关。
4.增强 CD8+CTL反应:细胞毒作用(cytotoxic effect,CTL)是针对病毒性感染的防御方式,疫苗进入机体后,激活机体能否产生显著的CD8+T细胞反应,是体现疫苗临床保护性的一个重要方面。铝佐剂的一个重要缺陷就是不能激活细胞免疫及CTL反应,而乳佐剂能增强这种反应。成年人流感疫苗效果降低的一个重要原因是裂解病毒无法有效激活CTL反应,而弗氏佐剂及Montinade ISA720乳佐剂则均被证明能诱导CTL作用。Behzad等[6]发现乳佐剂GLASE包裹流感疫苗增加骨髓树突状细胞的比例,刺激颗粒酶B分泌,表明该乳佐剂疫苗增强CD8+CTL反应。另一方面,由于DC细胞能影响T细胞发育,乳佐剂刺激DC细胞的成熟相应也能增强CD8+的CTL效应。
四、问题与展望
乳剂作为载药系统已引起广泛关注并有所应用,但作为疫苗佐剂仍需深入研究。世界范围内的传染性疾病暴发从未停止,亟待疫苗及佐剂研究的突破。目前,乳佐剂的研究已逐渐深入,并取得了大量基础资料。其增强免疫主要是基于纳米颗粒的性质和激发机体免疫应答。乳佐剂的均匀稳定性及合适的颗粒大小能保护并缓释抗原,并因颗粒大小的不同引发不同型的免疫反应,但是缓释抗原与免疫增强的具体关联并无确切阐述。免疫系统的应答则是由于乳佐剂包裹疫苗刺激淋巴细胞分化发育,加快抗原递呈的效率,引发抗体、细胞因子的分泌及ADCC、CTL作用等,这些机制的阐述为其临床应用提供了依据,但是人体免疫系统应答复杂,乳佐剂在分子水平上系统全面的研究资料甚少。
另外,乳佐剂用于人体还存在许多问题,首先大多数乳佐剂配方实验研究只在动物体内试验,极少进入临床试验,即使是MF59也因为使用的角鲨烯具有抗原性而引起注射部位肿胀坏死等现象,长期使用可能造成肝损伤。其次,目前应用或研究较深入的几种乳佐剂均加入了免疫增强剂、TLR兴奋剂、或者促进免疫的中药成分,使乳佐剂的成分复杂,不易控制质量,使其离应用还有一定距离[20]。加之各个实验室对乳佐剂配方阐述模糊,因此重复性不能得到保证。弊端存在的同时是机遇,怎样克服这些研究壁垒成为科学家们亟待解决的难题。
1 O'Hagan DT,Ott GS,Nest GV,et al.The history of MF59?adjuvant:a phoenix that arose from the ashes[J].Expert Rev Vaccines,2013,12(1):13-30
2 He B,Santamaria R,Xu W,et al.The transmembrane activator TACI triggers immunoglobulin class switching by activating B cells through the adaptor MyD88[J].Nature Immunology,2010,11(9):836 -845
3 Morel S,Didierlaurent A,Bourguignon P,et al.Adjuvant System AS03 containing alpha-tocopherol modulates innate immune response and leads to improved adaptive immunity[J].Vaccine,2011,29(13):2461-2473
4 Saul A,Lawrence G,et al.A human phase 1 vaccine clinical trial of the Plasmodium falciparum malaria vaccine candidate apical membrane antigen 1 in montanide ISA720 adjuvant[J],2005,23:3076 -3083
5 Klucker MF,Dalencon F,Probeck,et al.AF03,an alternative squalene emulsion-based vaccine adjuvant prepared by a phase inversion temperature method[J].Journal of Pharmaceutical Sciences,2012,101(12):4490-4500
6 Behzad H,Huckriede AL,Haynes L,et al.GLA - SE,a synthetic toll-like receptor 4 agonist,enhances T-cell responses to influenza vaccine in older adults[J].Journal of Infectious Diseases,2012,205(3):466-473
7 Yu S,Tang C,Shi X,et al.Novel Th1 - biased adjuvant,SPO1,enhances mucosal and systemic immunogenicity of vaccines administered intranasally in mice[J].Vaccine,2012,30:5425 -5436
8 Chiang CY,Huang MH,Hsieh CH,et al.Dengue-1 envelope protein domain III along with PELC and CpG oligodeoxynucleotides synergistically enhances immune responses[J].PLoS Neglected Tropical Diseases,2012,6(5):e 1645(1 -10)
9 Hamouda T.Efficacy,immunogenicity and stability of a novel intranasal nanoemulsion-adjuvanted influenza vaccine in a murine model[J].Human Vaccine,2010,6(7):585 -594
10 Makidon PE,Belyakov IM,Blanco LP,et al.Nanoemulsion mucosal adjuvant uniquely activates cytokine production by nasal ciliated epithelium and induces dendritic cell trafficking[J].European Journal of Immunology,2012,42:2073 -2086
11 Heegaard PM,Dedieu L,Johnson N,et al.Adjuvants and delivery systems in veterinary vaccinology:current state and future developments[J].Archives of Virology,2011,156(2):183 -202
12 Oyewumi MO,Kumar A,Cui Z.Nano-microparticles as immune adjuvants:correlating particle sizes and the resultant immune responses[J].Expert Review of Vaccines,2010,9(9):1095 - 1107
13 Yang YW,Shen SS.Enhanced antigen delivery via cell death induced by the vaccine adjuvants[J].Vaccine,2007,25(45):7763 - 7772
14 Fox CB,Baldwin SL,Duthie MS,et al.Immunomodulatory and physical effects of oil composition in vaccine adjuvant emulsions[J].Vaccine,2011,29:9563 -9572
15 Baldwin SL,Fox CB,Pallansch MA,et al.Increased potency of an inactivated trivalent polio vaccine with oil- in - water emulsions[J].Vaccine,2011,29(51):644 -649
16 Leclercq SY,dos Santos RM,Macedo LB,et al.Evaluation of waterin-oil-in-water multiple emulsion and microemulsion as potential adjuvants for immunization with rabies antigen[J].European Journal of Pharmaceutical Sciences,2011,43(5):378 - 385
17 Black M,Trent A,Tirrell M,et al.Advances in the design and delivery of peptide subunit vaccines with a focus on toll-like receptor agonists[J].Expert Rev Vaccines,2010,9(2):157 - 173
18 Seubert A,Calabro S,Santini L,et al.Adjuvanticity of the oil- in -water emulsion MF59 is independent of Nlrp3 inflammasome but requires the adaptor protein MyD88[J].Proceedings of the National A-cademy of Sciences of the United States of America,2011,108(27):11169-11174
19 Ellebedy AH,Lupfer C,Ghoneim HE,et al.Inflammasome - independent role of the apoptosis-associated speck-like protein containing CARD(ASC)in the adjuvant effect of MF59[J].Proceedings of the National Academy of Sciences of the United States of America,2011,108(7):2927 -2932
20 Fox CB,Huynh C,O'Hara MK,et al.Technology transfer of oil-in-water emulsion adjuvant manufacturing for pandemic influenza vaccine production in Romania[J].Vaccine,2013,31(12):1633 -1640
