荔枝核总皂苷提取工艺优化
2013-11-30,,,
,,,
(南方医科大学中医药学院,广东 广州 510515)
荔枝核总皂苷提取工艺优化
邢学锋,谭伟华,王爱珍,王志威
(南方医科大学中医药学院,广东 广州 510515)
目的:探讨荔枝核总皂苷的最佳提取工艺参数。方法:通过对溶媒和提取方式的筛选,确定最佳溶媒和提取方式,采用L9(34)正交实验法优化各项工艺参数。结果:采用乙醇回流提取,其最佳参数为A2B3C3D2即10倍量50%乙醇回流提取3次,每次2 h,可测定含量为5.51%。以D-101大孔吸附树脂纯化提取液,100 mL 50%乙醇洗脱得率为99.69%,纯度为36.24%。结论:此乙醇回流提取法可行,为实际工业生产和进一步药用研究提供理论参考。
荔枝核;皂苷类;提取法;溶媒
荔枝(LitchichinensisSonn.)是无患子科Aspindaceae荔枝属植物[1]。近年来学者对荔枝核的化学成分及药理作用进行了不少研究。荔枝核的主要化学成分为皂苷、挥发油、有机酸、酯、氨基酸、糖类及微量元素等[2],成分之一皂苷具有降血糖[3]、调血脂[4]等多种药理活性。本研究拟以荔枝核为对象,对荔枝核总皂苷的提取工艺进行优化,为其深加工产品工艺提供理论参考,促进荔枝从单纯的食用水果,转化成高附加值产品和中药制剂。
1 材料与仪器
荔枝核中药饮片(广州至信中药饮片有限公司,生产批号:120201,经南方医科大学药用植物与鉴定教研室马骥教授鉴定),人参皂苷Rg1对照品703-9206(中国药品生物制品检定所),D-101大孔吸附树脂,电子天平P602S-DA,电子微量天平CP324S,紫外可见分光光度计HP-8453,所用试剂均为分析纯。
2 方法
2.1 标准曲线制作与提取溶媒、方式的筛选
2.1.1 标准曲线制作 用电子微量天平精密称取5 mg对照品人参皂苷Rg1,配制成0.5 mg/mL的标准液,分别取20、40、80、160、200、240 μL标准液于小试管中,水浴挥干,加入新配制的5%香草醛-冰醋酸溶液0.2 mL和高氯酸0.8 mL,60 ℃水浴加热15 min,冰水冷却5 min,加入3 mL冰醋酸,摇匀静置10 min,在540 nm波长下测定吸光度。并以标样浓度c(μg/μL)为横坐标,吸光度A为纵坐标,绘制标准曲线。标准曲线回归方程为:A=30.67C+0.005(r=0.997 9),线性范围为10~120 μg。通过精密度、重现性和回收率实验,人参皂苷Rg1检测浓度在0~0.025 μg/μL范围内与吸光度呈良好线性关系。
2.1.2 提取溶媒和方式的筛选 称取荔枝核饮片50.00 g 3分,标记1)、2)、3)作不同处理。1)用水500 mL浸泡1 h,回流提取一次1 h;2)用70%乙醇浸泡1 h,回流提取一次1 h;3)用70%乙醇500 mL浸泡1 h,超声提取一次1 h。旋转蒸发至无醇味,记录浓缩后的体积。取各提取液25 mL,以蒸馏水定容至100 mL,各取40 μL稀释液,按“2.1.1”项操作测定吸光度。结果显示醇提测定的总皂苷含量为2.82%,高于水提的1.81%和超声提取的1.28%。
2.2 提取工艺参数的优化 根据提取溶媒和提取方式筛选的预实验结果,荔枝核总皂苷选用乙醇回流提取,并采用正交实验法优化其提取工艺参数。
2.2.1 L9(34)正交实验 采用L9(34)正交表进行实验,选用影响提取效果的乙醇用量/倍(A)、提取次数/次(B)、提取时间/h(C)和乙醇浓度/%(D)4个试验因素,每个因素设置3水平进行优选设计。实验因素与水平见表1。
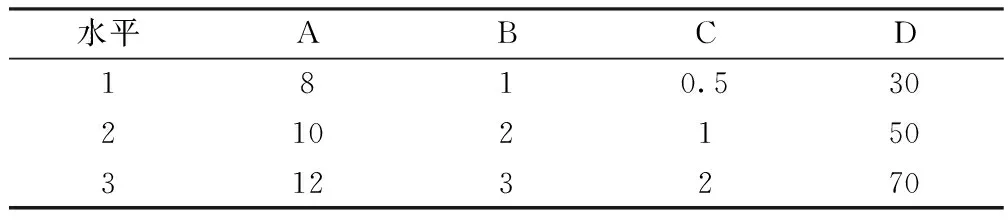
表1 乙醇回流提取的4因素3水平
2.2.2 直观分析 每次实验称取荔枝核饮片50.00 g,按每个实验号的条件加入乙醇浸泡1 h,回流提取,合并提取液,旋转蒸发至无醇味,得到9个提取液样品,记录各自浓缩后的体积。按“2.1.2”项操作测定吸光度,并通过标准曲线回归方程计算各样品总皂苷含量。使用正交设计小助手分析实验数据,得到直观分析表,见表2。各组实验数据RSDlt;5%。

表2 L9(34)正交实验直观分析表
2.2.3 方差分析 见表3。比较F比大小,发现荔枝核总皂苷提取工艺影响因素的顺序为:提取时间gt;提取次数gt;乙醇浓度gt;乙醇用量,其中提取次数(B)、提取时间(C)在α=0.05的检验水平下有差异。根据L9(34)正交效应曲线,得最佳条件为A2B3C3D2,即10倍量50%乙醇回流提取3次,每次2 h。
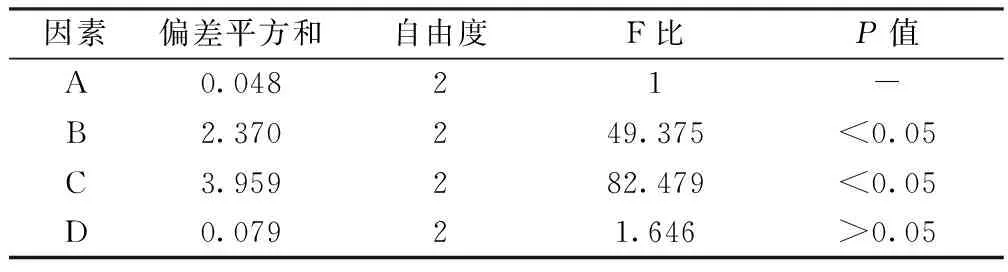
表3 L9(34)正交实验方差分析
注:F0.05,2,2=19.00,F0.01,2,2=99.00。
2.2.4 提取工艺参数的重现性实验 按“2.2.3”项得到的最佳提取工艺参数提取新样品,并按“2.1.2”项操作,测得其吸光度均值为0.353 32,总皂苷含量5.51%,RSD为0.93%,重现性良好。
2.3 荔枝核总皂苷部位纯化
2.3.1 洗脱溶剂和溶剂量的选择 D-101型大孔吸附树脂预处理与装柱后,取“2.2.4”浓缩液20 mL上柱,依次用0%(蒸馏水)、30%、50%、70%、90%乙醇100 mL洗脱。取各洗脱液100 μL,按“2.1.1”项操作测定吸光度。洗脱前收集液在540 nm波长不见峰值,提示提取浓缩液上柱后没有过载,且50%乙醇能将荔枝核中大部分总皂苷洗脱。另取浓缩液20 mL上柱,依次以蒸馏水、50%乙醇200 mL洗脱,每洗脱50 mL收集洗脱液2滴,并按“2.1.1”项操作测定其吸光度峰值。结果显示,用50%乙醇100 mL可将20 mL样品浓缩液中大部分总皂苷洗脱。
2.3.2 最优条件荔枝核提取液洗脱率 取“2.2.4”提取的最佳参数样品2分,1分取25 mL以蒸馏水定容至100 mL,另一分取20 mL直接上柱,并用50%乙醇100 mL洗脱,收集洗脱液。取稀释液和收集的洗脱液各40 μL,按“2.1.1”项操作测定吸光度。计算得总皂苷含量分别为5.51%和5.49%,洗脱率为99.69%。RSDlt;5%。
2.3.3 洗脱液中总皂苷纯度 取一干燥洁净蒸发皿称重m1,“2.2.4”提取的最佳参数样品20 mL上柱,用50%乙醇100 mL洗脱,用蒸发皿收集洗脱液100 mL。干燥后称重m2,得洗脱液中总皂苷纯度为36.24%。
3 结果
荔枝核总皂苷提取工艺采用乙醇回流提取,影响因素顺序为:提取时间gt;提取次数gt;乙醇浓度gt;乙醇用量,最佳条件A2B3C3D2,即10倍量50%乙醇回流提取3次,每次2 h,可测定含量为5.51%。以D-101大孔吸附树脂纯化提取液,100 mL50%乙醇洗脱得率为99.69%,纯度为36.24%。
4 讨论
皂苷类成分是荔枝核活性作用的有效部位之一。根据对照品稳定性、参比物质与测定物质同质性的原则[5],在本研究的前期阶段已选用人参皂苷Rg1作为对照品,通过精密度、重现性和回收率实验,建立荔枝核总皂苷的含量测定方法[6],用于提取工艺优选的定量分析。方欢乐等[7]采用两相溶剂萃取法处理样品,但未计算其纯度。因荔枝核皂苷的苷元部分多为疏水性,能被非极性树脂所吸附。D-101大孔吸附树脂是一种球状、非极性聚合物吸附剂,对皂苷类物质有特殊的选择性。 本研究得出的荔枝核总皂苷提取工艺,仅在实验室条件下进行,主要以比色法测定计算的总皂苷含量为考察指标,为实际工业生产和进一步药用研究提供理论参考,并未考虑操作环节、材料成本、提取周期、能耗等生产要素。
[1]国家药典委员会.中国药典[M].北京:中国医药科技出版社,2010:227.
[2]刘朝霞,钱敏,陈海光.荔枝核的加工研究进展[J].广东农业科学,2011,38(3):87-89.
[3]姜振国,任坤,林?,等.荔枝核降血糖有效部位的研究(一)[J].长春中医药大学学报,2011,27(1):14-16.
[4]朱晓莹,银彩林.荔枝核复方对糖尿病小鼠血糖、血脂影响的实验研究[J].中国当代医药,2012,19(15):5-6.
[5]国家食品药品监督管理局药品审评中心.药品技术评价文集(第3辑)[M].北京:中国医药科技出版社,2009:161-165.
[6]解生旭,徐暾海,韩冬,等.紫外可见分光光度法测定蒺藜果中呋甾总皂苷含量[J].长春中医药大学学报,2008,24(5):495-496.
[7]方欢乐,陈衍斌.荔枝核皂苷含量测定及提取工艺优选研究[J].亚太传统医药,2010,6(3):17-19.
R283.3
A
1007-4813(2013)03-0537-02
邢学锋(1981-),男,讲师。研究方向:中药新药研发及中药复方物质基础。
2013-01-20)
