超高效液相色谱串联质谱法测定水体与底泥中孔雀石绿及隐色孔雀石绿残留
2013-11-28孙言春李池陶杜宁宁曹顶臣牟振波王海涛陈中祥
孙言春,李池陶,杜宁宁,曹顶臣,牟振波*,吴 松,王海涛,陈中祥
(1.中国水产科学研究院 黑龙江水产研究所/农业部水产品质量安全风险评估实验室(哈尔滨),黑龙江 哈尔滨 150070;2.哈尔滨工业大学 理学院,黑龙江 哈尔滨 150001)
孔雀石绿(Malachite green,MG)又名碱性绿、苯胺绿,曾作为一种工业染料广泛用作羊毛、丝绸、皮革等的染色剂[1]。由于MG还具有杀灭真菌、寄生虫等病原微生物的作用,在水产养殖中常用来预防和治疗受精卵和成鱼的水霉病、腮霉病和小瓜虫病等,以及用于活鱼运输、池塘暂养过程和环境的消毒等[2-5]。然而,MG在生物体内有明显蓄积现象且具有高毒、高残留、致癌、致畸、致突变等毒副作用,对生物体的组织、生殖、免疫系统均有影响,尤其是其代谢产物隐色孔雀石绿(Leucomalachite green,LMG)毒性更大[6-12]。因此,包括欧美、中国在内的国家都明令禁止其在水产养殖中的应用[13],以确保消费者健康和水产贸易的对外地位。
虽然MG在水产养殖中的违禁使用情况越来越少,但由于其曾经被广泛应用,已对环境造成了严重污染,尤其是表层沉积物作为MG在环境中的最终归宿,且不断向水体进行缓慢释放,成为其二次污染的主要来源[5,14-15]。因此,评估表层沉积物和水体中的MG及其代谢物残留状况,建立相应的分析方法,对于水产品中MG污染来源的排查具有积极的意义。
目前,针对水体、底泥等环境中的痕量MG及其代谢物的检测方法相对较少,且主要采用灵敏度较低的液相色谱法[16-19]。由于底泥等沉积物的成份复杂,各种杂质多,对分析干扰大,高效液相色谱对样品的净化要求较高,整个操作步骤繁琐、耗时长,不利于准确定性和定量分析。而高效液相色谱串联质谱法由于灵敏度高、专属性强,因此在MG药物残留检测上获得了广泛的应用[20-23]。已有研究采用高效液相色谱串联质谱法测定了水或底泥中MG和隐色LMG残留[24-26],但其前处理方法较繁琐,不适合大批量样品的检测需要。
本研究充分利用高效液相色谱串联质谱灵敏度高、专属性强的优点,对水体及表层沉积物中的MG及其代谢物进行提取、浓缩,优化了前处理过程,能够快速准确检测出养殖水体及沉积物中残存的痕量MG及其代谢物,可为污染来源排查及评价生态环境对健康养殖的影响提供可靠的检测手段。
1 实验部分
1.1 仪器设备
AcquityTM超高效液相色谱仪,Micromass Quattro micro API三重四极杆质谱(配电喷雾离子源),MassLynxTMV 4.1操作软件(Waters公司);XS205电子天平(Mettler Toledo公司);GX271自动固相萃取仪(Gilson公司);Biofuge Stratos高速冷冻离心机(Thermo Scientific公司);T25 digital Ultra-Turrax均质机,MS1 Mini-shaker涡轮振荡器(IKA公司);Milli-Q A10纯水器(Millipore公司);移液器(200、1 000、5 000 μL,Eppendorf公司);PHS-3C pH计(上海精密科学仪器有限公司)。
1.2 试剂与材料
MG、LMG、MG-D5、LMG-D6(纯度≥99.5%,德国Dr.Ehrenstorfer公司);甲醇、乙腈(色谱纯,德国Merck公司);二氯甲烷(色谱纯,美国Fluka公司);实验用水由Millipore A10纯水系统(美国Millipore公司)制备;乙酸铵(LC/MS级)、乙酸(色谱纯)、甲酸(纯度>98%)均购自美国Fluka公司;N,N,N',N'-四甲基对苯二胺(TMPD,生物试剂),浓盐酸(分析纯);固相提取小柱Agilent Accu-BOND SCX(美国Agilent公司,200 mg/3 mL),Oasis MCX(美国Waters公司,150 mg/6 mL),Oasis WCX(美国Waters公司,150 mg/6 mL)。
TMPD溶液(1.0 g/L):称取50 mg TMPD溶于50 mL甲醇中;柠檬酸缓冲溶液(pH 2.6):10.5 g柠檬酸盐溶入500 mL水中,配成0.1 mol/L柠檬酸盐溶液;将14.2 g磷酸二氢钠(NaH2PO4·2H2O)溶于500 mL水中,配成0.2 mol/L磷酸二氢钠溶液,将445.5 mL 0.1 mol/L柠檬酸盐溶液和54.5 mL 0.2 mol/L磷酸二氢钠溶液混合即可;标准溶液:准确称取MG和LMG标准品及对应内标,用甲醇溶解并稀释成100 mg/L的储备液,室温下可稳定3个月;储备液用80%乙腈溶液(乙腈∶5 mmol/L的乙酸铵溶液=8∶2,体积比)作稀释液配成1.0 mg/L的中间工作溶液,然后用该稀释液将中间液配制成相应浓度的标准工作溶液;内标溶液使用前用稀释液配成两种物质浓度均为0.1 mg/L的混合溶液。
1.3 采样方法
水样采集:用广口瓶取500 mL水样,加入40 mL TMPD溶液,4 000 r/min离心5 min,超声3 min,过0.45 μm尼龙滤膜。加入100 μg/L MG及LMG内标混合液50 μL,放置10 min,然后加入柠檬酸缓冲溶液(pH 2.6)和甲醇各30 mL。超声10 min后,进行固相萃取。
底泥样品采集:取表层沉积物样品,用均质机充分均质后,称取5.0 g,加入200 μL TMPD溶液和50 μL 100 μg/L的MG及LMG内标混合液,放置10 min,备用。
1.4 色谱条件
色谱柱:Waters Acquity UPLC BEH C18(1.7 μm,50 mm×2.1 mm);柱温:35℃;样品室温度:10℃;流动相A:含0.1%甲酸的5 mmol/L的乙酸铵水溶液;流动相B:0.1%甲酸乙腈溶液;进样体积:10 μL;流速:0.30 mL/min。梯度洗脱程序:0~1.0 min,40%B;1.0~3.0 min,40%~95%B;3.0~5.0 min,95%~40%B。
1.5 质谱条件
电离方式:ESI(+);电离电压:2.5 kV;锥孔电压:45 V;离子源温度:110℃;锥孔反吹气流量:50 L/h;脱溶剂气温度:380℃;脱溶剂气流量:550 L/h;采集方式:多反应监测(MRM);定性、定量离子对见表1。
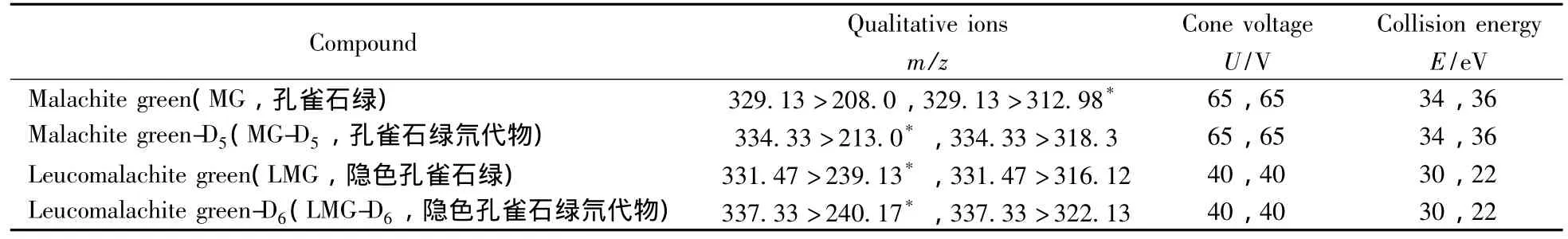
表1 目标化合物的MRM监测离子对及其质谱参数Table 1 Mass spectrometric conditions for monitoring of target compounds
1.6 前处理方法
水样:预先用5 mL甲醇、5 mL水、5 mL柠檬酸缓冲溶液(pH 2.6)活化Waters Oasis MCX(150 mg,6 mL)SPE柱,然后将“1.3”制备的水样过柱。依次用3 mL 0.1 mol/L的盐酸溶液、5 mL水、5 mL 50%甲醇水溶液、3 mL正己烷淋洗,弃去淋洗液。真空抽干后,用5 mL乙酸乙酯-甲醇-氨水(50∶45∶5)混合溶液进行洗脱,收集于10 mL离心管中,于45℃下氮气吹干。残留物加入1.0 mL的乙腈-5 mmol/L乙酸铵溶液(80∶20),涡旋振荡1 min,过0.22 μm有机相滤膜后,上机检测。
底泥样品:准确称取(5.0±0.05)g底泥样品于50 mL聚乙烯离心管中,加入15 mL乙腈,旋涡2 min,超声萃取20 min后静置30 min;再向离心管中加入10 mL二氯甲烷,旋涡2 min后,4 000 r/min离心5 min,取下层清液于旋转蒸发瓶;再次向离心管中加入10 mL乙腈-二氯甲烷混合液(3∶2),重复上述操作,合并萃取液,于45℃旋转蒸干;残余物加入1.0 mL的乙腈-5 mmol/L乙酸铵溶液(80∶20),涡旋振荡1 min,过0.22 μm有机相滤膜后,上机检测。
2 结果与讨论
2.1 液相色谱及质谱条件的优化
MG及其代谢物LMG属于三苯基甲烷类化合物,具有弱碱性,因此可以通过调节流动相的pH值来抑制弱碱的解离,同时加入甲酸和乙酸铵有利于目标分析物的分子离子化,并改善峰形。采用梯度洗脱有利于将目标分析物和基质分开,并有利于提高离子化效果。在已有文献的研究基础上[17-18,21],通过优化得到的液相洗脱条件如“1.4”所示。根据MG和LMG的化学性质,选择ESI正离子模式。用流动注射进样方式对MG、LMG及其对应内标物质的母离子进行扫描,得到其准分子离子峰,再以适当的碰撞能量对准分子离子进行子离子扫描,响应值最强的子离子作为定量离子,响应值相对较强的离子作为定性离子。以MRM扫描模式对母离子与子离子进行碎裂电压及碰撞能量的优化,优化后的参数见表1。采用优化后的色谱条件和质谱条件,MG和LMG及其对应内标的标准溶液质量色谱图如图1所示。
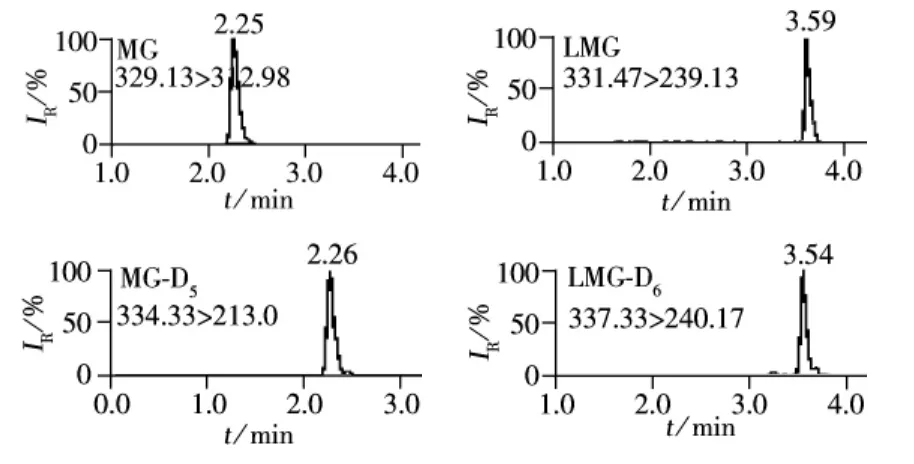
图1 MG、LMG及其对应内标标准品溶液(2.0 μg/L)的 MRM 色谱图Fig.1 MRM chromatograms of MG,LMG ,MG-D5,LMG-D6at 2.0 μg/L standard solution
2.2 水溶液萃取固相萃取柱的选择
水体中MG和LMG含量一般较低,因此需对样品进行提取、富集和净化。现有方法中,生物基质多采用氧化铝柱净化,但水体极性较大,氧化铝对目标化合物有一定的吸附造成目标化合物回收率偏低。因此,本文比较了Oasis MCX、Oasis WCX和AccuBOND SCX 3种阳离子交换固相萃取柱对水体中MG和LMG的净化效果,发现MCX柱对这2种化合物的保留效果较好(见表2)。WCX柱对 MG保留较差,回收率低,对LMG保留较好;而SCX柱的效果则相反。这可能是因为Oasis MCX柱具有反相与阳离子交换双重机理,其选择性更强,效果更好,因此本研究选用Oasis MCX柱进行样品净化处理。考虑到水环境中MG及其代谢物的浓度一般较小,按照最大吸附量是填料的二十分之一来计算,选择150 mg/6 mL规格的固相萃取柱已满足分析方法的要求。

表2 WCX、MCX和SCX固相萃取柱对回收率的影响Table 2 Influence of WCX,MCX and SCX SPE on recoveries of MG and LMG
2.3 固相萃取条件的优化
阳离子交换柱适合碱性化合物的富集和净化,因此一般采用酸性溶液活化,碱性溶液洗脱。本实验在甲醇和水活化的基础上,选用pH 2.6的柠檬酸缓冲溶液继续活化,可保持填料对阳离子和非极性分子的吸附活性,同时使目标分析物保持正离子态而被吸附保留在柱上,从而提高填料对目标分析物的吸附活性。由于需要碱性有机溶液才能使填料失活解吸,因此可以选择用酸性或中性溶液淋洗萃取柱,洗去极性大和极性较小的共存有机干扰物质,最后用碱性溶液洗脱。本实验按照极性逐渐减小的顺序,依次用0.1 mol/L的盐酸溶液、水、50%甲醇水溶液、3 mL正己烷淋洗,以去除吸附在填料上的大部分基质干扰。同时考察了甲醇-氨水(95∶5)、乙腈-氨水(95∶5)、乙酸乙酯-甲醇-氨水(50∶45∶5)3种洗脱液的洗脱效果。结果表明,在同等体积下,乙酸乙酯-甲醇-氨水(50∶45∶5)的洗脱效果最好,回收率最高,因此选择其为洗脱溶液。将500 mL 5.0 μg/L的水溶液按照“1.6”方法过柱后,持续加入12 mL洗脱液,分别用过滤管收集流出液,每2 mL收集1管。45℃下氮气吹干后,残余物加入1.0 mL乙腈-5 mmol/L的乙酸铵溶液(80∶20),涡旋振荡1 min,过0.22 μm有机相滤膜后,上机检测。发现8 mL以后的洗脱液中,均检测不到目标分析物,说明8 mL洗脱液可将目标物完全洗脱。为保证洗脱完全,在实际应用时采用10 mL洗脱液进行洗脱。浓缩富集前加入MG-D5和LMG-D6内标,结果显示方法的回收率、稳定性和重现性均较好。
2.4 底泥样品中浓缩富集条件的优化
底泥样品均质称量后,需加入一定量的TMPD溶液作为抗氧化剂来提高样品中MG和LMG的回收率。对固体样品中MG和LMG的提取,常用的提取溶剂包括乙腈、甲醇、乙酸铵缓冲液和二氯甲烷等[18-23]。常用的方法是先加入乙腈,使底泥中的目标分析物溶解到乙腈溶液中,然后用二氯甲烷将乙腈中的MG和LMG反萃取到二氯甲烷溶液中,最后将二氯甲烷提取液进一步浓缩和净化。本实验考察了乙腈和二氯甲烷的体积比分别为2∶3、1∶1和3∶2时的提取效果,回收率结果如表3所示。结果表明,乙腈与二氯甲烷采用3∶2比例时,回收率最高,稳定性较好,因此选择乙腈和二氯甲烷体积比为3∶2的混合液为提取液。以有机试剂对固体粉碎样品进行提取时,一般采用有机试剂的体积为固体样品质量的5倍左右,以使提取液和样品表面充分接触而提高提取效果,因此选择加入25 mL提取液,即先加入15 mL乙腈,涡旋和超声提取后,再加入10 mL二氯甲烷涡旋和离心。再次向离心管中加入10 mL乙腈-二氯甲烷混合液提取液,重复提取一次,合并萃取液,于45℃旋转蒸干,可使回收率达到80%以上。
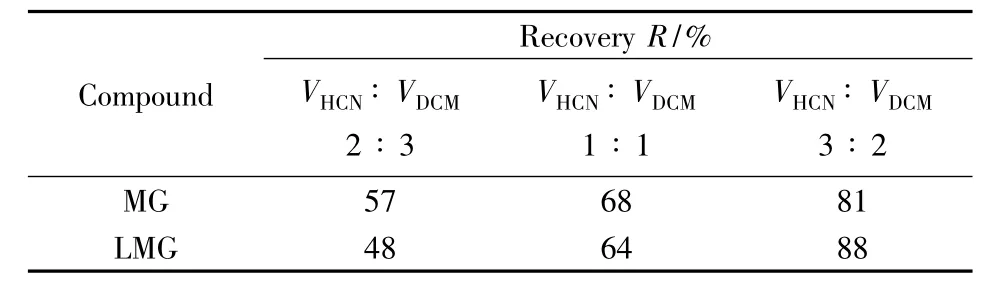
表3 不同乙腈和二氯甲烷体积比对回收率的影响Table 3 Influence of different volume ratio of HCN to DCM on recoveries of MG and LMG
2.5 方法的标准曲线与灵敏度
在优化条件下,分别采用内标法和外标法考察了MG和LMG的线性范围(见表4),结果显示两者质量浓度均在0.2~100 μg/L范围内与峰面积呈良好的线性关系,r2大于0.995。但采用外标法对实际样品进行定量时,MG和LMG在环境水和底泥样品中的回收率分别在45%和60%左右,这可能是基质效应造成的结果。而采用内标法定量时,回收率分别在80%和90%左右,大大减少了基质效应带来的影响,因此本方法采用内标法定量。
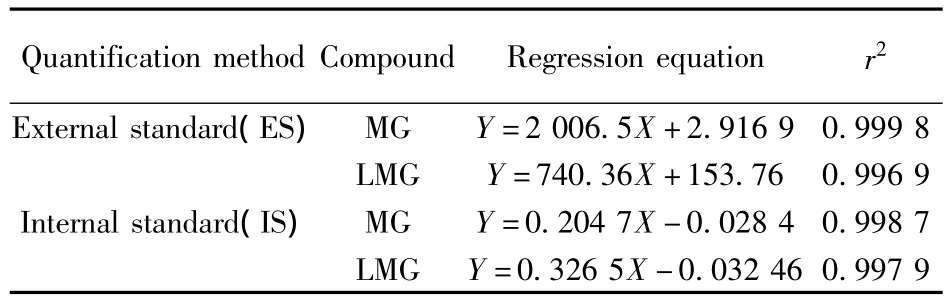
表4 MG和LMG的回归方程及相关系数(r2)Table 4 Regression equation and correlation coefficients(r2)of MG and LMG
采用向阴性样品中添加标准物质的方法,进一步考察方法的灵敏度。在方法规定的取样体积和定容体积下,按3倍信噪比计算得该方法在环境水样和底泥样品中的检出限(LOD)分别为0.2 ng/L和0.02 μg/kg,以信噪比S/N>10得其定量下限(LOQ)分别为0.4 ng/L和0.04 μg/kg。
2.6 方法的回收率与精密度
采用空白加标的方式,在环境水样中分别添加1.0、10.0、100 ng/L 3个浓度梯度,底泥中MG和LMG分别添加0.20、2.00、20.0 μg/kg,按照本方法处理后测定,回收率和相对标准偏差见表5。
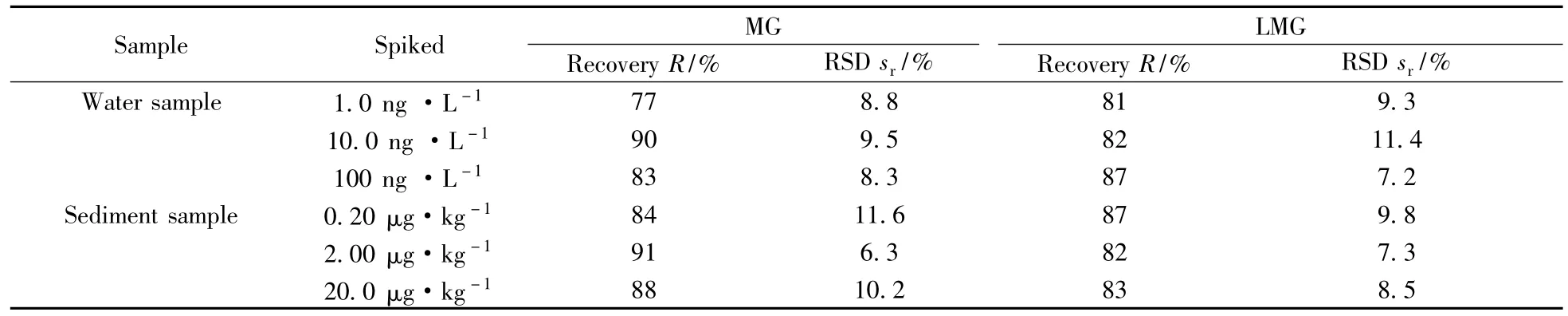
表5 养殖环境水和底泥中MG和LMG的加标回收率及相对标准偏差Table 5 Spiked recoveries and RSDs of MG and LMG in negative water and sediment in aquatic environment
由表5可见,在养殖环境水体中,MG和LMG的平均回收率为77%~90%,RSD为7.2%~11.4%;底泥中MG和LMG的平均回收率为82%~91%,RSD为6.3%~11.6%。因此,MG和LMG在水产养殖环境水和底泥中的加标回收率均能达到检测要求,说明本方法具有较高的准确性。同时,RSD均低于15%,表明结果在置信区间内,本方法具有较高的可靠性。
2.7 实际样品的测定
采用该方法测定了东北地区11家水产养殖场的养殖池塘水体和底泥中MG和LMG的残留情况,在3家检出的养殖场中,其水体中MG的浓度为2.7~11.6 ng/L,LMG的浓度为6.5~21.6 ng/L;底泥中MG的浓度为0.8~18.7 μg/kg,LMG的浓度为2.8~26.4 μg/kg。经进一步调查,发现该3家养殖场在几年前确曾采用过MG来防治和治疗水霉病,因此,该方法可用于水产养殖环境水体和底泥中MG和LMG残留量的测定。
3 结论
本文通过优化固相萃取条件和液液萃取条件,建立了水产养殖环境水体和底泥中MG和LMG残留的高灵敏分析和确证方法。结果表明,本方法在0.2~100 μg/L范围内呈现良好的线性关系,水体和底泥中的检出限分别为0.2 ng/L和0.02 μg/kg;相对标准偏差(RSD)均小于12%。该方法步骤简单、回收率高、精密度良好。可作为水体和底泥中MG及其代谢物LMG残留的检测方法,并可为MG及LMG在水产品中的富集规律及毒理评价提供灵敏、准确的分析手段,为水产品中MG及LMG溯源和卫生监督提供检测技术支持。
[1]Culp S J,Beland F A.Int.J.Toxicol.,1996,15(3):219 -238.
[2]Li C T,Xu W,Jia Z Y,Shi L Y.Chin.J.Fish.(李池陶,徐伟,贾智英,石连玉.水产学杂志),2011,24(4):37-40.
[3]Eli A,Briyai O F,Abowei J F N.Asian J.Med.Sci.,2011,3(5):198-205.
[4]Ni D S.Research of Prevent and Control Saprolegniasis in Fishes.Beijing:Agriculture Press(倪达书.鱼类水霉病防治研究.北京:农业出版社),1982:32.
[5]Alderman D J.J.Fish.Dis.,1985,8(3):289 -298.
[6]Shivaji S,Ranjana S,Roy D.Aquat.Toxicol.,2004,66(3):319 -329.
[7]Hou Y Q,Zhu W J.Reproduction and Contraception(侯瑜琼,朱伟杰.生殖与避孕),2006,26(12):707-711.
[8]Zhou Y H,Wu Y K,Li Q X,Zhang J X,Shen J Z,Hu Z M.J.Toxicol.(周艳红,吴永魁,李乾学,张锦霞,沈建忠,胡仲明.毒理学杂志),2006,20(3):163-165.
[9]Wen C,Wu H J,Wang Y F.Environ.Sci.Technol.(文琛,邬红娟,王宇飞.环境科学与技术),2007,30(6):8-9.
[10]Li N.Foreign Med.Sci.:Sect.Hyg.(李宁.国外医学 卫生学分册),2005,32(5):262-264.
[11]Sandra J C,Lonnie R B,Donna F K,Daniel R D,Louis T M,Frederick A B.Chem.Biol.Interact.,1999,122(1):153-170.
[12]Annalaura S,Carlo N,Isabella D A,Alessandra G A,Monica C,Claudia R,Franco Z,Mauro D.Toxicol.Vitro.,2005,19(7):853-858.
[13]Sudova E,Machova J,Svobodova Z,Vesely T.Veter.Med.,2007,52(12):527 -539.
[14]Kumar K V,Sivanesan S,Ramamurthi V.Process Biochem.,2005,40(8):2865-2872.
[15]Gupta V K,Mittal A,Krishnan L,Gajbe V.Sep.Purif.Technol.,2004,40(1):87 -96.
[16]Safarik I,Safariková M.Water Res.,2002,36(1):196 -200.
[17]Zhang T Q,Yang H S,Lin H,Wang J,Zhou G,Li Q.Journal of Fisheries of China(张彤晴,杨洪生,林海,王静,周刚,李强.水产学报),2007,31(5):699-703.
[18]Yu P J.Chem.Anal.Meter.(余培健.化学计量分析),2007,16(2):27-29.
[19]Gao L,Zhang D,Cao J,Guo D,Yang R Z,Chen Y.J.Instrum.Anal.(高玲,张丹,曹军,郭栋,杨瑞章,陈勇.分析测试学报),2012,31(3):337-342.
[20]Kirsi H,Erja L,Kimmo P.J.Chromatogr.B,2007,845(1):74-79.
[21]Zhu K Z,Wang P,Lin Y F,Xiao S J,Mei S R.Chin.J.Chromatogr.(朱宽正,王鹏,林雁飞,萧松建,梅素容.色谱),2007,25(1):66-69.
[22]María J M B,Sonia H,Ana U,Ana A,María D H,Olga S,Marcus R,Amadeo R F A.Anal.Chim.Acta,2010,665(1):54-74.
[23]Luis V,Cecilia D,Antonio L Z,Pablo R.J.Chromatogr.A,2005,1067(1/2):101-105.
[24]Xu Y H,Gu L,Jiang J S,Ding L.Chem.Anal.Meter.(徐彦辉,顾亮,蒋俊树,丁磊.化学计量分析),2011,20(2):49-51.
[25]Liu G H,Liu H H.J.Hyg.Res.(刘桂华,刘红河.卫生研究),2007,36(6):731-733.
[26]Na G S,Li H X,Zhou C G,Sun Q,Yao Z W.Chin.J.Anal.Lab.(那光水,李红霞,周传光,孙茜,姚子伟.分析试验室),2008,27(12):63-65.
