HPLC-PDA法测定黄芪多糖注射液中非法添加利巴韦林的试验
2013-09-23郝利华毕言锋郭桂芳刘自扬万仁玲
郝利华,毕言锋,郭桂芳,刘自扬,万仁玲
(中国兽医药品监察所,北京 海淀100081)
黄芪多糖注射液具有增强机体免疫力等作用,在兽医临床广泛应用。利巴韦林为人用抗病毒药,移植兽用缺乏科学数据,用于动物疫病不但给疫病防控带来不良后果,而且影响疫病防控政策的实施,农业部于2005年10月《农业部第560号公告》中明确规定禁止兽用。根据目前兽药市场反应的情况,黄芪多糖注射液中有违规添加利巴韦林现象。本试验旨在建立黄芪多糖注射液中非法添加利巴韦林的HPLC-PDA定性、定量检查方法,又用质谱法对测定结果进行确证。试验结果表明,本方法简便、快速、准确、可行,为兽药监管提供科学依据。
1 仪器与试药
1.1 仪器 高效液相色谱仪 Waters 2695,二极管阵列检测器2998(PDA),美国Waters公司。
精密天平AE240精度0.01mg梅特勒精密仪器厂
1.2 试药 利巴韦林对照品:中国药品生物制品检定所,批号:629-200202;供试品:市售黄芪多糖注射液;黄芪多糖提取物:中国兽医药品监察所,含量25%(以葡萄糖计)。
2 试验方法
2.1 溶液制备 对照品溶液:取利巴韦林对照品15mg,精密称定,置50mL量瓶中,加水溶解并稀释至刻度,精密量取5mL至25mL量瓶中,加水稀释至刻度,摇匀,即得。
阴性对照溶液:取黄芪多糖提取物4.0g,加水100mL,即得[1]。
供试品溶液:精密量取供试品1mL,置100mL量瓶中,加水稀释至刻度,摇匀,精密量取5mL置25mL量瓶中,加水稀释至刻度,摇匀。
2.2 色谱条件[2]采用资生堂利巴韦林专用柱(CAPCELL,PAK,Scx,UG80,4.6×250mm,5 μm);以水(用硫酸调节pH 值至2.5±0.1)为流动相;采用二极管阵列检测器,采集波长范围为190 nm~400nm,分辨率为1.2nm,检测波长207nm;进样量20μL,流速0.3mL/min。理论板数按利巴韦林峰计算应不低于3 000。
2.3 方法学考察
2.3.1 样品本底及干扰 精密量取对照品溶液和阴性对照溶液各溶液20μL,注入高效液相色谱仪,记录色谱图和光谱指数图,测定黄芪多糖成分对测定结果是否产生干扰。
结果见图1、图2,黄芪多糖注射液本底对利巴韦林测定不产生干扰。
2.3.2 线性关系考察 取利巴韦林对照品30mg,置50mL量瓶中,加水使溶解并稀释至刻度,摇匀,精密量取1、3、5、7、9mL于25mL量瓶中,加水至刻度,摇匀,测定。按利巴韦林峰面积与对应的浓度作标准曲线,并计算回归方程和相关系数。利巴韦林回归方程为y=46 083x+106,R2=0.999 9。表明利巴韦林在24μg/mL~216μg/mL浓度范围内,峰面积与浓度呈良好的线性关系。
2.3.3 检测限与定量限 黄芪多糖储备液:取阴性对照溶液0.15mL[2]置50mL量瓶中,加水至刻度,摇匀。
检测限溶液制备:取2.1对照品溶液适量(可适当稀释)、加黄芪多糖储备液5mL于25mL量瓶中,加水至刻度,摇匀,测定。光谱指数图失真前的浓度为本法的检测限,S/N≥10的浓度为定量限。该色谱条件下利巴韦林检测限为2μg/mL,定量限 为6μg/mL。
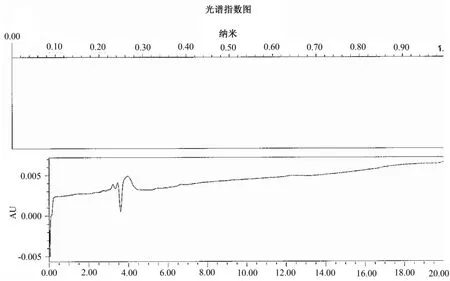
图1 阴性对照溶液光谱图、色谱图
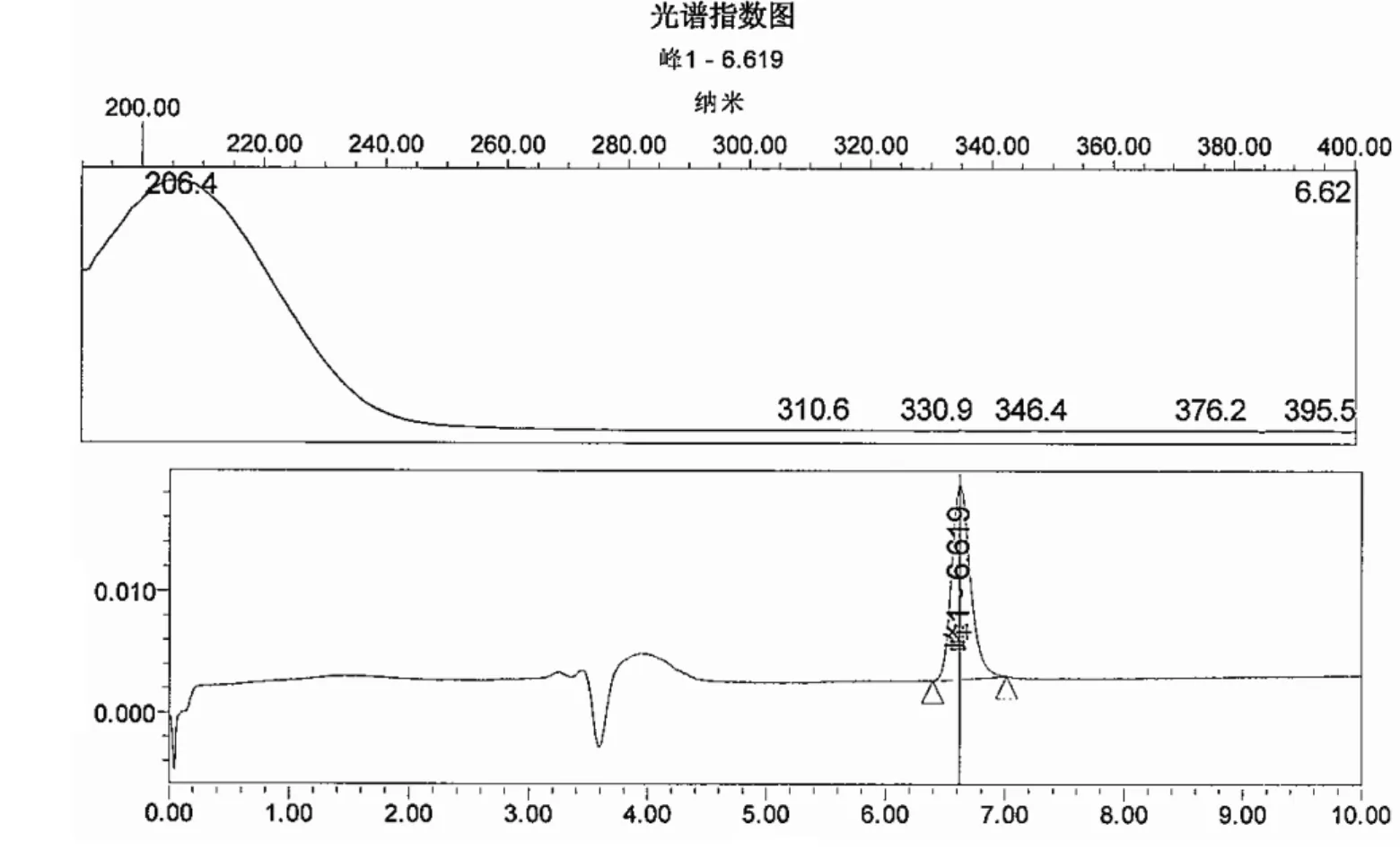
图2 利巴韦林对照品光谱图、色谱图
2.3.4 回收率试验 取利巴韦林对照品12mg、15 mg、18mg,精密称定,置50mL量瓶中,分别加黄芪多糖注射液各0.15mL,用水稀释至刻度,摇匀,精密量取5mL于25mL量瓶中,加水至刻度,摇匀,按上述色谱条件测定,每个浓度测定3份平行样。回收率结果见表1。
2.4 供试品测定 取市售黄芪多糖注射液25批(不同厂家),按上述色谱条件测定。结果见表2。
2.5 质谱确证条件[3]色谱条件:Waters ACQUITY UPLC液相色谱仪;ACQUITY C18色谱柱(100 mm×2.1mm i.d.,1.7μm);流速0.3mL/min;柱温35℃;流动相A为0.1%甲酸乙腈溶液,流动相B为0.1%甲酸水溶液;梯度洗脱程序:0~0.5min,A相比例为2%;0.5~3min,A相比例由2%线性变化至20%。进样体积2μL。
质谱条件:Waters HDMS四级杆-飞行时间质谱仪(Q-TOF MS),离子源为电喷雾正电离模式(ESI+),毛细管电压3.0kV,锥孔电压20V;采用碰撞能量梯度(MSE)功能同时采集MS和 MS2信息,低碰撞能设为4V,高碰撞能梯度范围设为10~20V;离子源及脱溶剂气温度分别为120℃和350℃;脱溶剂化气体流速设为650L/h。TOF MS质量采集方式为全扫描,范围为m/z 50至300Da,样品分析前用甲酸钠溶液进行质量数校正。另外,采用亮氨酸-脑啡肽溶液(LE,m/z 566.2771)为Lock mass实时校正精确质量数。
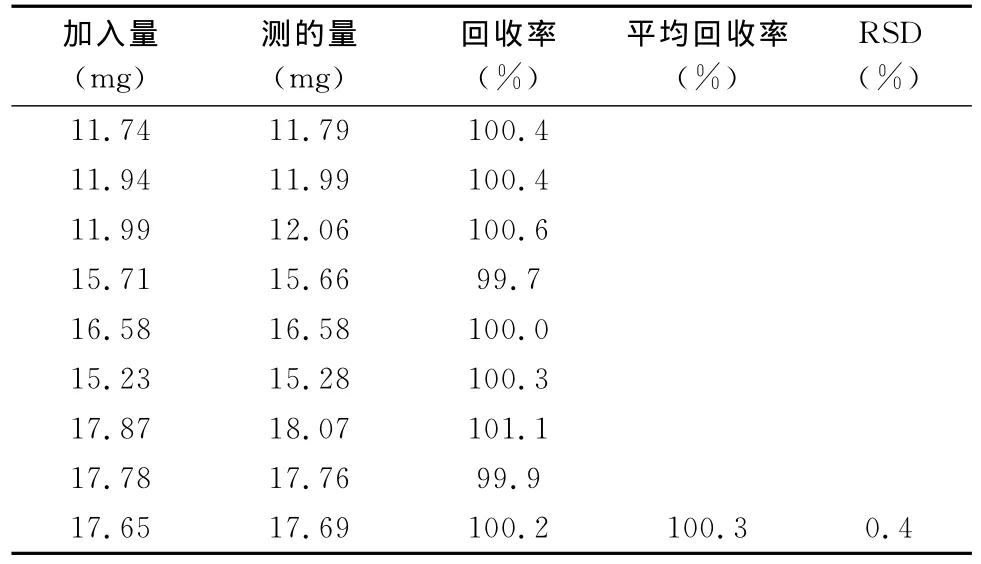
表1 利巴韦林回收率

表2 黄芪多糖注射液中利巴韦林含量测定结果
3 结果与分析
通过对比对照品和供试品色谱图的保留时间,发现在检测的25批黄芪多糖注射液中,3批添加了利巴韦林,对照品溶液中的利巴韦林与供试品溶液中的添加物质PAD光谱一致,检出波长均为206 nm,色谱保留时间一致,证明其中添加了利巴韦林[4],见图3。
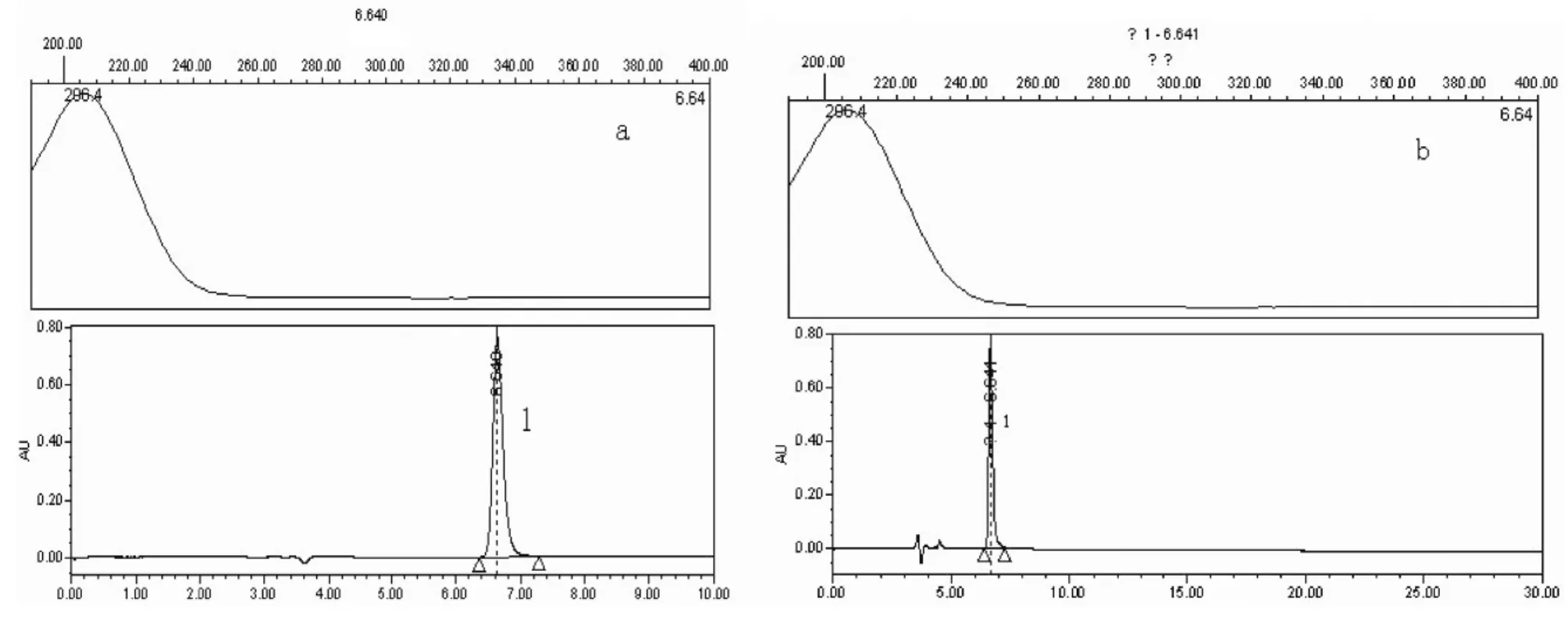
图3 HPLC-PDA光谱指数图(上)及色谱图(下)
为了进一步确证检出利巴韦林,又采用了超高效液相色谱-四级杆-飞行时间质谱进行分析,对比对照溶液和样品溶液的保留时间(RT)和质谱碎片离子(MS2)。对照品溶液中,利巴韦林(m/z245)的选择离子检测监测色谱图(EIC)和MS2全扫描质谱图见图3(a),其中,RT为1.14min,主要碎片离子有m/z113和 m/z96。供试品溶液中利巴韦林的EIC和 MS2全扫描质谱图见图3(b),其RT和MS2信息与对照溶液完全相同,说明供试品溶液中确实含有利巴韦林,见图4。
4 讨论
4.1 本试验在做回收试验时,按利巴韦林注射液规格[2]为100%添加,在实际供试品测定中发现有的样品不只添加一种成分,可检出两种或两种以上,添加量各不相同,故在实际检测过程中可根据实际情况调节供试品的稀释倍数。
4.2 本试验采用色谱柱为利巴韦林专用柱,柱平衡时间比较长,可先采用纯水以1.0mL/min的流速过夜冲洗,再经流动相以0.3mL/min的流速进行平衡。
4.3 HPLC-PDA检测方法利用待测物与其对应的对照品有相同的最大吸收波长,两者之间的偏差应在±2nm之内,另根据保留时间的一致性可确定检出药物与其对应对照品为同一物质,而进行定性与定量测定[5-6]。在测定的色谱图中,待测物的保留时间应与其对应的利巴韦林对照品的保留时间一致。
5 结论
通过本试验,确定了黄芪多糖注射液中非法添加利巴韦林的定性和定量检测方法,方法简便、快速、准确、且可行。
[1] 兽药质量标准2003年版[S].
[2] 中国药典二○一○年版二部[S].
[3] 宁素云,郭兴杰,张红,等.HPLC法同时检测清热解毒类中成药中非法添加的9种化学药品[J].中国药事,2009,23(9)907-910.
[4] 吴小红,李焕德.高效液相色谱法-二极管阵列检测器同时分析测定中成药及保健品中非法添加的9种糖皮质激素[J].中南药学,2009,5,7(5):324-327.
[5] 王晓飞,葛海生,于玲,等.中成药中非法添加对乙酰氨基酚的检测[J].江西中医学院学报,2009,6,21(3):72-73.
[6] 刘吉金,杨敏,李军,等.HPLC同时检测保健品及中成药中非法添加9种抗高血压化学药物的研究[J],中国现代应用药学杂志,2008,25(8):717-719.
