牦牛不同脏器中牛磺酸提取工艺优化及含量分析
2013-09-06余群力张文华
陈 骋,张 丽,韩 玲,*,余群力,张文华
(1.甘肃农业大学食品科学与工程学院,甘肃兰州 730070;2.宁夏厦华肉食品有限公司,宁夏中卫755000)
牛磺酸(Taurine),化学名称为β-氨基乙磺酸(NH2-CH2-CH2-SO3H),1827年首次从牛胆汁中分离出来,又称牛胆素、牛胆酸[1]。牛磺酸是人重要的营养素,对调节机体中枢、消化、生殖、免疫和内分泌等系统生理功能有重要的作用[2-3]。随着我国西部藏区畜牧产业的发展,脏器等牛副产物的产量日趋增加。根据国家统计局及农业部的资料,2010年屠宰牦牛约为189.7万头,体重350kg左右,其脏器总产量约为6万t[4-5]。然而,牦牛肝脏很可能富含牛磺酸,如果能够从牦牛脏器中提取天然牛磺酸,确定最佳的提取工艺,对于提高牦牛脏器综合利用效率具有极其重要的意义,同时还可以缓解人工合成牛磺酸所带来的安全及环境问题[6]。此外,目前尚无针对牦牛脏器中牛磺酸提取及含量分析的权威方法,相关的国家标准及行业标准均属空白,无法准确分析牦牛脏器中牛磺酸的含量,难以评估其市场前景。因此,优化牦牛脏器中牛磺酸的提取方法,可以为建立牦牛脏器中牛磺酸的检测标准提供理论基础。目前,国内外已有关于动物机体中提取天然牛磺酸的研究报道,其主要研究对象为海产贝类或其他水产品[7]。2000年,钱俊青等[8]研究了珍珠贝母体中提取牛磺酸的工艺。2005年,李和生等[9]研究了从蛤蜊中提取牛磺酸的工艺。2010年,杨广会等[3]研究了从鱿鱼肝脏中提取牛磺酸的工艺。然而,目前尚未见针对牦牛脏器中牛磺酸提取工艺研究的报道。本研究采用均匀实验设计法,针对青海海北地区牦牛内脏(心脏、肝脏、肺脏、肾脏)中牛磺酸的提取工艺参数进行优化,并以最佳工艺进行心脏、肝脏、肺脏和肾脏四种脏器中牛磺酸提取,采用紫外可见分光光度法测定其含量,分析海北牦牛4种脏器中牛磺酸含量,以期为今后进一步利用牦牛脏器中牛磺酸资源,开发高附加值产品提供科学依据。
1 材料与方法
1.1 材料与仪器
青海海北藏族自治州成年牦牛脏器(心脏、肝脏、肺脏、肾脏)样品采后在-20℃条件下冷冻保存,一周内进行实验;牛磺酸标准品 上海国药集团化学试剂有限公司;732型强酸性阳离子交换树脂 河北华众化工有限公司;乙酰丙酮 北京奥博星生物技术有限公司;甲醛 天津市化学试剂六厂;氢氧化钠、浓盐酸、醋酸钠 天津市化学试剂三厂;以上试剂均为分析纯。
756P型紫外可见分光光度计 上海光谱仪器有限公司;JJ-2B型组织捣碎机 金坛市医疗仪器有限公司;L5000型高速台式离心机 长沙湘仪离心机仪器有限公司;PHS-3C型酸度计 上海佑科仪器仪表有限公司;LE-52型旋转蒸发仪 上海亚荣生化仪器厂;离子交换柱(25mm×30cm)深圳市深泉科技有限公司。
1.2 实验方法
1.2.1 牦牛脏器中牛磺酸含量测定
1.2.1.1 标准曲线的绘制 使用牛磺酸标准品分别配制0.00、0.05、0.10、0.15、0.20、0.25、0.30、0.35、0.40、0.45mg/mL的牛磺酸标准溶液,在最大吸收波长400nm[7]处依次测定吸光值,以吸光值(Y)对牛磺酸标准溶液浓度(X)绘制标准曲线并求得回归方程。
1.2.1.2 显色剂的配制 吸取1.0mol·L-1的醋酸钠溶液10.0mL,依次加入0.4mL乙酰丙酮、1.0mL甲醛,并加蒸馏水稀释至25.0mL,实验当天配制[9]。
1.2.1.3 样品测定 牛磺酸与乙酰丙酮和甲醛经加热反应生成N-取代基2,6-二甲基-3,5-二乙酰基-1,4-二氢吡啶,该配合物显黄色。从待测样品中吸取1mL(1.2.2.2)收集的溶液,10倍稀释。吸取2mL稀释液,加入1mL显色剂,100℃下水浴15min,随后冷却至室温,于400nm波长下测定其吸光值[10]。
1.2.1.4 牛磺酸含量计算公式
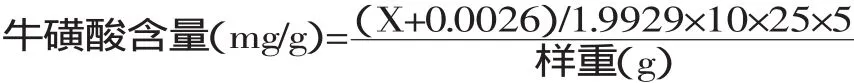
式中:X—吸光值;0.0026—牛磺酸标准曲线回归方程的截距;1.9929—牛磺酸标准曲线回归方程的斜率;10—稀释倍数,用于吸光值测定时溶液(1mL)中牛磺酸浓度(mg/mL)换算为牛磺酸质量(mg);25—体积比,用于吸光值测定时溶液(1mL)中牛磺酸质量(mg)换算为过柱时溶液中牛磺酸的质量(mg);5—体积比,用于过柱后溶液中牛磺酸质量(mg)换算为浓缩液中牛磺酸的质量(mg)。
1.2.2 牦牛脏器牛磺酸提取工艺优化
1.2.2.1 牛磺酸提取工艺流程 牦牛脏器→匀浆→自溶→提取→除蛋白→脱色浓缩→过柱除杂→待测。
1.2.2.2 操作要点 a.前处理:称取原料25.0g,按1∶4(m∶v)加入蒸馏水,置于组织捣碎机中匀浆,至糜状[3]。
b.自溶:采用2mol/L的盐酸溶液调匀浆后组织液pH至5.5,组织液随后置于50℃水浴锅内,恒温水浴20h[3]。
c.提取:自溶结束后,调水浴锅温度至80℃,继续恒温提取50min,随后采用四层细纱布过滤,收集滤液[3]。
d.除蛋白:除酸性蛋白:采用1∶1(v∶v)的盐酸调滤液pH至3.5,4500r/min下离心20min,收集上清液;
除碱性蛋白:采用5mol/L的氢氧化钠调除去酸性蛋白后上清液pH至8.5,4500r/min下离心20min,收集上清液[9-10]。
e.脱色浓缩:上清液中加入适量活性炭(每100mL加入2~3g)进行脱色,过滤后置于旋转蒸发仪,待上清液浓缩至50mL,采用2mol/L的盐酸溶液调浓缩液pH至4.5[10]。
f.去除其他杂质:离子交换柱:除去蛋白质及色素后,提取液中仍然含有干扰牛磺酸测定的甘氨酸、赖氨酸等氨基酸,当牛磺酸慢速流经强酸性阳离子交换树脂时,这些氨基酸会保留到树脂上,而牛磺酸被洗脱下来得到分离[6]。本实验采用732型强酸性阳离子树脂进行湿法装柱,树脂填充高度4cm,除去管中气泡待用[11]。
g.过柱:吸取10mL(e)中收集的浓缩液缓慢注入732型强酸性阳离子树脂交换柱,采用蒸馏水进行洗脱,每次5mL,共3次,收集此溶液25mL,即为待测样品[9]。
1.2.2.3 牦牛脏器中牛磺酸提取工艺优化 采用均匀实验设计方法针对料液比、自溶温度、提取温度、提取时间4个因素组合实验,进行牛磺酸提取工艺优化。
a.因素水平的确立:本实验4因素中,料液比(m∶v)水平范围分别为1∶1、1∶2、1∶3、1∶4、1∶5、1∶6;自溶温度水平范围为30、35、40、45、50、55℃;提取温度水平范围为70、75、80、85、90、95℃;提取时间水平范围为30、40、50、60、70、80min。
b.因素水平均匀实验设计:本实验采用4因素6水平的均匀设计U6(46),因素水平表如表1所示。
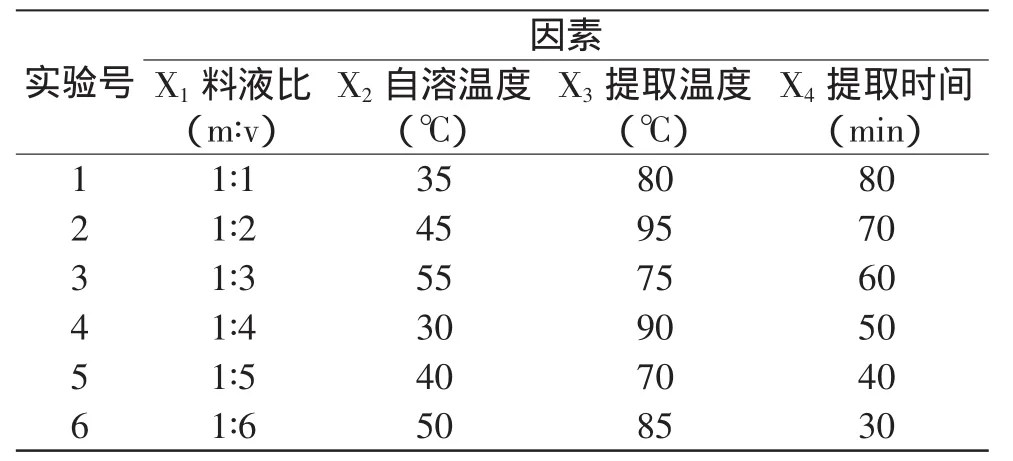
表1 均匀设计因素水平表Table 1 Factors and levels of the uniform design
c.验证实验:对均匀实验设计获得的理论最佳工艺参数进行验证,参照(1.2.2.2)牛磺酸提取方法,采用直观分析法从均匀实验设计的实验结果中选出理论最佳工艺参数针对青海海北牦牛肝脏进行牛磺酸提取,测定其含量,与回归方程计算的预测值进行比较、验证。
1.2.3 牦牛不同脏器中牛磺酸含量分析 以(2.2,2.3)确定的牛磺酸最佳提取工艺参数,对青海海北牦牛脏器(心脏、肝脏、肺脏、肾脏)中的牛磺酸进行提取,并测定其含量。
2 结果与分析
2.1 标准曲线回归方程的确定
牛磺酸标准曲线如图1所示。
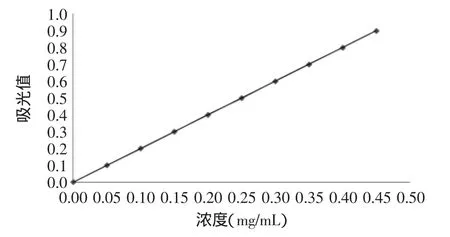
图1 牛磺酸标准溶液浓度与吸光值关系曲线Fig.1 Standard curve of taurine
回归方程为:Y=1.9929X-0.0026,R2=0.997,说明牛磺酸标准溶液浓度在0.00~0.45mg/mL的范围内与吸光值呈良好的线性关系。
2.2 牛磺酸最佳提取工艺
根据表1中的均匀设计方案,对牦牛肝脏中的牛磺酸进行提取,并测定其含量,结果如表2所示。
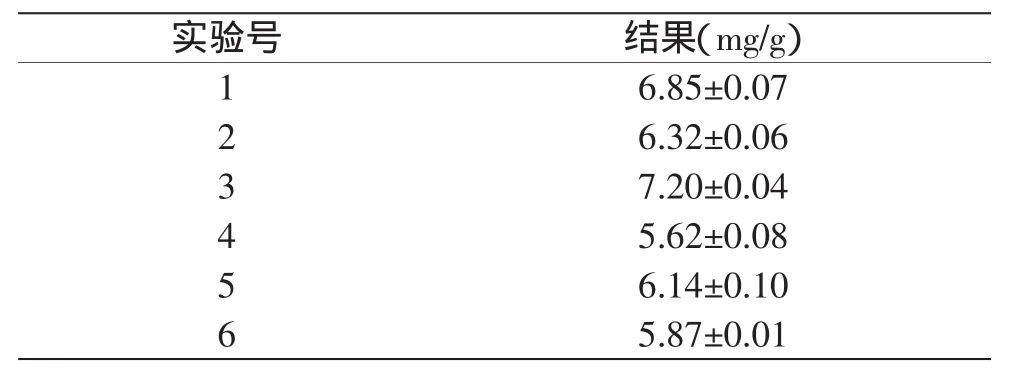
表2 均匀设计实验结果(n=12)Table 2Results of uniform design experiment(n=12)
根据表2结果,以牛磺酸提取量为因变量,液料比(X1)、自溶温度(X2)、提取温度(X3)、提取时间(X4)为自变量,采用IBM SPSS Statistics 19软件对实验结果进行多元线性和二次多项式逐步回归分析,得回归方程:
Y=-3.731+0.246X3+0.001X1X4+0.001X2X4-0.002X32
对方程进行显著性检验,R2=0.998,F=150723.36(p<0.01),说明该方程具有显著意义。进一步对各项系数进行显著性检验,结果如表3所示。
由表3可知,方程各项系数中,提取温度(X3),提取温度的二次方(X32)以及自溶温度、提取时间的交互作用(X2X4)的影响均为极显著(p<0.01);料液比、提取时间的交互作用(X1X4)的影响为显著(p<0.05)。由于方程中各项系数单位不一致不能直接进行比较,故对回归系数进行标准化,各项标准化系数如表4所示。
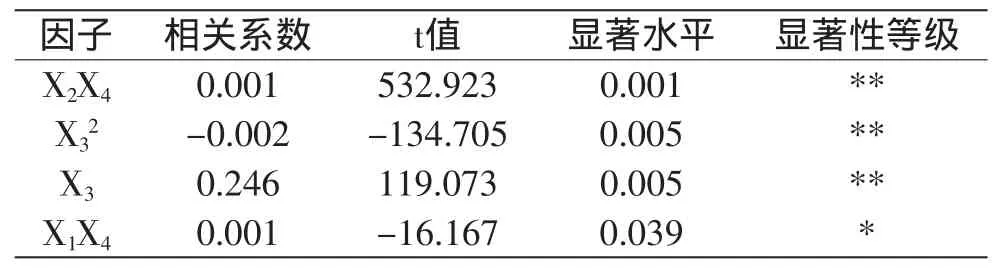
表3 回归项系数检验Table 3 Regression coefficient test
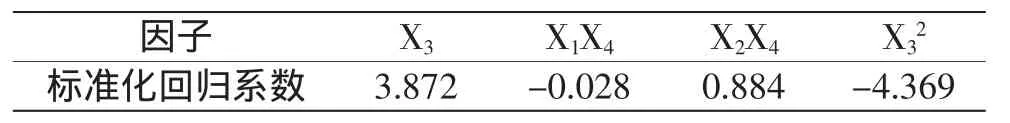
表4 标准化回归系数Table 4 The standardized regression coefficient
由表4可知,各因素对牦牛肝脏中牛磺酸提取影响强弱的顺序为:提取温度(X3)>自溶温度、提取时间交互作用(X2X4)>料液比、提取时间交互作用(X1X4)。其中,提取温度为牛磺酸提取中最主要的影响因素,自溶温度、提取时间为次要因素,而料液比的影响最小。
提取温度是影响牦牛脏器中牛磺酸提取的最主要因素,提取时间和自溶温度为次要因素,与杨光辉等[3]的研究结果一致,其在鱿鱼肝脏中牛磺酸提取工艺条件的研究中发现提取温度为影响鱿鱼肝脏中牛磺酸提取的主要因素,提取时间为次要因素,且80℃下提取50min为最佳组合,与本实验(2.2)确定的75℃下提取60min的最佳组合在同一梯度区间。陈秋虹等[5]研究发现牛磺酸提取温度应控制在70℃左右,温度过高,可溶性蛋白质溶出变性,溶液粘度增大,反而影响牛磺酸的提取量。因此,本实验确定牦牛脏器中牛磺酸的最佳提取温度为75℃,提取时间为60min。
自溶温度为影响牛磺酸提取的另一次要因素,(2.2)中最佳自溶温度为55℃,杨光辉等[3]在针对鱿鱼肝脏中牛磺酸提取的研究发现,55℃下自溶22h,牛磺酸的提取量最高,同时发现自溶时间超过20h后,牛磺酸的提取量急剧下降,与本实验结果一致。
料液比对牦牛脏器中牛磺酸的影响最小,杨光辉等[3]、钱俊青等[8]、李和生等[9]在针对不同原料中牛磺酸提取的研究中均发现料液比为最小影响因素,这主要是由于牛磺酸具有良好的水溶性。
因此,牦牛脏器中牛磺酸理论最佳提取工艺为:料液比为1∶3(m∶v),自溶温度为55℃,提取温度为75℃,提取时间60min。
2.3 最优工艺参数验证
预测值:针对(2.2)获得的牛磺酸提取理论最优工艺:料液比1∶3(m∶v),自溶温度55℃,提取温度75℃,提取时间60min代入(2.2)获得的回归方程,得到牛磺酸含量预测值为6.95mg/g。
验证:采用(2.2)获得的理论最优提取工艺参数,对青海海北牦牛肝脏中的牛磺酸进行提取,并测定其含量,做3次平行,实际测得牛磺酸含量为(6.90±0.10)mg/g。
通过验证实验发现,青海海北牦牛肝脏中牛磺酸的预测值为6.95mg/g,实际含量为6.90mg/g,二者仅相差0.05mg/g。因此,青海海北牦牛脏器中牛磺酸最佳提取工艺参数为:料液比为1∶3(m∶v),自溶温度为55℃,提取温度为75℃,提取时间60min。
2.4 牦牛不同脏器中牛磺酸含量分析
采用(2.2,2.3)确定的最佳工艺参数,分别对青海海北牦牛肝、肾、心、肺四种脏器中的牛磺酸进行提取,并测定其含量,结果如图2所示。
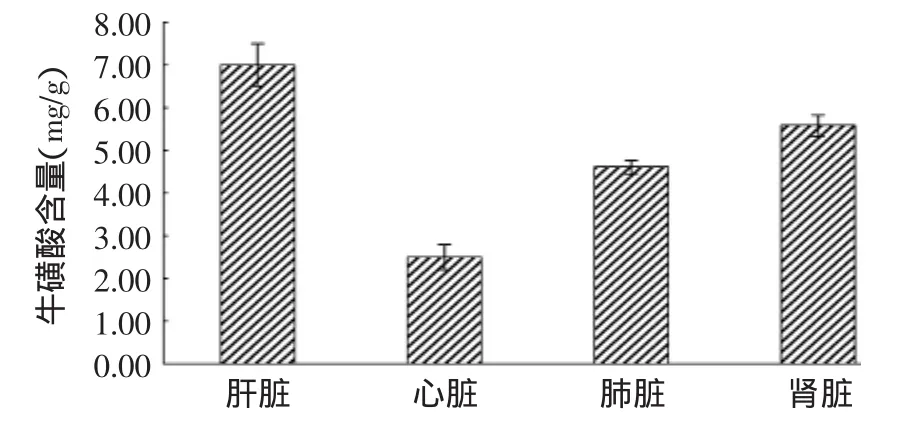
图2 不同脏器牛磺酸含量Fig.2 Taurine content of yak organs
对4种脏器中牛磺酸含量进行Duncan’s新复极差多重比较,发现青海海北牦牛4种脏器之间牛磺酸含量均存在极显著的差异,肝脏含量(7.02mg/g)极显著高于其他脏器(p<0.01),肾脏中含牛磺酸5.59mg/g显著、极显著高于肺脏(4.46mg/g)和心脏(2.50mg/g)中牛磺酸含量(p<0.05,p<0.01)。
肝脏和肾脏中牛磺酸的高含量主要是由于肝脏是牛磺酸最主要的合成器官,肾脏是牛磺酸排泄的器官[12],实验结果符合牛磺酸在哺乳动物机体中的代谢及分布特点。尽管青海海北牦牛肝脏中牛磺酸含量7.02mg/g略低于鱿鱼肝脏(7.36mg/g)[3],但以我国每年加工鱿鱼约20万t[13]计算,鱿鱼肝脏约占鱿鱼体重的15%[3],即每年可用来提取牛磺酸的鱿鱼肝脏为3万t左右,而牦牛肝脏约占牦牛平均体重(360kg)的1.2%,以2010年全国牦牛屠宰量189.7万头计算,可用于牛磺酸提取的牦牛肝脏就达8万t,远高于鱿鱼肝脏原料量。因此,牦牛肝脏资源丰富,可以作为天然牛磺酸的良好来源。此外,牦牛肾脏中牛磺酸含量(5.59mg/g)远低于牦牛和鱿鱼肝脏中含量,但高于蛤蜊中牛磺酸含量(4.85mg/g)[9],也可作为天然牛磺酸较好的来源。
3 结论
本实验选用青海海北牦牛肝脏、心脏、肺脏和肾脏为原料,通过优化牛磺酸最佳提取工艺,并对不同脏器中牛磺酸含量进行分析,得到以下结论:
3.1 牦牛脏器中牛磺酸的最佳提取工艺参数:料液比为1∶3(m∶v),自溶温度为55℃,提取温度为75℃,提取时间60min。
3.2 海北牦牛不同脏器中,肝脏含量(7.02mg/g)极显著高于其他脏器(p<0.01),肾脏中含牛磺酸5.59mg/g显著、极显著高于肺脏(4.46mg/g)和心脏(2.50mg/g)中牛磺酸含量(p<0.05,p<0.01)。
因此,牦牛肝脏和肾脏中蕴含着丰富的牛磺酸资源,采用科学的提取方法,在满足对天然牛磺酸需求的同时,也实现了牦牛副产物的综合开发利用,带动畜牧业循环经济的健康发展。
[1]Pion P D,Kittleson M D,Rogers Q R,et al.Myocardial failure in cats associated with low plasma taurine:a reversible cardiomy pathy[J].Science,1987,237:764-748.
[2]刘养清,刘二保.动物胆汁理化特性及药用[M].北京:北京化工工业出版社,2002:90-95.
[3]杨广会,徐晓莉,王金凤.从鱿鱼肝脏中提取牛磺酸的工艺条件研究[J].食品科学技术,2010,35(6):231-233.
[4]Ito T,Azuma J.Taurine is a possible anti-atherosclerotic agent[J].Nippon Yakurigaku Zasshi,2004,123(5):311-317.
[5]陈秋虹,莫建光,黄艳.天然牛磺酸提取与应用[J].氨基酸和生物资源,2011,33(2):43-45.
[6]张丽萍,李开雄.畜禽副产物综合利用技术[M].北京:中国轻工业出版社,2009:38-76.
[7]潘凤莲.天然牛磺酸提取及分离纯化研究[J].畜牧与饲料科学,2011,32(3):77-78.
[8]钱俊青,陈浚,任建华,等.珍珠贝母体中牛磺酸的提取[J].氨基酸和生物资源,2000,22(1):27-30.
[9]李和生,王鸿飞,陈檬,等.蛤蜊中牛磺酸提取的工艺条件研究[J].食品科技,2005,7(3):39-42.
[10]杨涓,魏智清,庞伟.分光光度法测定宁夏枸杞中牛磺酸含量[J].农业科学研究,2005,26(2):29-30.
[11]杨涓,康建宏,魏智清,等.分光光度法测定地骨皮中牛磺酸含量[J].氨基酸和生物资源,2006,28(3):26-29.
[12]张平伟,杨祖英.牛磺酸的生理功能及其营养作用[J].中国食品卫生杂志.1997,9(5):38-42.
[13]马永钧,秦乾安,陈小娥,等.鱿鱼加工副产物综合利用研究进展[J].渔业现代化,2008,35(4):62-65.
