介导分泌表达猪圆环病毒2 型Cap 蛋白的重组杆状病毒的构建
2013-08-29张春雷靳立明高又文樊惠英
张春雷,靳立明,叶 昱,张 杰,朱 俊,高又文,廖 明,樊惠英
(华南农业大学 兽医学院,农业部兽用疫苗创制重点实验室,广东 广州 510642)
当前,猪圆环病毒2 型(Porcine circovirus type 2,PCV 2)是严重危害世界养猪业的病原之一[1].该病毒与猪的多种疾病综合征有关,特别是断乳仔猪多系统衰竭综合征(Post-weaning multisystemic wasting syndrome,PMWS),还可导致猪呼吸道病综合征(Por-cine respiratory disease complex,PRDC)、猪皮炎/肾病综合征(Porcine dermatitis and nephropathy syndrome,PDNA)等相关疾病[2-4].该病最早于1991年在加拿大发现,其临床症状主要表现为呼吸道症状、进行性消瘦、苍白发热及黄疸等.PCV2 主要侵害机体的免疫系统,导致免疫抑制,造成继发感染,在猪群中感染率非常高,给养猪业造成巨大的经济损失[5-6].
PCV2 基因组为单股负链环状DNA,基因组全长1 767 或1 768 bp,共编码11 个开放阅读框架(Open reading frames,ORFs),其中功能上以ORF1 和ORF2最为重要.ORF1 编码与病毒DNA 滚环复制相关的蛋白(Rep)[7];ORF2 编码病毒的结构蛋白(Cap),构成病毒的核衣壳,是病毒的主要免疫原性蛋白[8-9],所以关于PCV2 基因工程疫苗和诊断试剂盒的研究,都主要集中在PCV2 Cap 蛋白上.
华南农业大学农业部兽用疫苗创制重点实验室曾利用杆状病毒表达系统(Baculovirus expression vector system,BEVS)表达PCV2 Cap 蛋白,但重组Cap 蛋白在Sf9 昆虫细胞中以包涵体形式存在,而非其天然活性状态,不利于其抗原表位的展示,导致该蛋白的免疫原性不强,也不利于该蛋白的后期纯化.因此,本研究拟通过引入EGT 分泌型信号肽取代ORF2 原有核定位信号肽(NLS)以达到Cap 蛋白分泌出细胞的目的,并在ORF2 C 端融合6 个组氨酸标签以便于后期的纯化,从而产生具有天然结构和更高免疫活性的重组Cap 蛋白,为PCV2 基因工程疫苗的研究提供新的选择.
1 材料与方法
1.1 材料
1.1.1 毒株、菌种和细胞 PCV2 毒株、Sf9 昆虫细胞、大肠埃希菌DH5α、DH10Bac 菌株均由华南农业大学农业部兽用疫苗创制重点实验室保存,pFast-BacTMDual 为Invitrogen 公司产品.
1.1.2 主要试剂ExTMTaqDNA 多聚酶、dNTP 为大连宝生物工程有限公司产品,T4DNA 连接酶和各种限制性内切酶等工具酶均为NEB 公司产品,DNA 凝胶纯化试剂盒、质粒抽提试剂盒为天根生化科技(北京)有限公司产品,昆虫细胞培养基(Grace)和LipofectamineTM2000 转染试剂为美国Invitrogen 公司产品,胎牛血清为奥地利PAA 公司产品.抗PCV2 的阳性血清由华南农业大学农业部兽用疫苗创制重点实验室制备并保存,FITC 标记山羊抗小鼠IgG 为Sigma公司产品.
1.2 方法
1.2.1 EGT 信号肽基因的扩增和鉴定 根据EGT基因序列设计引物,PCR 扩增EGT 信号肽基因.P1:5'-ACGCGTCGACATGACTATTCTCTGCTGGCTTGCACTGCTGTCTACGCTTACTGCT-3',P2:5'-GTGTTGAAGATGCCATTGGCCGCATTTACAGCAGTAAGCGTAGACAGCAG-3',P1 上游下划线部分为保护性碱基,斜线部分为SalⅠ酶切位点,ATG 为起始密码子.引物P1 和P2 之间有21 个碱基互补,P1、P2 互为模板,用ExTMTaqDNA 多聚酶扩增EGT 信号肽基因,预计扩增长度为84 bp.PCR 循环参数为:94℃预变性3 min;94℃变性30 s,56℃退火40 s,72℃延伸40 s,进行30 个循环;72℃延伸10 min.PCR 产物送上海英俊生物公司进行序列测定.
1.2.2 去除核定位信号肽ORF2(dORF2)基因的扩增和鉴定 根据PCV2 ORF2 序列设计1 对特异性引物.P3:5'-AATGGCATCTTCAACACCCGCCTCTCCCGC-3',P4:5'-TGCTAAGCTTTTAGTGGTGATGATGGTGGTGAGGGTTAAGTGGGGGGTCTTT-3'.其中,引物P3 与EGT 信号肽基因有17 个碱基的互补,P4中下划线部分为保护性碱基,斜线部分为HindⅢ酶切位点,波浪线部分为6 个组氨酸编码序列.以克隆载体pMD18-T PCV2 为模板,用ExTMTaqDNA 多聚酶扩增dORF2 基因,PCR 循环参数为:94℃预变性5 min;94℃变性40 s,56℃退火45 s,72℃延伸1 min,进行30 个循环;72℃延伸10 min,预计扩增长度为607 bp,扩增产物送上海英俊生物公司进行序列测定.
1.2.3 EGT 信号肽序列和dORF2 序列的PCR 融合PCR 反应体系为50 μL,取经纯化的EGT 信号肽和dORF2 产物各1.5 μL,引物P1 和P4(20 pmol/L)各1 μL,dNTPs(2.5 mmol/L)4 μL,10× Ex TaqTMBuffer 5 μL,Ex TaqTMDNA 聚合酶(5 U/μL)0.5 μL,去离子水35 μL.用ExTMTaqDNA 多聚酶进行PCR 扩增,PCR 循环参数为:94℃预变性5 min;94℃变性45 s,56℃退火45 s,72℃延伸1 min,进行30个循环;72℃延伸10 min,预计扩增长度为674 bp,PCR 产物前端带有salⅠ酶切位点,后端带有HindⅢ酶切位点,并有6 个组氨酸(His)标签,命名为EGTdORF2,扩增产物送上海英俊生物公司进行序列测定.
1.2.4 重组转移载体pFastBac-EGT-dORF2 的构建与鉴定 将扩增的片段EGT-dORF2 进行胶回收纯化,然后用限制性内切酶SalⅠ和HindⅢ进行酶切,连接到经同样酶切消化的pFastBacTMDual 载体上,转化DH5α 感受态细胞,进行含氨苄抗性的平板筛选,挑取阳性克隆进行摇菌扩增,小量提取质粒,用SalⅠ和HindⅢ进行酶切,筛选得到阳性转移质粒pFastBac-EGT-dORF2.进行序列测定以验证插入序列的正确性.
1.2.5 重组穿梭载体Bacmid-EGT-dORF2 的获得将重组质粒pFastBac-EGT-dORF2 转化DH10Bac 感受态细胞,用三抗平板(Kan、Gen 和Tet)进行蓝白斑筛选,纯化白色阳性菌落,提取Bacmid 质粒,用M13通用引物鉴定穿梭质粒Bacmid-EGT-dORF2.
1.2.6 重组杆状病毒Bv-EGT-dORF2 的获得 提取纯化Bacmid-EGT-dORF2,利用LipofectamineTM2000将Bacmid-EGT-dORF2 转染Sf9 昆虫细胞,于27℃条件下培养,待出现细胞病变后,收集培养液上清液即获得了重组杆状病毒Bv-EGT-dORF2,并利用昆虫细胞扩增种毒.
1.2.7 间接免疫荧光检测Cap 蛋白的表达 用24孔板培养Sf9 细胞至对数生长期时,接种重组杆状病毒Bv-EGT-dORF2,27℃培养72 h,至细胞出现病变时,弃培养上清液,收获细胞,用预冷的PBS 洗涤3次,干燥后用预冷的丙酮-乙醇(体积比3∶2)固定液于-20℃条件固定15 min,以1∶200 稀释的鼠抗PCV2 抗体为一抗,1∶100 稀释的FITC 标记的羊抗鼠IgG 为二抗,荧光显微镜观察结果.
1.2.8 Western-blot 鉴定Cap 蛋白的表达 收集感染Bv-EGT-dORF2 的Sf9 昆虫细胞,用适量PBS 重悬,经适当处理后,进行SDS-PAGE 电泳,电转移至NC 膜,用0.05 g/mL 脱脂奶粉封闭2 h,PBST 洗涤后,一抗孵育过夜,再用1∶10 000 稀释的FITC 标记的羊抗鼠IgG 二抗孵育1 h,经Odyssey 双色红外激光成像系统扫描,并观察结果.
2 结果
2.1 EGT 信号肽和dORF2 基因的连接结果
将含有SalⅠ酶切位点的编码EGT 信号肽基因片段和含有Hind Ⅲ酶切位点的dORF2 片段进行PCR 融合扩增,其产物用0.01 g/mL 琼脂糖凝胶电泳进行鉴定,出现674 bp 条带,与预期大小一致(图1),测序结果表明无碱基突变.
2.2 重组转移质粒pFastBac-EGT-dORF2 的构建
对重组质粒pFastBac-EGT-dORF2 分别进行salⅠ和HindⅢ单酶切和双酶切鉴定,单酶切消化后产生大小约为5 200 bp 片段,双酶切后产生4 500 和670 bp 的2 个片段,与预期大小一致(图2).并对pFastBac-EGT-dORF2 进行测序,证实无碱基突变.
2.3 重组穿梭载体Bacmid-EGT-dORF2 的PCR鉴定
将重组穿梭载体 Bacmid-EGT-dORF2 转化DH10Bac 感受态细胞后,经蓝白斑筛选,挑取白斑进行菌液扩增,提取质粒用M13 引物进行PCR 鉴定,PCR 产物经琼脂糖凝胶电泳后,在3 500 bp 处可见特异性条带,证明已成功获得重组Bacmid-EGTdORF2(图3).
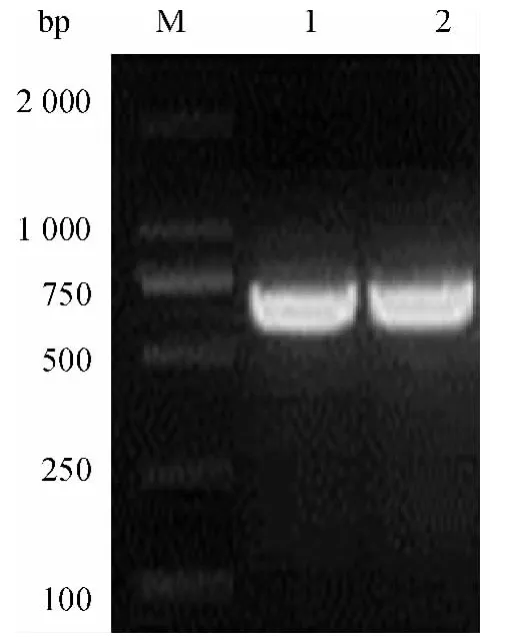
图1 EGT-dORF2 融合产物的PCR 鉴定Fig.1 Identification of the fused EGT-dORF2 by PCR
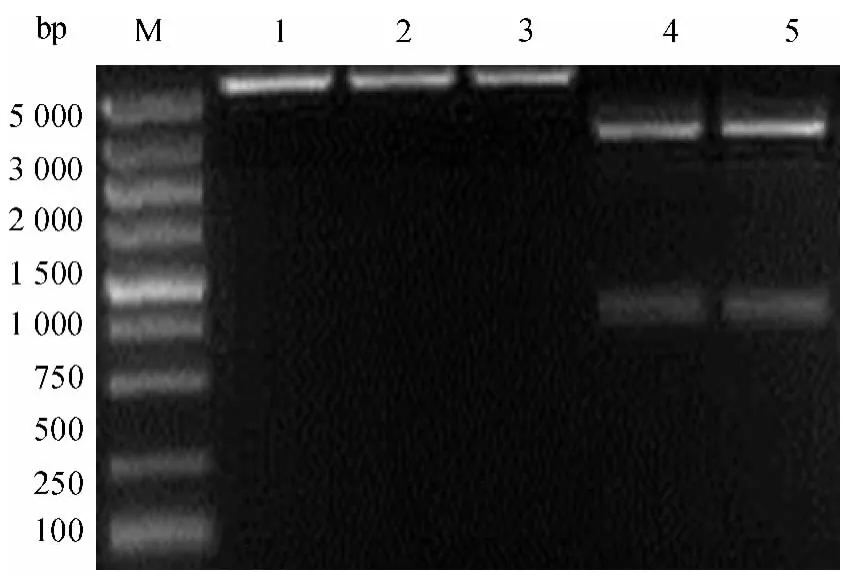
图2 重组转移质粒pFastBac-EGT-dORF2 的酶切鉴定Fig.2 Identification of recombinant vector pFastBac-EGT-dORF2
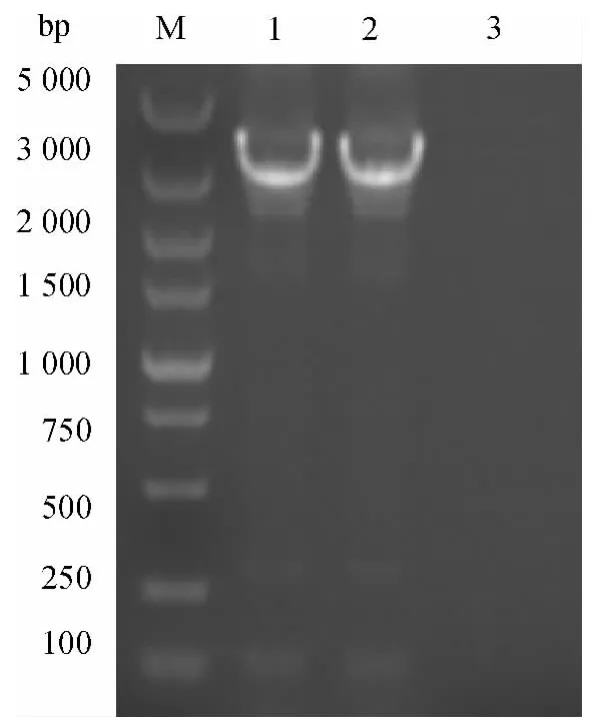
图3 重组穿梭载体Bacmid-EGT-dORF2 的PCR 鉴定Fig.3 Identification of recombinant transfer vector Bacmid-EGTdORF2 by PCR
2.4 重组杆状病毒Bv-EGT-dORF2 的鉴定
利用脂质体转染法,将提取的重组穿梭载体Bacmid-EGT-dORF2 转染Sf9 细胞,于27℃培养,72 h 出现细胞病变,主要表现为细胞变大、变圆、折光率增强、膨胀等(图4).
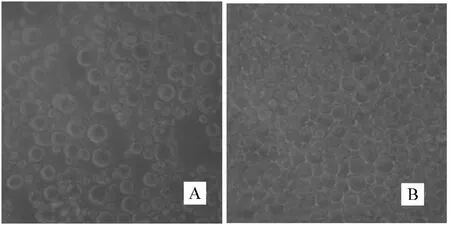
图4 重组穿梭载体Bacmid-EGT-dORF2 转染Sf9 细胞Fig.4 Transfeccted insect cells by recombinant transfer vector Bacmid-EGT-dORF2
2.5 间接免疫荧光鉴定Cap 蛋白的表达
重组杆状病毒感染Sf9 细胞后,进行间接免疫荧光试验.结果显示,重组杆状病毒Bv-EGT-dORF2 感染Sf9 细胞后,能够与抗PCV2 血清发生特异性的免疫反应,发出特异性的免疫荧光,并且荧光信号主要分布在细胞膜上(图A),而野毒感染组未出现任何荧光(图B),表明重组杆状病毒成功表达Cap 蛋白(图5).
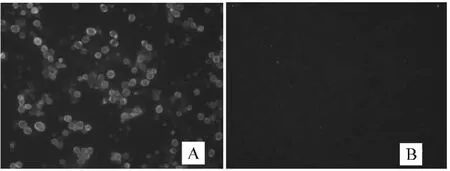
图5 重组杆状病毒Bv-EGT-dORF2 的间接免疫荧光实验Fig.5 Indirect immunofluorescence of the recombinant baculovirus Bv-EGT-dORF2
2.6 Western-blot 鉴定Cap 蛋白的表达
Sf9 昆虫细胞感染Bv-EGT-dORF2 后72 h,收集细胞,进行Western-blot 鉴定,在相对分子质量为28 000处出现特异性条带,而野生杆状病毒对照组则未出现条带.表明重组杆状病毒能够在Sf9 细胞表达具有生物活性的Cap 蛋白(图6).

图6 重组杆状病毒Bv-EGT-dORF2 的Western-blot 鉴定Fig.6 Identification of recombinant baculovirus Bv-EGT-dORF2 by Western-blot
3 讨论
Cap 蛋白为PCV2 的核衣壳蛋白,是该病毒唯一的结构蛋白,同时也是病毒主要的免疫原性蛋白,所以关于PCV2 诊断和基因工程疫苗的研究,都集中在Cap 蛋白上[8-9].Cap 蛋白的表达作为一个研究的热点,已在不同系统中获得表达.陈春丽等[10]利用pCold-SUMO 原核表达系统实现了Cap 蛋白的可溶性高效表达.宋云峰等[11]利用伪狂犬病毒作为载体,表达了Cap 蛋白.欧阳素贞等[12]利用重组腺病毒载体成功表达了Cap 蛋白.樊惠英[13]利用Bac-to-Bac杆状病毒表达系统表达了PCV2 Cap 蛋白,并对所表达的重组Cap 的亚细胞定位进行了研究.王彦彬等[14]、Yamaji 等[15]和Golden 等[16]通过引入一些信号肽实现目的蛋白的分泌表达.
Cap 蛋白的N 端65aa~87aa、113aa~147aa、157aa~183aa 区域为病毒的主要抗原位点[17-18],其中N 端69~83aa 和117aa~131aa 抗原位点是型特异性的PCV2 抗原位点,但由于ORF2 基因编码的N端41 个氨基酸为核定位信号肽[19],不包含主要的抗原区域,但使得Cap 蛋白定位于细胞核.不利于其抗原表位的展示,导致该蛋白的免疫原性不强,也不利于该蛋白的后期纯化.因此,本研究通过引入EGT 分泌型信号肽取代ORF2 原有核定位信号肽(NLS),构建了介导分泌表达PCV2 Cap 的重组杆状病毒.
间接免疫荧光试验表明,被重组杆状病毒感染的Sf9 昆虫细胞显示很强的荧光信号,并且其荧光主要分布在细胞膜上,表明重组蛋白是以分泌型的形式进行表达.进一步对重组杆状病毒Bv-EGT-dORF2进行Western-blot 鉴定,在相对分子质量28 000 处出现特异性条带,而野生杆状病毒对照组则未出现条带,表明重组杆状病毒能够表达具有生物活性的Cap蛋白.但是在Sf9 培养上清液中未检测到Cap 蛋白的表达,经过分析,其原因可能是由于EGT 信号肽为外源信号肽,而非来自Sf9 细胞,因此,表达的Cap 蛋白虽然可以通过EGT 信号肽引导分泌到细胞外,但却不能被Sf9 细胞所识别,不能被正确剪切掉,导致细胞培养上清液中的Cap 蛋白很少,从而检测不到该蛋白的表达.这也与王彦彬等[14]的研究结果一致.
同时,本研究在Cap 蛋白的C 端融合进去6 个His 标签,方便目的蛋白的后期纯化过程[20].并对病毒感染后最佳收毒时间进行了筛选和优化,结果表明,感染后72 h 时细胞病变最为明显,间接免疫荧光最亮,表明此时蛋白的表达量最高,时间过长会产生大量的细胞碎片,荧光反而会减弱.
本研究通过引入EGT 分泌型信号肽,构建了介导分泌表达Cap 蛋白的重组杆状病毒,成功实现了PCV2 Cap 蛋白的表达,但未有效地分泌到上清液中,因此,我们下一步的工作将继续试用来源于Sf9细胞或者能被Sf9 细胞所识别的信号肽,来提高细胞培养上清液中目的蛋白的表达量.
[1]ALLAN G M,MEEHAN B,TODD D,et al.Novel porcine circoviruses from pigs with wasting disease syndromes[J].Vet Rec,1998,142(7):467-468.
[2]ALLAN G M,McNEILLY E,KENNEDY S,et al.PCV-2-associated PDNS in Northern Ireland in 1990[J].Vet Rec,2000,146(24):711-712.
[3]KIM J,CHUNG H K,CHAE C.Association of porcine circovirus 2 with porcine respiratory disease complex[J].Vet J,2003,166(3):251-256.
[4]RAMAMOORTHY S,MENG Xiangjin.Porcine circoviruses:A minuscule yet mammoth paradox[J].Anim Health Res Rev,2009,10(1):1-20.
[5]朗洪武,张广川,吴发权.断奶猪多系统衰竭综合征血清抗体检测[J].中国兽医科技,2000,30(3):3-5.
[6]张朝霞,刘长明,危艳武.猪圆环病毒2 型ELISA 抗体检测试剂盒的研制及应用[J].中国预防兽医学报,2008,30(7):548-578.
[7]MANKERTZ A,MANKERTZ J,WOLF K,et al.Identification of a protein essential for replication of porcine circovirus[J].J Gen Virol,1998,79(2):381-384.
[8]NAWAGITGUL P,MOROZOV I,BOLIN S R,et al.Open reading frame 2 of porcine circovirus type 2 encodes a major capsid protein[J].J Gen Virol,2000,81(9):2281-2287.
[9]LEKCHAROENSUK P,MOROZOV I,PAUL P S,et al.Epitope mapping of the major capsid protein of type 2 porcine circovirus (PCV2)by using chimeric PCV1,PCV2[J].J Virol,2004,78(15):8135-8145.
[10]陈春丽,郭宇飞,陈筱薇,等.利用SUMO 系统高效表达可溶性的PCV2 Cap 蛋白[J].华南农业大学学报,2012,33(3):393-397.
[11]宋云峰,肖少波,曹胜波,等.猪2 型圆环病毒Cap 蛋白在伪狂犬病毒中的表达[J].中国兽医学报,2007,27(2):155-158.
[12]欧阳素贞,张福良,王双山,等.猪圆环病毒2 型Cap 蛋白重组腺病毒的构建及表达[J].中国预防兽医学报,2008,30(3):165-168.
[13]樊惠英.猪圆环病毒2 型基因工程疫苗的研究[D].武汉:华中农业大学,2007.
[14]王彦彬,崔保安,陈红英,等.猪干扰素α 在昆虫细胞中分泌表达及抗病毒活性检测[J].中国农业科学,2009,42(4):1435-1441.
[15]YAMAJI H,SEGAWA M,NAKAMURA M,et al.Production of Japanese encephalitis vurus-like particles using the baculovirus-insect cell system[J].J Biosci Bioeng,2012,114(6):1-6.
[16]GOLDEN A,AUSTEN D A,VAN SCHRAVENDIJK M R,et al.Effect of promoters and signal sequences on the production of secreted HIV-1 gp120 protein in the baculovirus system[J].Protein Expr Purif,1998,14(1):8-12.
[17]LOU Zhongzi,LI Xuerui,LI Zhiyong,et al.Expression and antigenicity characterization for truncated capsid protein of porcine circovirus type 2[J].Can J Vet Res,2011,75(1):61-64.
[18]MAHE D,BLANCHARD P,TRUONG C.Differential recognition of ORF2 protein from type 1 and type 2 porcine circoviruses and identification of immunorelevant epitopes[J].J Gen Virol,2000,81(7):1815-1824.
[19]LIU Qiang,TIKOO S K,BABIUK L A.Nuclear localization of the ORF2 protein encoded by porcine circovirus type 2[J].Virology,2001,285(1):91-99.
[20]KOHO T,MÄNTYLÄ T,LAURINMÄKI P,et al.Purification of norovirus-like particles(VLPs)by ion exchange chromatography[J].J Virol Methods,2012,181(1):6-11.
[21]COX M M.Recombinant protein vaccines produced in insect cells[J].Vaccine,2012,30(10):1759-1766.
