中波紫外线诱导小鼠皮肤急性光损伤模型中ASC和caspase-1的表达
2013-08-27杨闰平李恒进
胡 坚,杨闰平,李恒进,赵 华
解放军总医院 皮肤科,北京 100853
急性光损伤是皮肤对日光中中波紫外线(ultraviolet B,UVB)产生的一种急性炎症反应,正常皮肤在单次过度照射UVB后即可引起这种局部炎症反应。急性光损伤的机制及防治一直是人们普遍关注的问题,研究认为多种细胞因子参与了其发病过程。凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a CARD,ASC)属于死亡结构域超家族成员,由N端的热蛋白结构域(pyrindomain,PYD)和C端的caspase募集结构域(caspase activation and recruitment domain,CARD)构成,在肺、肝、结肠、卵巢、皮肤、眼、白细胞和淋巴细胞等组织和细胞表达,在先天性和适应性免疫应答、炎症反应、细胞凋亡及调节趋化因子的活性、淋巴细胞的趋化性、抗原的摄取和呈递等方面具有一定的意义[1-2],而半胱氨酸蛋白酶caspase-1作为ASC的一种常见下游因子参与了ASC引起的多种生理及病理过程[3]。Watanabe和Feldmeyer等发现ASC和caspase-1在UVB照射后的人角质形成细胞中表达增强,提示ASC和caspase-1可能参与了UVB所致急性光损伤的发病过程[4-5]。因此本实验通过观察ASC和caspase-1在UVB诱导的急性光损伤皮损中的表达,探讨其在急性光损伤发病中的可能机制。
材料和方法
1 实验动物 SPF级雌性BALB/c小鼠共30只,6~8周龄,体质量18~20 g。小鼠购自北京维通利华实验动物技术有限公司(许可证编号:SCXK(京)2011-0004),饲养于解放军总医院实验动物中心。
2 试剂和仪器 小鼠ASC、caspase-1单克隆抗体,Abcam公司;UVB灯管(TL20W/12RS), PHLIPS公司。
3 小鼠急性光损伤模型的建立 辐照计测定UVB灯管波长为280~320 nm,距离灯管20 cm处辐照强度为0.33 mW/cm2。固定照射距离为20 cm,根据辐射时间(s)=所需照射剂量(mJ/cm2)/辐照强度(mW/cm2)确定辐照时间。预实验测定MED:将10只小鼠分为5组,每组2只,参考国内外文献[6-7],分别对耳部照射30、90、150、300、600 mJ/cm2剂量的UVB,测得MED约为90 mJ/cm2。观察不同剂量UVB照射小鼠耳部临床和组织病理表现,实验组鼠耳采用4倍MED即360 mJ/cm2剂量给予单次照射,表现与急性光损伤的表现一致[8-9]。实验组操作如下:预热UVB灯管5 min,将小鼠固定于工作台上。小鼠随机分为对照组和实验组,每组10只,对照组不照射UVB,实验组照射4倍MED剂量UVB。观察实验组的光损伤变化,于照射后24 h取小鼠耳。
4 免疫组化检测皮肤ASC和caspase-1 分别取实验组和对照组小鼠耳, 4%甲醛固定,梯度乙醇脱水,二甲苯透明,石蜡包埋。采用Elivision法,2 μm厚度连续切片,高压锅加热修复,双氧水消除过氧化酶。分别滴加1∶100 ASC和1∶100 caspase-1一抗,4 ℃湿盒过夜后PBS洗3次,每次3 min,滴加二抗,室温静置20 min后PBS洗3次,再加三抗,静置20 min,PBS洗3次。DAB显色,苏木精复染,脱水、透明、中性树胶封片。以PBS代替一抗作阴性对照。
5 结果判定 由两名医生对免疫组化染色切片进行评估。在显微镜下观察表皮细胞着色情况,每张阳性切片随机选取5个高倍视野(×400),各计数100个角质形成细胞中阳性细胞所占的百分比,根据阳性细胞比例,无阳性染色为0分、0~25%为1分、26%~50%为2分、51%~75%为3分、≥76%为4分;并按染色强度无、弱、中、强分别计为0~3分。综合两个指标将评分分为4级,0分为阴性、1~3分为弱阳性、4~5分为阳性、6~7分为强阳性。
6 统计学方法 应用SPSS17.0统计软件,两独立样本非正态分布定量资料采用Wilconxon秩和检验,P<0.05为差异有统计学意义。

图1 左侧为对照组小鼠,右侧为实验组小鼠Fig.1 Mice in the blank control group (left)and experimental group (right)

图2 小鼠急性光损伤模型(HE×100) 对照组(左);实验组(右)Fig.2 UVB-induced light injury model in blank control group (left)and experimental group (right)(HE×100)
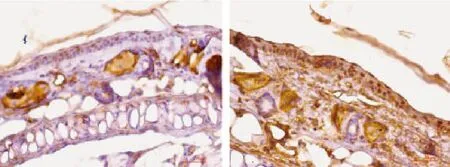
图3 ASC在小鼠耳部皮肤的表达 对照组(左);实验组(右)Fig.3 Immunohistochemical staining showing expressions of ASC-like protein in blank control group (left) and experimental group (right)
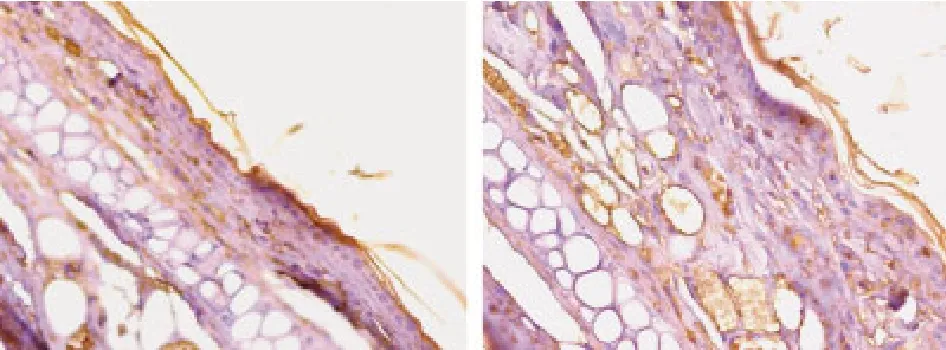
图4 caspase-1在小鼠耳部皮肤的表达 对照组(左);实验组(右)Fig.4 Immunohistochemical staining showing expressions of caspase-1 in blank control group(left) and experimental group (right)
结 果
1 小鼠皮肤急性光损伤模型 与对照组相比,4倍MED剂量UVB照射的实验组小鼠24 h后耳部皮肤水肿、增厚,出现红斑、毛细血管扩张。见图1。组织病理改变,HE染色显示表皮细胞增生、水肿、部分细胞空泡形成、核固缩,真皮乳头浅层水肿、血管扩张、管周淋巴细胞浸润。见图2。临床表现和组织病理均符合急性光损伤表现。
2 免疫组化结果 1)ASC在小鼠耳部表皮的表达:对照组小鼠耳部表皮部分细胞胞浆和胞核染为浅棕黄色,染色评分中位数为1.23;照射4倍MED的实验组鼠耳部表皮细胞水肿,排列紊乱,表皮全层细胞胞浆和胞核染为深棕黄色,ASC表达增强,染色评分中位数为4.11,两组间差异有统计学意义 (t=65.0,P< 0.01)。见图 3。2)caspase-1在小鼠耳部表皮的表达:对照组小鼠耳部表皮部分细胞胞浆和胞核染为浅棕黄色,染色评分中位数为1.16;照射4倍MED的实验组鼠耳部表皮细胞水肿,排列紊乱,染为棕黄色,且阳性染色细胞增多,caspase-1表达增强,染色评分中位数为1.59,两组间差异有统计学意义(t=56.5,P<0.01)。见图4。
讨 论
国内外虽不乏关于急性光损伤的研究,但目前尚未形成统一的动物模型,不同模型的差异主要表现在:1)实验动物:国外最多采用SKH-1无毛小鼠,其优点在于皮肤裸露便于照射,且具有胸腺,免疫功能正常[6]。而国内多采用Balb/C小鼠剃毛后照射UVB[7]。2)照射部位:因小鼠背部体表面积较大,实验多对背部进行照射。3)光源:采用日光模拟器或紫外荧光灯,UVB波长约为290~320 nm。4)UVB照射方法:国外SKH-1小鼠多采用UVB单次照射,剂量为 200、360、800 mJ/cm2不等[6];Sumiyoshi等对C57BL/6J小鼠进行UVB 120 mJ/cm2(约为3.3MED)照射[8]。而国内多对Balb/C小鼠进行180 mJ/cm2单次或多次照射[7]。5)评判标准:以临床表现为红斑、水肿;组织病理表现为表皮细胞水肿、空泡形成、核固缩,表皮内或表皮下水疱形成,真皮血管扩张等为急性光损伤特征[6,8]。本实验采用UVB单次照射Balb/C小鼠,选取毛发较少的耳部皮肤,借鉴国内外经验,并根据测定的MED以及观察剂量的小鼠耳部红斑反应,确定采用4倍MED剂量,临床及组织病理表现与急性光损伤基本符合,认为造模成功。
以往研究认为,UVB引起的急性光损伤主要表现为急性炎症反应和细胞凋亡两个方面。1)急性炎症反应:UVB照射后诱导生成的ROS作为第二信使通过p38MAPK、ERK1/2信号转导通路激活转录因子c-Jun、c-Fos、NF-kB,诱导角质形成细胞生成前炎性因子IL-1β、IL-6、IL-8、TNF-α,促进角质形成、细胞增殖及中性粒细胞、淋巴细胞等的浸润;UVB还可激活环氧合酶COX-2,进一步诱导合成PGE2、VEGF、MMPs、ICAM-1、PECAM-1等,促进炎症反应及血管生成。2)细胞凋亡:DNA可直接吸收UVB,在相邻嘧啶碱基之间形成二聚体光产物。此外,UVB诱导生成过量的活性氧及氮簇,超过了机体的清除能力,引起多种形式的DNA损伤如单链断裂、链间交联、碱基修饰等。
研究显示,ASC可通过多种途径发挥生物学作用[2-3]:1)参与形成NLRP3炎症小体以参与炎症反应。2)通过寡聚形成超分子结构即焦亡小体调节细胞焦亡。3)参与细胞凋亡过程。在UVB引起的急性光损伤中,一方面低剂量UVB诱导产生大量ROS,并使细胞内Ca2+升高,ROS和Ca2+作为危险因子促使ASC参与形成NALP3炎症小体。ASC作为接头蛋白连接前caspase-1,使caspase-1自分裂、活化,并进一步促使前IL-1β和前IL-18裂解成为活性IL-1β和IL-18,诱导其他炎症细胞因子如IL-6、趋化因子、黏附分子等的合成,放大局部炎症反应[9]。另一方面,UVB也可能通过ROS增强ASC的表达诱导细胞焦亡。焦亡是新近发现的一种新的由caspase-1介导的伴有大量炎症因子释放的细胞程序性死亡方式,ASC寡聚形成超分子功能性复合体通过caspase-1促使DNA的降解,并可导致细胞膜的完整性丧失,从而使胞内容物释放,加重炎症反应[2]。本实验结果显示经4倍MED的UVB照射后,实验组小鼠耳部表皮细胞ASC和caspase-1表达较对照组增强,提示ASC和caspase-1参与了小鼠急性光损伤的发病过程,具体机制有待进一步研究。
1 Hassan H, Amer AO. Cell intrinsic roles of apoptosis-associated speck-like protein in regulating innate and adaptive immune responses[J]. ScientificWorldJournal, 2011, 11 :2418-2423.
2 de Alba E. Structure and interdomain dynamics of apoptosisassociated speck-like protein containing a CARD (ASC)[J]. J Biol Chem, 2009, 284(47): 32932-32941.
3 Motani K, Kushiyama H, Imamura R, et al. Caspase-1 protein induces apoptosis-associated speck-like protein containing a caspase recruitment domain (ASC)-mediated necrosis independently of its catalytic activity[J]. J Biol Chem, 2011, 286(39): 33963-33972.
4 Feldmeyer L, Keller M, Niklaus G, et al. The inflammasome mediates UVB-induced activation and secretion of interleukin-1beta by keratinocytes[J]. Curr Biol, 2007, 17(13): 1140-1145.
5 Watanabe H, Gaide O, Pétrilli V, et al. Activation of the IL-1betaprocessing inflammasome is involved in contact hypersensitivity[J].J Invest Dermatol, 2007, 127(8): 1956-1963.
6 Svobodová AR, Galandáková A, Sianská J, et al.Acute exposure to solar simulated ultraviolet radiation affects oxidative stress-related biomarkers in skin, liver and blood of hairless mice[J].Biol Pharm Bull, 2011, 34(4):471-479.
7 袁李梅, 李杨, 刘流, 等. 绞股蓝皂甙对光损伤小鼠皮肤PCNA表达的影响[J].昆明医学院学报,2010,31(11):41-46.
8 Sumiyoshi M, Kimura Y. Effects of olive leaf extract and its main component oleuroepin on acute ultraviolet B irradiation-induced skin changes in C57BL/6J mice[J]. Phytother Res, 2010, 24(7): 995-1003.
9 Cheng J, Waite AL, Tkaczyk ER, et al. Kinetic properties of ASC protein aggregation in epithelial cells[J]. J Cell Physiol, 2010, 222(3): 738-747.
