采用Red重组系统敲除铜绿假单胞菌弹性蛋白酶基因
2013-08-21熊浚智何晓梅盛哈蕾蔡文强张克斌
余 华,熊浚智,何晓梅,盛哈蕾,蔡文强,谢 玮,张克斌
铜绿假单胞菌(Pseudomonasaeruginosa,Pa)又称绿脓杆菌,是临床最常见的条件致病菌,具高度的环境适应力和耐药性。在烧伤、创伤、免疫缺陷、器官移植、肺囊性纤维化及一些医院感染病人中引起严重感染。Pa弹性蛋白酶(elastase,LasB)由lasB基因编码[1],是其最主要的分泌型蛋白酶及毒力因子,与其致病性密切相关。目前对弹性蛋白酶在该菌侵袭力和致病性中的作用有一些研究[2],但尚欠系统和深入。如果能获得无弹性蛋白酶活性的Pa菌株,将为更全面深入研究弹性蛋白酶在Pa中的致病机理,以及细菌与宿主相互关系等方面提供材料和基础。
近年来发展起来的利用λ噬菌体Red重组酶的同源重组系统,具有重组效率高、所需同源序列短、可定点进行基因敲除、敲入、点突变等操作的特点[3]。目前,Red重组酶系统已广泛应用于大肠杆菌、痢疾杆菌、沙门氏菌等细菌的基因修饰中[4-5],但现有的Red重组酶质粒(如p KD46)所具有的温敏性复制子oriR101和rep A不能在Pa中进行复制,从而极大地限制了其在Pa基因修饰中的运用。然而含有p RO1610复制子的p UCP系列质粒,可在Pa、大肠杆菌及多种革兰氏阴性菌中稳定复制[6]。为此,本研究通过构建含有Red重组酶基因的穿梭质粒p UCP-Red,采用双臂同源重组法以获取敲除lasB基因的Pa菌株。
1 材料与方法
1.1 菌株和质粒 大肠杆菌DH5α、Pa野生株(PAO1)为本室保存。质粒pJQ200SK由第三军医大学微生物教研室李明博士惠赠;p KD46、p MD18T和p UCP载体为本室保存。1.2 主要试剂和仪器 DNA限制性核酸内切酶购于Ta KaRa公司;DNA连接酶、聚合酶和荧光定量PCR酶购于TOYOBO核酸公司;细菌基因组提取、胶回收和质粒提取试剂盒购于天根生物公司;电转仪购于Bio-Rad公司。
1.3 实验所用PCR引物

表1 实验所用PCR引物Tab.1 PCR primers used in this study
1.4 实验步骤
1.4.1 PAO1/p UCP-Red基因敲除体系构建
1.4.1.1 p UCP-Red质粒构建 设计特异性 PCR引物,见表1。从p KD46上扩增Red重组酶基因 (含有受阿拉伯糖启动子调控的exo、bet和gam基因)。通过常规的酶切、连接、转化等基因操作方法构建DH5α/p UCP-Red重组菌。
1.4.1.2 PAO1/p UCP-Red菌 株 的 构 建 及 筛 选 挑 取PAO1单菌落接种于LB培养基中,37℃过夜培养后,按1∶100转接LB培养基,37℃220 r/min快速振摇3 h(OD600约为0.4~0.5)。离心收集菌体沉淀并用10%甘油洗涤4次,按每100 m L培养所得菌体加入100μL 10%甘油重悬,制备电转感受态细胞。取1μg p UCP-Red质粒电击转化PAO1感受态细胞,电击条件25μF、200Ω、2.5 k V。电击后菌液立即转入LB培养基中,180 r/min振摇2 h后,涂布含有羧苄青霉素(300μg/m L)的LB平板,37℃培养24 h~48 h挑取单菌落,采用PCR鉴定质粒是否成功转化(引物见表1)。
1.4.2 PAO1lasB基因敲除株的构建
1.4.2.1 线性打靶片段的制备 线性打靶片段的构建参照文献进行[7]。打靶片段前臂、后臂(lasB基因编码区上游或下游)和庆大霉素抗性基因引物,见表1。
1.4.2.2 PAO1/p UCP-Red电转感受态的制备 PAO1/p UCP-Red感受态的制备参照上述感受态制备方法和文献[7]进行。
1.4.2.3lasB基因敲除株的筛选 从羧苄青霉素(300μg/mL)和庆大霉素(200μg/m L)双抗性平板上挑取单菌落经培养后,提取基因组DNA,通过PCR鉴定(引物见表1),筛选发生正确重组的lasB基因敲除株。
1.4.3lasB基因敲除株的鉴定
1.4.3.1lasB基因转录情况鉴定 常规LB培养细菌后,提取其总RNA并反转录为cDNA,方法按试剂盒说明书进行。以cDNA为模板PCR扩增lasB基因,检测该基因的mRNA转录情况,引物见表1。
1.4.3.2 弹性蛋白酶活性测定 通过牛奶平板法,检测lasB基因敲除株弹性蛋白酶活性,方法参照文献进行[8]。
2 结 果
2.1 p UCP-Red质粒的构建 采用Red FP和Re-d RP引物成功扩增了分子量约为3 400 bp的Red重组酶基因(包括exo、beta、gam3个基因)。p UCPRed质粒经PCR和测序鉴定,所构建的red基因核酸序列与理论序列完全一致,PCR结果见图1。
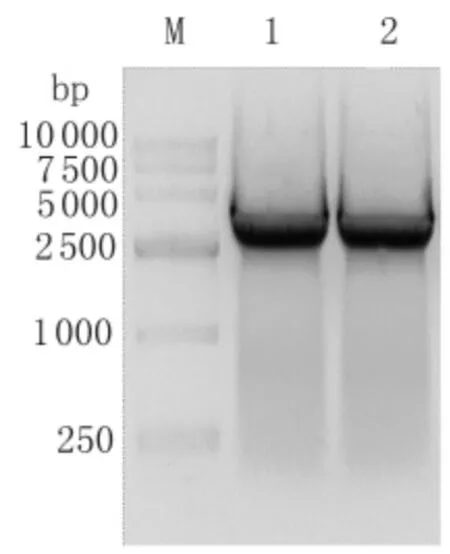
图1 重组质粒pUCP-Red中red基因的PCR鉴定M:DL15000 Marker;1,2:red基因PCR鉴定结果Fig.1 PCR analysis of red gene cloned into vector pUCP-Red M:DL15000 Marker;1,2:PCR amplification results of red gene
2.2 线性打靶片段的制备 以PAO1基因组DNA为模板,分别扩增出两端与lasB基因上下游序列同源的80 bp前臂和后臂;以pJQ200SK质粒为模板,扩增了835 bp的庆大霉素抗性基因。通过FAFP和BARP引物,可扩增全长约为1 000 bp的线性打靶片段,如图2所示,且经进一步测序鉴定,线性打靶序列与理论序列完全一致。
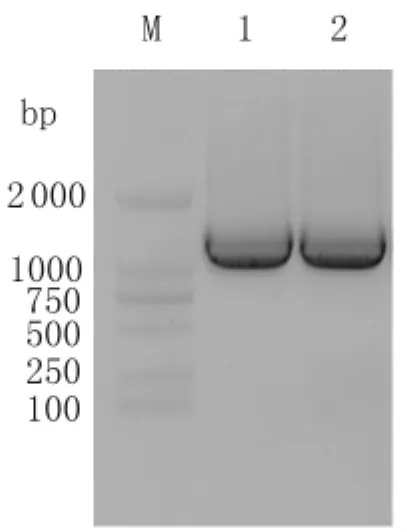
图2 线性打靶片段的PCR鉴定M:DL15000 Marker;1,2:线性打靶片段的PCR鉴定结果(FAFP和BARP引物鉴定)Fig.2 PCR analysis of recombinant DNA fragment used for knocking out the lasB gene of PAO1M:DL15000 Marker;1,2:PCR amplification results of recombinant DNA fragment(amplified by FAFP and BARP primers)
2.3lasB基因敲除株的PCR鉴定 若未发生同源重组的菌株,通过敲除基因外侧引物JDFP和JDRP(上下游引物分别位于lasB基因-431~-413和+181~+199)可从PAO1基因组DNA上扩增出约2 130 bp的lasB基因及基因组序列;而发生正确重组的lasB基因敲除株则可扩增出约1 300 bp的线性打靶片段和部分基因组序列。通过JDFP和JDRP引物PCR鉴定可见,对照组PAO1、PAO1/p UCP-Red菌株和发生正确重组的lasB基因敲除株均扩增出了与理论相符的DNA序列长度。此外,通过线性打靶基因的前臂上引和后臂下引扩增出了约1 000 bp的打靶基因DNA序列,从而从分子水平上证明lasB基因成功敲除,结果见图3。
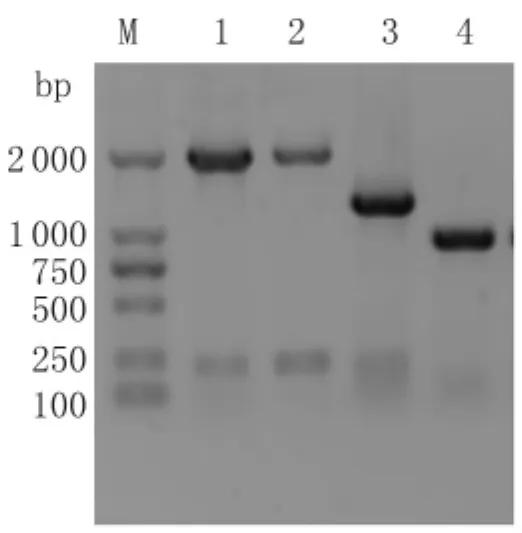
图3 lasB基因敲除株PCR鉴定M:DL2000 Marker;1:PAO1野生株(JDFP和JDRP引鉴定);2 :PAO1/p UCP-Red(JDFP和JDRP 引 鉴定);3:lasB 基因敲除株(JDFP和JDRP引鉴定);4:lasB基因敲除株(FAFP和BARP引物鉴定)Fig.3 PCR results of PAO1 knocked out of lasB geneM:DL2000 Marker;1:PAO1 wild type(amplified by JDFP and JDRP primers);2:PAO1/p UCP-Red(amplified by JDFP and JDRP primers);3:lasB gene knocked-out strain (amplified by JDFP and JDRP primers);4:lasB gene knocked-out strain(amplified by FAFP and BARP primers)
2.4 阳性重组菌弹性蛋白酶基因转录情况 通过RT-PCR法鉴定阳性重组菌中弹性蛋白转录情况,未发现有弹性蛋白酶基因的mRNA的转录。结果见图4。
2.5lasB基因敲除株的弹性蛋白酶检测 弹性蛋白酶能够降解牛奶平板中的酪蛋白形成透明环,因此,利用牛奶平板可直观的检测菌株弹性蛋白酶的分泌情况。与PAO1野生株相比,lasB基因敲除株细菌培养液中未检测到弹性蛋白酶活性,结果见图5。
3 讨 论
Pa弹性蛋白酶是其最为重要的致病因子之一,它可降解宿主细胞基质分子、各种胶原、肺上皮细胞表面活性蛋白A和D[9],其降解产物可抑制内源性抗菌物质和其它抗菌肽活性[10]。这些研究揭示了弹性蛋白酶在Pa致病性方面的重要性,但其对Pa自身代谢有何影响?缺乏弹性蛋白酶的Pa对宿主整体的致病性有何不同?目前对这些方面尚缺乏系统深入的研究。因此,本研究以获得无弹性蛋白酶活性的Pa菌株,为进一步研究弹性蛋白酶的致病机理奠定基础。
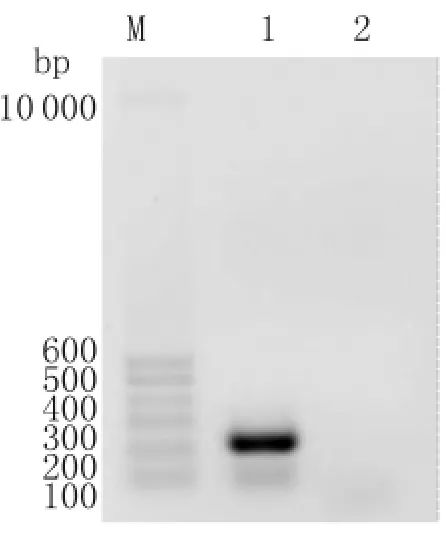
图4 弹性蛋白酶编码区mRNA的RT-PCR产物电泳图M:Markers;1:PAO1株弹性蛋白酶编码区mRNA的RT-PCR产物;2:lasB基因敲除株弹性蛋白酶编码区m RNA的RT-PCR产物Fig.4 RT-PCR products of elastase mRNAM:Markers;Line 1:RT-PCR products of elastase mRNA of PAO1;Line 2:RT-PCR products of elastase mRNA of lasB gene knocked-out strain

图5 平板法检测弹性蛋白酶活性检测图孔1、2:PAO1菌液104/m L×50μL×10 hrs;孔3、4:阳性重组菌菌液104/m L×50μL×10 hrsFig.5 Elastase activity measurement by milk plate methodHole 1 and 2:Bacteria culture of PAO1(104/mL×50μL×10 hrs);Hole 3 and 4:Bacteria culture of lasB gene knocked-out strain(104/m L×50μL×10 hrs)
λ噬菌体的Red重组体系由exo、beta和gam3个基因组成,分别编码Exo、Beta和Gam三种酶,其中Exo蛋白是一种核酸外切酶,可结合于双链DNA的末端,从5′端向3′端降解DNA,产生3′突出端;Beta蛋白可结合在单链DNA上,介导互补单链DNA退火,从而有利于线性片段与同源区发生重组置换;Gam蛋白可与细菌体内RecBCD酶结合抑制其核酸外切酶V活性,从而抑制外源DNA的降解[11-12]。采用Red重组系统进行双臂同源重组的基因敲除,其效率较传统的依赖于细菌体内固有的同源重组机制发生的重组高几十倍[13]。同时,在构建好线性打靶片段后,从转化到筛选获得阳性重组子,仅需2 d时间,运用该系统进行基因敲除,具有很高时效性。
文献报道及我们的实验表明,Red重组系统的重组效率与双臂同源片段的长度有明显相关性,同源片段越长,重组效率越高。文献报道所需同源臂长为50~100 bp即可满足重组需求,本研究采用的上、下臂同源片段长度为80 bp,获得了较高的重组效率(约80%),而采用该系统进行另一PAO1基因组DNA片段定点插入实验时,双臂长度选择了400 bp,其重组效率可达100%。
此外,由于Pa在液体培养中极易分泌胞外粘性物质(Extracellular polymeric substances,EPS),影响其感受态的制备及电转化效率。因此在制备感受态时,为了保证L-阿拉伯糖能充分诱导Red重组酶的表达且保持较低的菌液粘性物质,在菌液刚出现浑浊(OD600约为0.1)时,即可加入L-阿拉伯糖进行诱导,观察菌液及时终止诱导并制备感受态(一般1~3h)。
本实验通过打靶片段电击转化,经1%L-阿拉伯糖诱导表达了Red重组酶的PAO1/p UCP-Red感受态细胞,成功筛选到了PAO1的lasB基因敲除株,表明该Red重组体系可有效的运用于Pa的基因修饰。
同时,因p UCP质粒能在如大肠杆菌等多种革兰氏阴性菌中进行复制,本研究所构建的p UCPRed质粒还可用于这些菌株的基因敲除、定点突变、基因敲入等多种基因修饰中,但其效果仍需进一步实验证明。
[1]Stover C,Pham X,Erwin A,et al.Complete genome sequence ofPseudomonasaeruginosaPAO1,an opportunistic pathogen[J].Nature,2000,406(6799):959-964.DOI:10.1038/35023079
[2]Leduc D,Beaufort N,De Bentzmann S,et al.ThePseudomonas aeruginosaLasB metalloproteinase regulates the human urokinase-type plasminogen activator receptor through domain-specific endoproteolysis[J].Infect Immun,2007,75(8):3848-3858.DOI:10.1128/IAI.00015-07
[3]Isaacs FJ,Carr PA,Wang HH,et al.Precise manipulation of chromosomes invivoenables genome-wide codon replacement[J].Science,2011,333(6040):348-353.DOI:10.1126/science.1205822
[4]Wu T,Grassel C,Levine MM,et al.Live attenuatedShigella dysenteriaetype 1 vaccine strains overexpressing Shiga toxin B subunit[J].Infect Immun,2011,79(12):4912-4922.DOI:10.1128/IAI.05814-11
[5]Poteete AR,Fenton AC.Genetic requirements of phageλRedmediated gene replacement inEscherichiacoliK-12[J].J Bacteriol,2000,182(8):2336-2340.
[6]Silo-Suh LA,Elmore B,Ohman DE,et al.Isolation,characterization,and utilization of a temperature-sensitive allele of aPseudomonasreplicon[J].J Microbiol Methods,2009,78(3):319-324.DOI:10.1016/j.mimet.2009.07.002
[7]Liang RB,Liu JH.Scarless and sequential gene modification in Pseudomonas using PCR product flanked by short homology regions[J].BMC Microbiol,2010,10:209.DOI:10.1186/1471-2180-10-209.
[8]Huang CJ,Zhou SW,Qian GS,et al.High level expression of elastase fromPseudomonasaeruginosa[J].Chin J Zoonoses,2005,21(4):294-297.(in Chinese)
黄春基,周世文,钱桂生,等.铜绿假单胞菌弹性蛋白酶的高效表达[J].中国人兽共患病杂志,2005,21(4):294-297.
[9]Mariencheck WI,Alcorn JF,Palmer SM,et al.Pseudomonas aeruginosaelastase degrades surfactant proteins A and D[J].Am J Respir Cell Mol Biol,2003,28(4):528.DOI:10.1165/rcmb.2002-0141OC.
[10]Schmidtchen A,Frick IM,Andersson E,et al.Proteinases of common pathogenic bacteria degrade and inactivate the antibacterial peptide LL-37[J].Mol Microbiol,2002,46(1):157-168.DOI:10.1046/j.1365-2958.2002.03146.x
[11]Murphy KC.The lambda Gam protein inhibits RecBCD binding to dsDNA ends[J].J Mol Biol,2007,371(1):19-24.DOI:10.1016/j.jmb.2007.05.085
[12]Poteete AR.What makes the bacteriophageλRed system useful for genetic engineering:molecular mechanism and biological function[J].FEMS Microbiol Lett,2001,201(1):9-14.DOI:10.1016/S0378-1097(01)00242-7
[13]Tischer BK,von Einem J,Kaufer B,et al.Two-step red-mediated recombination for versatile high-efficiency markerless DNA manipulation inEscherichiacoli[J].Biotechniques,2006,40(2):191-197.
