不同倍性菘蓝对干旱胁迫的耐受能力及保护性酶的响应机制
2013-08-17王丽艳荆瑞勇郭永霞殷奎德
孙 强,王丽艳,荆瑞勇,郭永霞,殷奎德
(黑龙江八一农垦大学,黑龙江 大庆163319)
菘蓝(IsatisindigoticaFort.)为十字花科菘蓝属二年生草本植物,以干燥根及叶入药,分别称为板蓝根和大青叶,为常用中药材[1]。目前报道的菘蓝栽培品种主要有二倍体和四倍体两种倍性,有研究报道四倍体较二倍体中靛蓝、靛玉红、总氨基酸的含量均有明显提高[2],四倍体菘蓝根中游离氨基酸和水解氨基酸的含量均高于二倍体[3];二倍体菘蓝较同源四倍体具有中等偏高的遗传差异性[4];四倍体菘蓝体内超氧化物歧化酶的活性比二倍体的高[5]。在水分胁迫方面有对菘蓝生长发育和有效成分积累方面的研究[6],有对菘蓝幼苗生长和生理特性影响方面的研究[7],但其主要针对的是二倍体。有关二倍体和四倍体对干旱耐受能力的比较研究目前还未见报道。
干旱是限制植物基因表达、生长发育和产量的重要生态环境因素,对植物的危害在所有非生物胁迫中占居首位[8-9],因此,当前世界各国均对干旱下植物的生长状况给予了极大的关注。本试验以在MS培养基中加入不同浓度的甘露醇模拟干旱胁迫,研究不同干旱程度对不同倍性菘蓝种子萌发、幼苗生长和植物体内丙二醛、脯氨酸含量的变化来比较不同倍性菘蓝对干旱胁迫的耐受能力,通过对比其体内保护性酶超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)活性变化来揭示其内在机理,为深入了解不同倍性菘蓝的生长与生境的关系及其抗旱机制提供理论依据。
1 材料与方法
1.1 试验材料
供试材料为二倍体和四倍体菘蓝,购于毫州市春秋药材种业有限责任公司。
1.2 干旱胁迫处理方法
采用在MS培养基中加入不同浓度的甘露醇模拟干旱胁迫[10]。MS培养基中附加30g/L蔗糖、8 g/L植物琼脂,pH值为5.7,分别附加浓度为0,50,100,150,200,250,300,350,400mmol/L的甘露醇进行干旱胁迫处理,以不加甘露醇作为对照。
将二倍体和四倍体菘蓝种子去除种皮后用75%的乙醇处理5min,再用0.1%的升汞处理10min,最后用无菌水冲洗4~5遍,然后接种于上述不同处理的培养基中,每瓶20粒,每5瓶计为一个处理,每个处理重复10次,每个处理接种总计为50瓶,置于温度为(25±2)℃的组织培养室中进行培养,前三天进行暗培养,然后于光强1 500~2 000lx,每日光照时数14h的光照下培养,培养7d,每天统计发芽率。培养到第10d时进行相关指标测定。
1.3 测定项目
1.3.1 发芽率和发芽势
种子发芽率=种子正常发芽粒数/供试种子数×100%;
种子发芽势=种子第4d正常发芽粒数/供试种子粒数×100%。
1.3.2 根长、芽长、根重和芽重的测定 当种子接入培养基10d后,大部分已有真叶抽出,小心取出幼苗,用蒸馏水洗去残留的培养基,用一个透明的硬塑料板将幼苗压平展,与带刻度的标准直尺同时拍照。每个处理分别取20株幼苗进行拍照,然后用Image J软件进行分析[11]。拍完照片后,立刻将幼苗用解剖刀切成芽和根两部分,分别测定鲜重[12]。
1.3.3 丙二醛和脯氨酸含量的测定 将种子接种到培养基中10d后,取出幼苗测定植株茎叶中的丙二醛和脯氨酸的含量:丙二醛含量测定采用硫代巴比妥酸(TBA)比色法[13];脯氨酸含量的测定采用磺基水杨酸比色法[13]。
1.3.4 保护性酶SOD、POD、CAT活性测定 SOD采用氮蓝四唑(NBT)法进行测定[13];POD采用愈创木酚法,以每分钟内A470变化0.01为1个酶活性单位(U)[13];CAT的活性测定采用紫外吸收法进行测定,以每分钟内A240下降0.1的酶量为1个酶活单位(U)[14]。
1.4 统计分析
利用Excel和SPSS 13.0进行数据的统计分析。
2 结果与分析
2.1 不同干旱胁迫处理下不同倍性菘蓝的发芽率和发芽势
随着甘露醇浓度的增加,二倍体和四倍体菘蓝发芽率均呈下降趋势,随着发芽时间的增长差异逐渐减小(图1)。当甘露醇浓度为0~200mmol/L时第1天种子发芽率随着浓度的增加而降低,浓度大于200 mmol/L时,种子在第1天均不能发芽。从二倍体和四倍体的差异来看,二倍体菘蓝在甘露醇浓度为0,50mmol/L时第7天的发芽率达90%以上,分别为98%和100%,当甘露醇浓度为100,150,200mmol/L时发芽其发芽率均达80%以上,分别为89%、86%和83%,而当甘露醇浓度大于250mmol/L时发芽率迅速下降为60%左右,当甘露醇浓度达到400 mmol/L时,发芽率降低到50%以下。四倍体菘蓝在甘露醇浓度为0,50,100,150mmol/L时第7天的发芽率均达90%以上,分别为100%、99%、95%和92%,当甘露醇浓度为200,250mmol/L时发芽其发芽率均达80%以上,分别为89%和82%,而当甘露醇浓度大于300mmol/L时发芽率迅速下降为60%左右,当甘露醇浓度达到400mmol/L时,发芽率降低到50%以下。由此可分析得出当甘露醇浓度为100~250mmol/L时对两种倍性菘蓝的发芽率影响有差异,四倍体的发芽率要高于二倍体,对二倍体的影响要大于四倍体,而高于或低于此范围时的影响是相同的。因此可以得出,相对低浓度的甘露醇(100~250mmol/L)胁迫下四倍体菘蓝对干旱胁迫的耐受性要高于二倍体菘蓝。

图1 不同浓度甘露醇处理对菘蓝发芽率的影响
根据统计得到的发芽率,计算得到不同倍性菘蓝的发芽势,结果如图2所示。从总体趋势来看,二倍体和四倍体菘蓝的发芽势随着甘露醇浓度的增加均呈现逐渐下降的趋势。在甘露醇浓度为0~250 mmol/L(150mmol/L除外),四倍体的发芽势均高于二倍体,尤其是甘露醇浓度为250mmol/L时,四倍体远高于二倍体。而大于300mmol/L时,二倍体反而大于四倍体。
2.2 干旱胁迫处理下不同倍性菘蓝的根长、芽长、根重、芽重
不同浓度甘露醇培养基培养10d后组培苗的根长、芽长、根重、芽重统计结果如图3所示。由于当甘露醇浓度大于250mmol/L时,在种子接种10天后,仅有芽发出而未能形成植株,个别形成植株但生长不正常,因此未对此部分进行统计分析。

图2 不同浓度甘露醇处理下菘蓝的发芽势
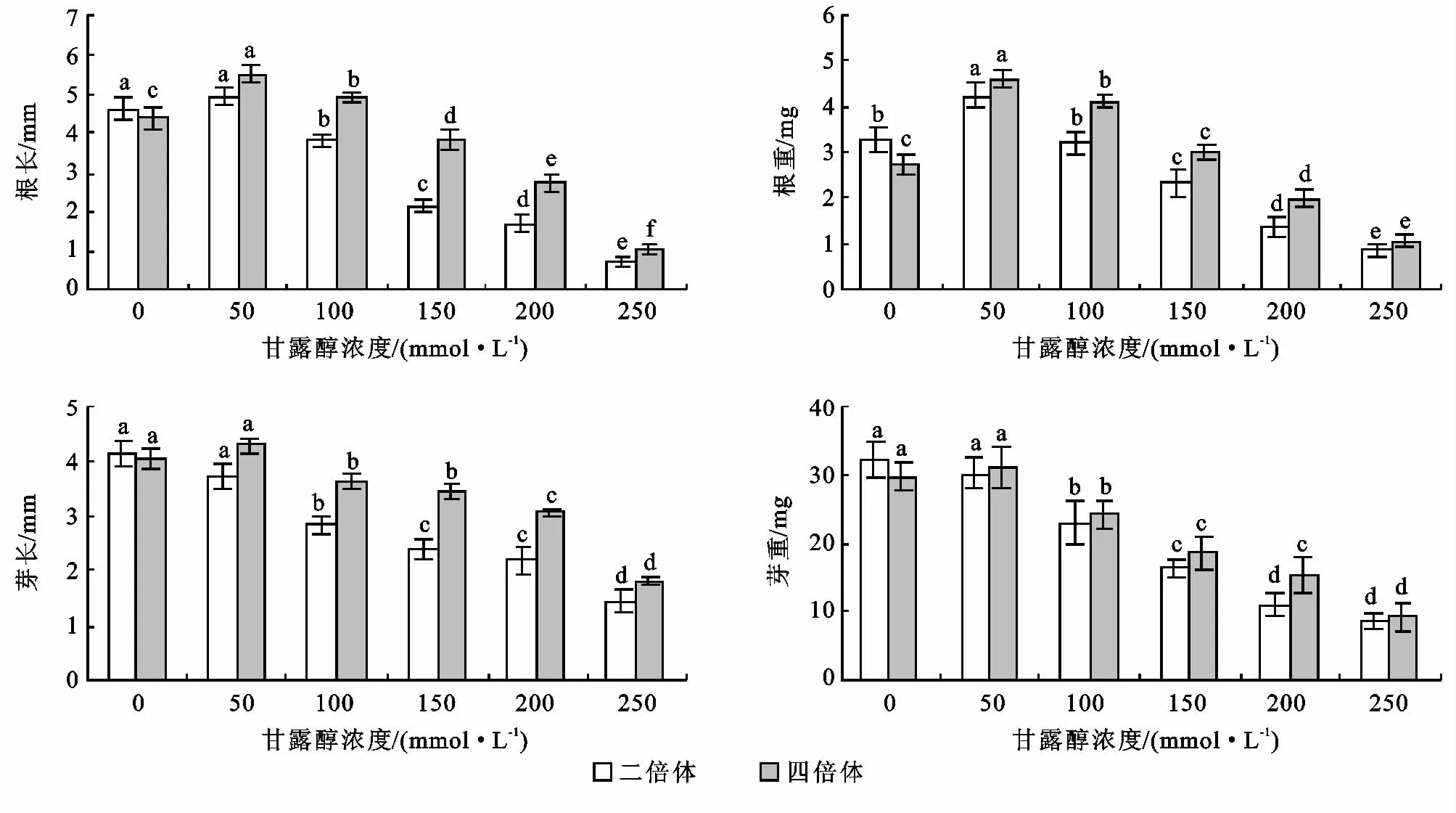
图3 不同浓度甘露醇处理对菘蓝根长、芽长、根重、芽重的影响
二倍体和四倍体菘蓝根长和根重均随着甘露醇浓度的增加呈现先增加后降低的趋势。两种倍性菘蓝的根长和根重均为甘露醇50mmol/L时最高,二倍体根长与对照无显著性差异,而根重与对照差异显著,与其它各浓度之间均存在显著性差异。而四倍体根长和根重与其它所有浓度均有显著性差异,并且甘露醇浓度为50,100mmol/L时的根长均高于对照。
四倍体菘蓝芽长和芽重随着甘露醇浓度的增加而呈现先稍有增加后降低的趋势,当甘露醇为50 mmol/L时芽长和芽重最高,但从方差分析可以看出与对照无显著性差异,而二倍体菘蓝随着甘露醇浓度的增加呈现逐渐降低的趋势,从方差分析可以看出甘露醇50mmol/L时与对照无显著性差异,与其它浓度之间存在显著性差异。
二倍体对照的根长、芽长、根重、芽重均高于四倍体对照,而随着甘露醇的加入四倍体的又均高于二倍体。这说明干旱胁迫对二倍体植株生长情况的影响较四倍体的大,四倍体较二倍体对干旱胁迫的耐受能力强。
2.3 不同干旱胁迫处理下不同倍性菘蓝的丙二醛和脯氨酸含量
不同浓度甘露醇处理下不同倍性菘蓝中丙二醛含量的测定结果如图4所示。二倍体和四倍体菘蓝随着甘露醇浓度的增加,丙二醛含量呈现逐渐增加的趋势。从方差分析可以看出,二倍体菘蓝甘露醇浓度为50mmol/L时丙二醛含量与对照差异不显著,与其它各浓度之间差异达显著水平。四倍体菘蓝甘露醇浓度为50,100mmol/L时与对照之间丙二醛含量差异均不显著,说明二倍体甘露醇浓度为50mmol/L时,四倍体甘露醇浓度达100mmol/L时,膜系统基本没有受到损伤,随着甘露醇浓度的增加,膜系统受损程度加重。二倍体菘蓝丙二醛含量各浓度均高于四倍体菘蓝,甘露醇浓度为250mmol/L时丙二醛含量达最大值,此时二倍体丙二醛含量较对照增加了2.89倍,四倍体增加了2.37倍。说明随着甘露醇浓度的增加四倍体菘蓝的膜系统受损伤程度低于二倍体菘蓝。这在一定程度上说明四倍体菘蓝较二倍体菘蓝对干旱胁迫的耐受能力强。
从图中4可以看出,随着甘露醇浓度的增加,二倍体和四倍体菘蓝脯氨酸含量均呈逐渐增加的趋势。从方差分析可以看出甘露醇浓度为50mmol/L时,脯氨酸含量与对照之间差异不显著,与其它各甘露醇浓度之间脯氨酸含量差异均达到显著性水平。四倍体各浓度下脯氨酸含量均较二倍体高,随着甘露醇浓度的增加四倍体较二倍体增加明显,二倍体最大值是对照的4.38倍,四倍体最大值是对照的5.23倍。这在一定程度上说明四倍体菘蓝较二倍体菘蓝对干旱胁迫的耐受能力更强。

图4 不同浓度甘露醇处理对菘蓝丙二醛和脯氨酸含量的影响

图5 不同浓度甘露醇处理对菘蓝SOD、POD、CAT活性的影响
2.4 不同干旱胁迫处理下不同倍性菘蓝的保护性酶SOD、POD、CAT活性
不同浓度甘露醇处理下不同倍性菘蓝中保护性酶活性的测定结果如图5所示,随着甘露醇浓度的增加,二倍体和四倍体菘蓝中SOD、POD和CAT三种保护性酶均呈现先增加后降低的趋势。其中SOD和POD均在甘露醇浓度为100mmol/L时体内酶活性最大,并且二倍体和四倍体相同。而CAT的变化二倍体和四倍体稍有差异,二倍体表现为甘露醇浓度为100mmol/L时体内酶活性最大,而四倍体则是甘露醇浓度为50mmol/L时体内酶活性最大。当甘露醇浓度从0增加到250mmol/L时,四倍体的SOD、POD和CAT三种保护性酶活性均高于二倍体。这说明在干旱胁迫下四倍体菘蓝对活性氧的清除能力要高于二倍体菘蓝。这也部分解释了四倍体菘蓝较二倍体菘蓝对干旱胁迫的耐受能力强。
3 结论与讨论
种子萌发是植物体生活史中重要的阶段,直接影响到植物体后期的生长发育和形态建成,从而会间接影响产量的形成,因此种子能够迅速整齐的萌发,是获得高产、稳产的基础[15]。水分是种子萌发的必要条件,本试验中随着甘露醇浓度即胁迫程度的增加,二倍体的发芽率在甘露醇浓度为50mmol/L时达到最高,之后随着甘露醇浓度的增加,发芽率呈逐渐下降的趋势。四倍体菘蓝的发芽率、二倍体和四倍体菘蓝的发芽势均随着甘露醇浓度的增加呈现逐渐下降的趋势,这一结果与部分研究者的结果一致:宋军生等[16]利用PEG-6000模拟干旱来研究不同干旱胁迫对板蓝根种子萌发的影响,其发芽率、发芽势和发芽指数均随着PEG-6000浓度的增加呈现逐渐下降的趋势。张聃等[17]采用聚乙二醇高渗溶液人工模拟水分胁迫来研究湿地松种子萌发时的发芽率、发芽势和发芽指数,结果发现这三者均随着聚乙二醇浓度的增加呈现逐渐下降的趋势;朱慧等[18]研究发现PEG-6000胁迫处理五爪金龙种子萌发的发芽率和发芽指数均随着PEG-6000浓度的增加呈现逐渐下降的趋势;朱教君等[19]的研究表明,聚乙二醇胁迫处理沙地樟子松种子萌发时的发芽率、发芽势和发芽指数均随着聚乙二醇浓度的增加呈现逐渐下降的趋势。本研究结果显示,相对低浓度的甘露醇(100~250mmol/L)胁迫下,四倍体菘蓝对干旱胁迫的耐受性要高于二倍体菘蓝。
丙二醛是膜脂过氧化的最终产物,是膜系统受伤害的重要标志之一,其含量可以表示膜脂过氧化作用的程度[20],可间接反映植物组织抗氧化能力的大小,因而用于鉴定植物的抗旱性[21]。二倍体和四倍体菘蓝随着甘露醇浓度的增加,丙二醛含量呈现逐渐增加的趋势,膜系统受损程度越发加重,四倍体菘蓝丙二醛最大值较对照的增加量低于二倍体,这在一定程度上说明四倍体菘蓝较二倍体菘蓝对干旱的耐受能力强。
脯氨酸是植物体内蛋白质的重要组成部分,当植物受到外界环境胁迫时,植物体内游离脯氨酸积累含量增加,在植物的渗透调节中起重要作用。即使在含水量很低的细胞内,脯氨酸溶液仍能提供足够的自由水以维持正常的生命活动。植物体内游离脯氨酸含量在—定程度上反映了植物体内的水分情况,因而可以作为植物缺水情况的参考性生理指标[22]。二倍体和四倍体菘蓝随着甘露醇浓度的增加,脯氨酸含量呈逐渐增加的趋势。四倍体各浓度下脯氨酸含量均较二倍体高,随着甘露醇浓度的增加四倍体较二倍体增加明显,说明四倍体菘蓝较二倍体菘蓝能耐受更强的干旱胁迫。
干旱是一种重要的非生物胁迫因子,它能使植物细胞膜脂受到伤害,同时也干扰植物细胞中活性氧的产生与清除之间的平衡,从而导致植物细胞遭受氧化胁迫。在正常条件下,植物组织细胞中产生的活性氧与清除系统保持平衡,当外界环境胁迫长期作用于植物后,产生的活性氧超出了清除系统的清除能力时,就会引起组织内活性氧积累而产生氧化伤害[23],植物体为保护自身免受氧化伤害而形成一套相应的抗氧化保护系统,如SOD、POD、CAT等[24]。本试验中随着甘露醇浓度的增加二倍体和四倍体菘蓝中SOD、POD和CAT三种保护性酶均呈现先增加后降低的趋势。酶活性之所以降低是因为在一定干旱胁迫范围内,通过增加酶活性来提高适应干旱胁迫的能力,但当胁迫超出其忍耐范围,保护酶活性则会下降,这与范苏鲁等[25]对大丽花的研究结果一致。当甘露醇浓度从0增加到250mmol/L时,四倍体的SOD、POD和CAT三种保护性酶活性均高于二倍体。这说明在干旱胁迫下四倍体菘蓝对活性氧的清除能力要高于二倍体菘蓝。
[1] 中华人民共和国药典委员会.中华人民共和国药典:一部[M].北京:中国医药科技出版社,2010.
[2] 乔传卓,戴富宝,崔熙,等.两种倍性水平鞍蓝的生药学研究[J].中草药,1995,26(8):423-428.
[3] 陈桂平,客绍英.二倍体及四倍体菘蓝氨基酸含量的测定分析[J].中药材,2011,34(4):506-508.
[4] 段英姿.菘蓝二倍体及其同源四倍体遗传差异的ISSR分析[J].西北植物学报,2012,32(8):1534-4538.
[5] 陈玉芹,聂姬锋,客绍英,等.不同倍性菘蓝超氧化物歧化酶的活性变化[J].唐山师范学院学报,2008,30(2):44-47.
[6] 谭勇,梁宗锁,董娟娥,等.水分胁迫对菘蓝生长发育和有效成分积累的影响[J].中国中药杂志,2008,33(1):19-22.
[7] 王竹承,梁宗锁,丁永华.水分胁迫对菘蓝幼苗生长和生理特性的影响[J].西北农业学报,2010,19(12):98-103.
[8] Francois C,Genevieve C,Jean-christophe B.Molecular and physiological response to water deficit in droughttolerant and drought-sensitive lines of sunflower[J].Plant Physiol,1998,116(1):319-328.
[9] 陈善福,舒庆尧.植物耐干旱胁迫的生物学机理及其基因工程研究进展[J].植物学通报,1999,16(5):555-560.
[10] 王飞飞,李勇,王学东.拟南芥AT2G14260基因功能及其表达特异性[J].作物学报,2011,37(11):1984-1990.
[11] Verslues P E,Agarwal M,Katiyar-Agarwal S,et al.Methods and concepts in quantifying resistance to drought,salt and freezing,abiotic stresses that affect plant water status[J].The Plant Journal,2006,45(4):523-539.
[12] Turk M A,Shatnawi M K,Tawaha A M.Inhibitory effects of aqueous extracts of black mustard on germination and growth of alfalfa[J].Weed Biology and Management,2003,3(1):37-40.
[13] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[14] 高俊凤.植物生理学实验技术[M].西安:世界图书出版公司,2000.
[15] Levitt J.Response of plants to environmental stress[M].New York:Aedemic Press,1980.
[16] 宋军生,王芳,鱼小军.PEG胁迫对板蓝根种子萌发和幼苗生长的影响[J].种子,2011,30(11):11-14.
[17] 张聃,曹昀,郑林.湿地松种子萌发对模拟水分胁迫的响应[J].水土保持研究,2011,18(1):188-191.
[18] 朱慧,马瑞君,吴双桃,等.干旱胁迫对五爪金龙种子萌发与幼苗生长的影响[J].西北植物学报,2009,29(2):344-349.
[19] 朱教君,李智辉,康宏樟,等.聚乙二醇模拟水分胁迫对沙地樟子松种子萌发影响研究[J].应用生态学报,2005,16(5):801-804.
[20] 梁新华,史大刚.干旱胁迫对光果甘草幼苗根系 MDA含量及保护酶POD、CAT活性的影响[J].干旱地区农业研究,2006,24(3):108-110.
[21] 刘晓东,高春红,王玲.两种锦带花品种对干旱胁迫的生理响应[J].东北林业大学学报,2012,40(9):22-24.
[22] 俞建妹,唐树生,王凌晖.水分胁迫对桂花幼苗生长及生理特性的影响[J].安徽农业科学,2010,38(4):2107-2109.
[23] 孙鏖,易自力,蒋建雄,等.转NAS基因冷季型草坪草的生长及抗旱性研究[J].生物技术通报,2008(4):122-129.
[24] Sergi M B,Lenonor A.Drought-induced changes in the redox state of alpha-tocopherol,ascorbate and the diterpene carnosic acid in chloropasts of labiatae species differing in carnosic acidcontents[J].Plant Physiology,2003,131(4):1816-1825.
[25] 范苏鲁,苑兆和,冯立娟,等.干旱胁迫对大丽花生理生化指标的影响[J].应用生态学报,2011,22(3):651-657.
