不同温度与营养盐条件对浒苔(Ulva prolifera)和肠浒苔(Ulva intestinalis)的生长影响
2013-08-14何进石雅君王玉珏邵红兵刘东艳
何进 ,石雅君 ,王玉珏 ,邵红兵 ,刘东艳
(1.中国科学院烟台海岸带研究所 中国科学院海岸带环境过程与生态修复重点实验室(烟台海岸带研究所)山东省海岸带环境过程重点实验室 山东 烟台 264003;2.中国科学院大学,北京 100049)
“绿潮”(Green tide)是一种在世界沿岸国家普遍发生的、通常是由海洋绿藻大量增殖引起的有害藻华现象(Back et al, 2000;Blomster et al,2002)。目前,已知形成绿潮的物种主要来自石莼属(Ulva)、刚毛藻属(Cladophora)与硬毛藻属(Chaetomorpha)(Fletcher,1996)。绿潮爆发会带来一系列的环境危害,如:藻体腐败散发难闻气味,污染空气;藻类堆积可能为有害昆虫提供繁殖条件,引起害虫爆发;藻类沉积在海底,会引起缺氧和底质腐败,改变沉积物的理化性质,导致水生生物缺氧死亡等(Villares et al,1999;Hiraoka et al,2004;Lapointe et al,2005a,b)。
2008年,我国黄海海域形成了由浒苔(Ulva prolifera)引发的大规模绿潮,给山东省造成了巨大的经济损失(乔方利 等,2008;Liu et al,2009;Ye et al,2011)。已有的研究发现,在由浒苔(U.prolifera)引发的绿潮事件中,往往混有其他绿藻物种,如肠浒苔(U.intestinalis)等(Fletcher, 1974;Coleman et al, 1979;Briand et al,1987)。我国发生的绿潮事件也具有这样的特点(Wang et al,2012)。
绿潮原因物种的快速生长与温度和营养盐浓度往往存在密切关系(Morand et al,1996)。研究发现,浒苔(U.prolifera)是一种广温性海藻(Taylor et al,2005)生态幅较宽,其对温度的适应范围为:10℃~35℃(Moll et al,1995;Komatsu et al,1997;Kamer et al, 2001;吴洪喜 等,2000;张寒野等,2006;王建伟等,2007)。肠浒苔(U.intestinalis)在5℃~30℃范围内都可以存活,在水温5℃时种群开始增长,在10℃左右孢子萌发率迅速增加,温度为15℃时生长速率最大(Kim et al,1996;Lotze et al,1999)。
然而,在我国黄海发生的绿潮事件中,浒苔(U.prolifera)最终取代其他物种,成为优势种群。因此,需要解答浒苔(U.prolifera)与其他浒苔物种之间的竞争关系。本研究在以往学者的研究的基础上,对苏北沿岸潮间带优势物种:浒苔(U.prolifera)和肠浒苔(U.intestinalis)在不同温度和营养盐交叉条件下的生长情况开展了研究。目的是探索不同浒苔物种的生长特性,解释其在绿潮爆发中的竞争机制。
1 材料和方法
1.1 材料来源
浒苔(U.prolifera)和肠浒苔(U.intestinalis)样品于2010年4月取自江苏省南通市如东县长沙镇紫菜养殖筏架(E121°19′58.1″-E121°21′32.4″;N32°28′13.7″-N32°29′38.3″),浒苔(U.prolifera)和肠浒苔(U.intestinalis)在筏架上的生物量(干重)比例约为2∶1(个人数据,发表中)。采集到的两种浒苔样品放在冰盒中带回实验室,用GF/F玻璃纤维滤膜过滤过的自然海水反复清洗多次后,置于过滤过的消毒海水中培养、纯化。
1.2 实验设计
将两种浒苔置于光照培养箱(BSG-800)中培养,光暗比为12 h∶12 h,光照度8 000 lx。将GF/F膜过滤过的自然海水,置于1 000 mL的烧杯中,培养水体为1 000 mL。自然海水取自烟台栈桥近岸,通过添加NH4NO3和KH2PO4设置6个实验组,各组氮、磷营养盐的初始浓度如表1所示。培养温度分别设定为:10℃,15℃,20℃和25℃。
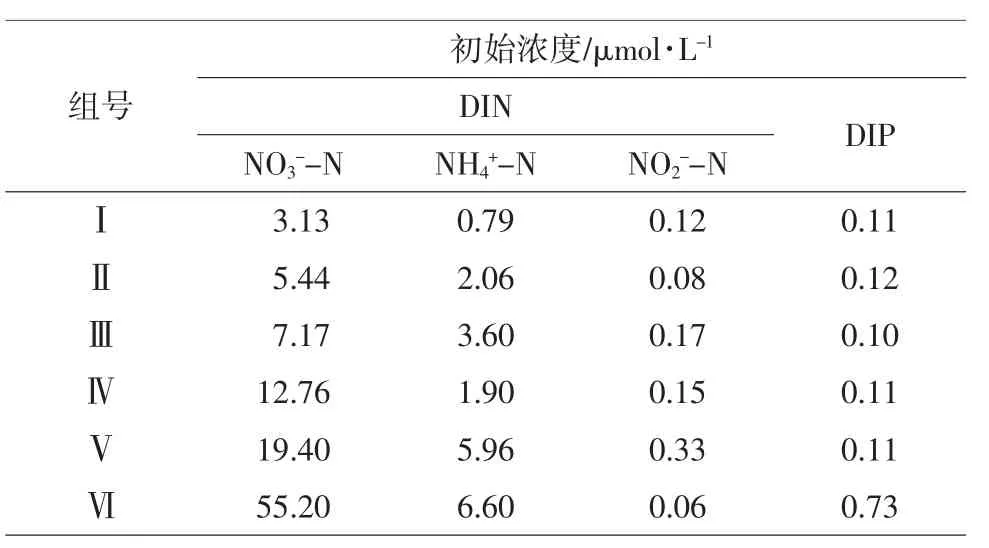
表1 各营养盐组初始浓度
1.3 浒苔含水率的计算
分别取出5份10 g的两种浒苔,将藻体用滤纸吸干后,在80℃下烘干至恒重,测藻体的含水率,再将浒苔含水率分别加和计算平均值。
1.4 相对生长率的计算
每天取出全部藻体,再将藻体用滤纸吸干,测量藻体湿重,计算相对生长率,再将生长期内每次的计算结果加和计算平均值,连续测定10天。计算公式如下:
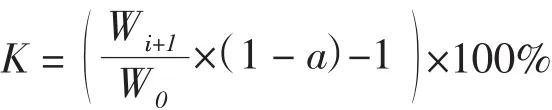
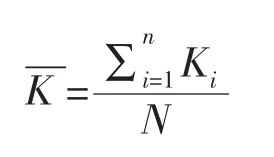
式中,Ki代表从第1天到第(i+1)天的相对增长速率;Wi+1代表第(i+1)天测定的湿生物量;W0代表开始培养时的湿生物量;i代表第i天取样;N代表总取样次数;代表两种浒苔生长期平均每天的相对增长速率;a为两种浒苔平均含水率。
1.5 营养盐的测定
将每种初始培养液以及培养10天后的每个烧杯的培养液经过GF/F膜过滤后,使用营养盐自动分析仪(Seal AA3,Germany)测定培养液中的氨氮(NH4+-N)、亚硝酸盐(NO2--N),硝酸盐(NO3--N),总溶解态氮(TDN)和溶解无机磷含量。溶解性无机氮(DIN)为氨氮(NH4+-N)、亚硝酸盐(NO2--N)和硝酸盐(NO3--N)的总和(海洋监测规范第4部分:海水分析GB17378.4-2007)。
1.6 数据处理
应用SPSS 11.5软件对数据进行统计分析。藻体生长率等参数应用“one-way ANOVA”的方法进行多重比较,以P<0.05作为差异显著性水平,所得数据均以平均值±标准差表示。营养盐消耗量为营养盐初始浓度与最终浓度之差。
2 结果
2.1 肠浒苔(U.intestinalis)和浒苔(U.prolifera)的生长情况
图1表明,不同温度条件下,肠浒苔(U.intestinalis)相对生长率变化趋势大致相同,每个营养盐组中不同温度条件下相对生长率的差异不显著(P>0.05),即从第1天至第8天均呈明显上升趋势,在第8天相对生长率达到最大,而从8天后开始快速下降。
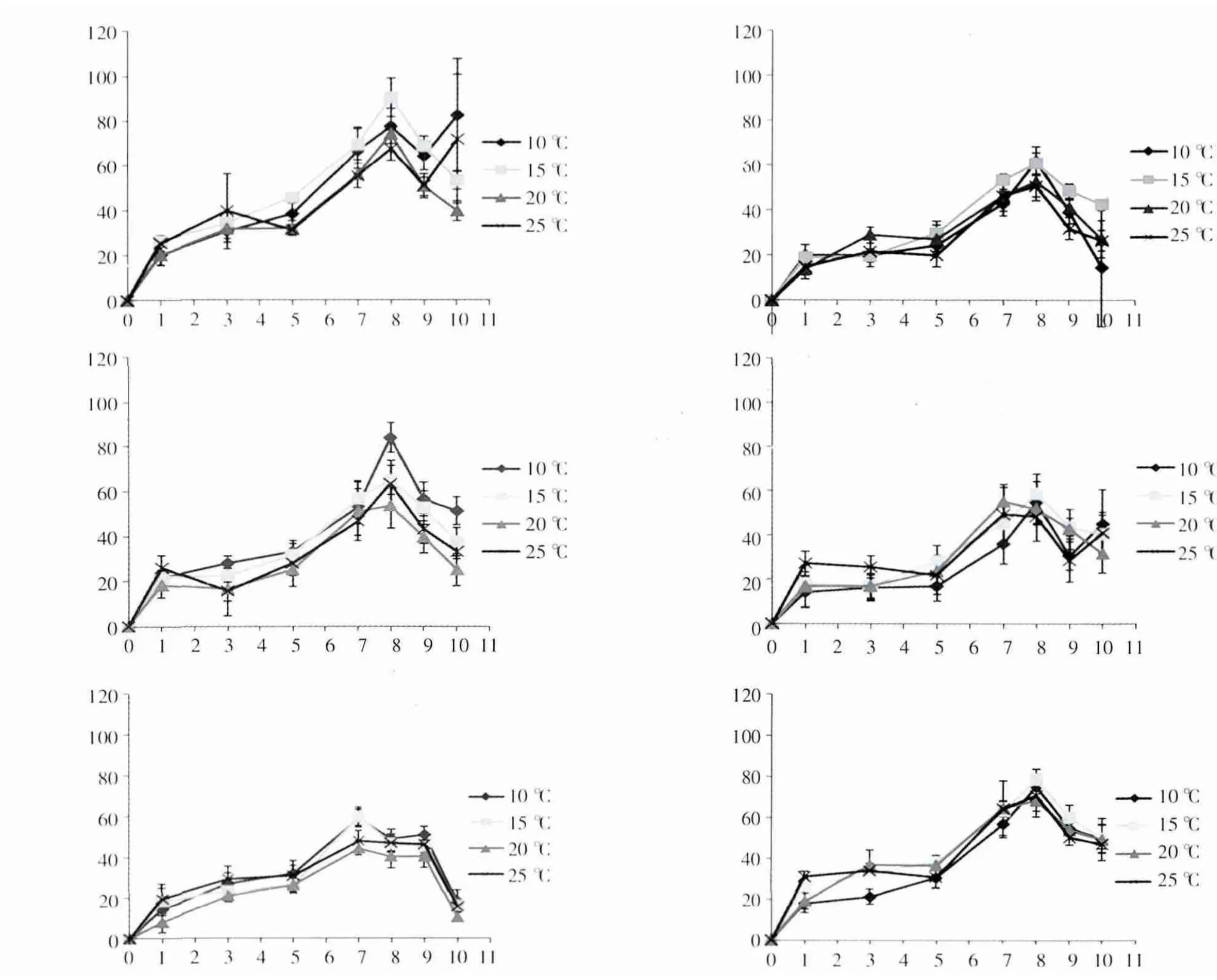
图1 肠浒苔(U.intestinalis)在6组营养盐环境中不同温度下的相对生长率
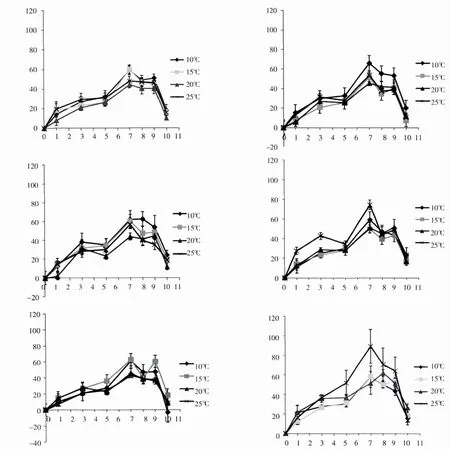
图2 浒苔(U.prolifera)在6组营养盐环境中不同温度下的相对生长率
图2 显示,浒苔(U.prolifera)相对生长率也呈现出先增后降的变化趋势。各实验条件下,浒苔(U.prolifera)相对生长率在第1-7天均呈明显上升趋势,并且,最大相对生长率均出现在第7天。经方差分析,每个营养盐组在不同温度下的相对生长率差异不显著(P>0.05)。
从图1和图2的对比可以看出,在相同温度条件下,肠浒苔(U.intestinalis)在第Ⅰ组营养盐环境中的相对生长率明显高于其他组,而浒苔(U.prolifera)在第Ⅵ组营养盐环境中的相对生长率,在20℃、25℃时明显高于其他组,但在10℃和15℃时,各组增长水平大致相同,说明高温、高营养盐利于浒苔(U.prolifera)的快速生长。
根据表2中两种浒苔相对生长率的最大值出现的温度和营养盐组情况可以看出,肠浒苔(U.intestinalis)的最大相对生长率出现在15℃时第Ⅰ组中,浒苔(U.prolifera)的最大相对生长率则出现在温度为25℃时,DIN浓度最大的第Ⅵ组,说明浒苔(U.prolifera)对营养盐与温度的耐受程度比较高。此外,各组中浒苔(U.prolifera)的最大相对生长率出现较早(第7天)且持续时间至第9天,显示了优于肠浒苔(U.intestinalis)的生长特征。
2.2 肠浒苔(U.intestinalis)和浒苔(U.prolifera)对营养盐的消耗情况
根据表3中两种浒苔的最大营养盐消耗量,可以看出,第Ⅲ组中肠浒苔(U.intestinalis)在10℃时对硝酸盐的消耗量最大,第Ⅵ组中肠浒苔(U.intestinalis)在15℃时对硝酸盐和DIP的消耗量最大。结合表2中两种浒苔最大相对生长率出现的组别,可以看出,肠浒苔(U.intestinalis)在上述温度和营养盐组中相对生长率也最大。
第Ⅲ组中浒苔(U.prolifera)在10℃时对氨盐的消耗量最大,第Ⅳ组中浒苔(U.prolifera)在25℃时对氨盐的消耗量最大,第Ⅵ组中浒苔(U.prolifera)在25℃时对硝酸盐和DIP的消耗量最大。根据表2数据,与肠浒苔(U.intestinalis)相同,浒苔(U.prolifera)在上述温度和营养盐组中其相对生长率也达到了最大。
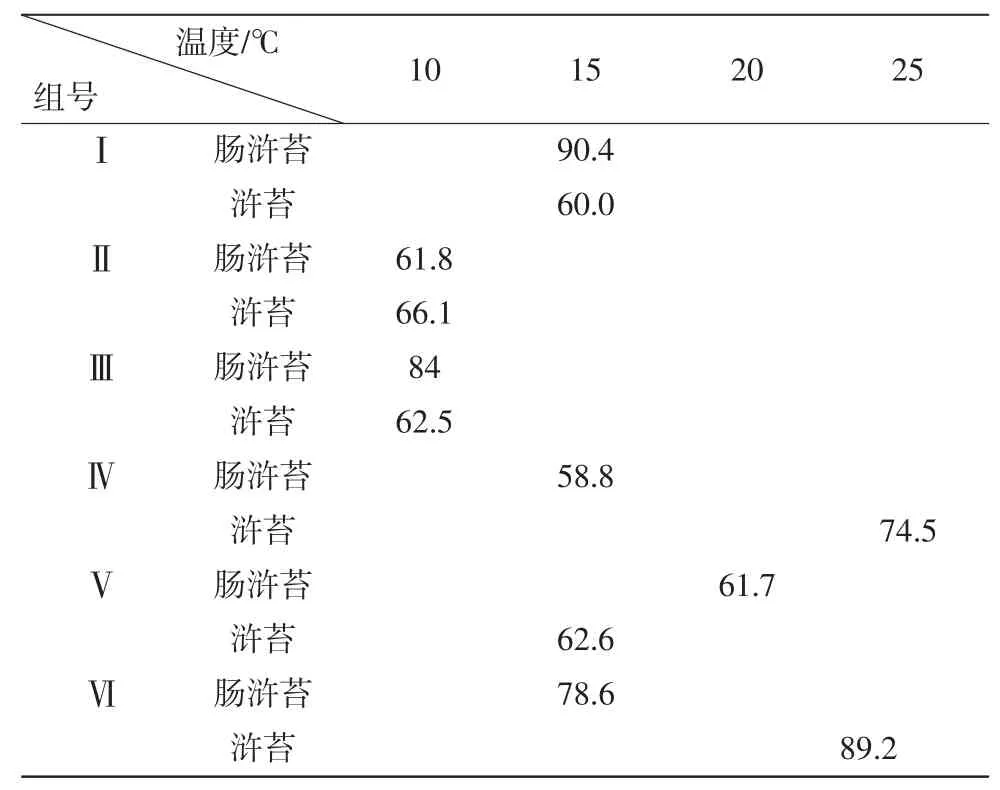
表2 浒苔(U.prolifera)和肠浒苔(U.intestinalis)在各组中的最大相对生长率 (%)

表3 浒苔(U.prolifera)和肠浒苔(U.intestinalis)的最大营盐消耗量(μmol·L-1)
此外,从表3中可以看出,在DIN浓度最高的第Ⅵ组中,在15℃~25℃的温度范围内,浒苔(U.prolifera)对硝酸盐的消耗量均最大,且均高于肠浒苔(U.intestinalis)。
3 讨论
综合比较两种浒苔在各种条件下的相对生长率,可以看出浒苔(U.prolifera)的相对生长率在第7天时就会达到最大值,并在短暂下降后又再次升高,这表明浒苔(U.prolifera)具有短期快速吸收储备营养物质的特点,与相关报道一致(Thomas et al,1987;Pedersen et al,1997)。此外结果还显示浒苔(U.prolifera)的相对生长率达到最大值后并未立即下降,而是仍保持较高值,在持续了两天之后才开始显著下降。而肠浒苔(U.intestinalis)则在第8天时相对生长率最大,之后呈下降趋势。肠浒苔(U.intestinalis)的相对生长率在达到最大值后即迅速下降,这意味着肠浒苔(U.intestinalis)以较高的生长率持续生长的能力弱于浒苔(U.prolifera),表明浒苔(U.prolifera)在大规模增殖后可能会抢占生态位,成为优势种。
对于浒苔(U.prolifera)和肠浒苔(U.intestinalis)不同生长模式,存在两种解释:第一,两种浒苔营养盐利用机制存在差异;第二,两种浒苔自身的生物适应策略不同。
从营养盐利用机制来看,本实验表明浒苔(U.prolifera)对硝酸氮的消耗能力很强,这与田千桃等(2010)的结论一致,浒苔(U.prolifera)在生态上的成功与其较强营养盐利用能力密不可分,其对硝酸氮的消耗量明显高于肠浒苔(U.intestinalis),这与Wang等(2012)的研究一致。实验结果还表明,在高营养条件下,浒苔(U.prolifera)的相对生长率明显高于肠浒苔(U.intestinalis),这与Lotze等(1999)的研究结果一致。此外,研究表明,DIN浓度的升高会限制部分石莼属绿藻的生长,如Berglund(1969)的研究显示缘管浒苔(U.linza)在DIN为14 μmol/L时生长情况最好,而DIN超过21 μmol/L时生长逐渐受到限制,这可能是本实验中肠浒苔(U.intestinalis)在营养盐浓度相对较高时,相对生长率较低现象的一种解释。
从两种浒苔自身的生物适应策略上来看,与肠浒苔(U.intestinalis)相比,浒苔(U.prolifera)对于不利的、多变的环境条件的响应更为敏感,更容易在短时间内引发藻华(Wang et al.,2012)。肠浒苔(U.intestinalis)与浒苔(U.prolifera)相比,则有着更强的N摄取和贮存能力(Cohen et al,2004),且具有较强的环境耐受力,即使在环境状况不利于其生长,如盐度下降,光照不足时,其仍会摄取并贮存N(Kamer et al,2001;Cohen et al,2004),并且在不利环境中,肠浒苔(U.intestinalis)会将光合作用提供的能量优先用于进行渗透调节而非藻体生长(Cohen et al,2004)。这就意味着,由于其他环境因素的限制,肠浒苔(U.intestinalis)藻体中的N即使很充足且在不断增加,其生物量也可能不会发生快速的增长。因此,在两种浒苔共生时,浒苔(U.prolifera)更容易爆发,而肠浒苔(U.intestinalis)则更偏向于贮存能量和营养盐。
4 结论
本次实验对浒苔(U.prolifera)和肠浒苔(U.intestinalis)对营养盐吸收利用的生理生态学差异做了初步研究,主要结论如下:
(1)浒苔(U.prolifera)在温度和营养盐浓度较高时表现出较高的相对生长率,而相比之下,肠浒苔(U.intestinalis)则在较低的温度和营养盐浓度下相对生长率较高。
(2)浒苔(U.prolifera)和肠浒苔(U.intestinalis)表现出两种截然不同的生长模式:浒苔(U.prolifera)达到最大相对生长率所需的时间少于肠浒苔(U.intestinalis)且持续时间长;而肠浒苔(U.intestinalis)不仅达到最大相对生长率的时间要长于浒苔(U.prolifera),而且其相对生长率在达到最大值后即迅速下降,不能持续。
Back S,Lehvo A,Blomster J,2000.Mass occurrence of unattached Enteromorpha intestinalis on the Finnish Baltic Sea coast:Helsinki:Societas Biologica Fennica Vanamo,1964,155-161.
Balls P,Macdonald A,Pugh K,et al,1995.Long-term nutrient enrichment of an estuarine system:Ythan,Scotland(1958-1993).Environmental Pollution,90(3):311-321.
Berglund H,1969.On the cultivation of multicellular marine green algae in axenic culture.Svensk Bot.Tidskr,63:251-264.
Blomster J,Bäck S,Fewer D P,et al,2002.Novel morphology in Enteromorpha(Ulvophyceae)forming green tides.American Journal of Botany,89(11):1756-1763.
Briand X,Morand P,1987.Ulva,stranded algae:a way of depollution through methanisation,834-839.
Cohen R A,Fong P,2004.Nitrogen uptake and assimilation in Enteromorpha intestinalis(L.)Link(Chlorophyta):using 15N to determine preference during simultaneous pulses of nitrate and ammonium.Journal of experimental marine biology and ecology,309(1):67-77.
Coleman N V,Stewart W,1979.Enteromorpha prolifera in a polyeutrophic loch in Scotland.British Phycological Journal,14:121.
Dan A,Hiraoka M,Ohno M,et al,2002.Observations on the effect of salinity and photon fluence rate on the induction of sporulation and rhizoid formation in the green alga Enteromorpha prolifera(Müller)J.Agardh(Chlorophyta,Ulvales).Fisheries Science,68(6):1182-1188.
Dugdale R,Goering J,1967.Uptake of new and regenerated forms of nitrogen in primary productivity.Limnology and Oceanography,196-206.
Fletcher R L,1974.Ulva problem in Kent.Marine Pollution Bulletin,5(2):21-21.
Fletcher R L,1996.Marine benthic vegetation:recent changes and the effects of eutrophication.In.:Berlin:Springer press.
Hiraoka M,Ohno M,Kawaguchi S,et al,2004.Crossing test among floating Ulva thalli forminggreen tide'in Japan.Hydrobiologia,512(1):239-245.
Hu C,Li D,Chen C,et al,2010.On the recurrent Ulva prolifera blooms in the Yellow Sea and East China Sea.Journal of Geophysical Research-Oceans,115.
Kamer K,Fong P,2001.Nitrogen enrichment ameliorates the negative effects of reduced salinity on the green macroalga Enteromorpha intestinalis.Marine Ecology Progress Series,218:87-93.
Komatsu T,Meinesz A,Buckles D,1997.Temperature and light responses of alga Caulerpa taxifolia introduced into the Mediterranean Sea.Marine Ecology Progress Series,146(1):145-153.
Lapointe B E,1997.Nutrient thresholds for bottom-up control of macroalgal blooms on coral reefs in Jamaica and southeast Florida.Limnology and Oceanography,1119-1131.
Lapointe B E,Barile P J,Littler M M,et al,2005a.Macroalgal blooms on southeast Florida coral reefs:II.Cross-shelf discrimination of nitrogen sources indicates widespread assimilation of sewage nitrogen.Harmful Algae,4(6):1106-1122.
Lapointe B E,Barile P J,Littler M M,et al,2005b.Macroalgal blooms on southeast Florida coral reefs:I.Nutrient stoichiometry of the invasive green alga Codium isthmocladum in the wider Caribbean indicates nutrient enrichment.Harmful Algae,4(6):1092-1105.
Largo D B,Sembrano J,Hiraoka M,et al,2004.Taxonomic and ecological profile of‘green tide’species of Ulva(Ulvales,Chlorophyta)in central Philippines.Asian Pacific Phycology in the 21st Century:Prospects and Challenges,247-253.
Liu D,Keesing J K,Xing Q,et al,2009.World's largest macroalgal bloom caused by expansion of seaweed aquaculture in China.Marine Pollution Bulletin,58(6):888-895.
Lotze H K,Schramm W,Schories D,et al,1999.Control of macroalgal blooms at early developmental stages:Pilayella littoralis versus Enteromorpha spp.Oecologia,119(1):46-54.
Marshall Pregnall A,Rudy P P,1985.Contribution of green macroalgal mats(Enteromorpha spp.)to seasonal production in an estuary.Marine ecology progress series.Oldendorf,24(1):167-176.
Moll B,Deikman J,1995.Enteromorpha clathrata:A potential seawater-irrigated crop.Bioresource technology,52(3):255-260.
Morand P,Merceron M,2005.Macroalgal population and sustainability.Journal of coastal research,1009-1020.
Pedersen M,Borum J,1997.Nutrient control of estuarine macroalgae:growth strategy and the balance between nitrogen requirements and uptake.Marine Ecology Progress Series,161:155-163.
Taylor R,Fletcher R L,Raven J A,2001.Preliminary studies on the growth of selected'Green tide'algae in laboratory culture:Effects of irradiance,temperature,salinity and nutrients on growth rate.Botanica Marina,44(4):327-336.
Taylor R,Fletcher RL,Raven JA,2005.Preliminary studies on the growth of selected‘green tide’algae in laboratory culture:effects of irradiance,temperature,salinity and nutrients on growth rate.Botanica Marina,44(4):327-336.
Thomas T,Turpin D,Harrison P,1987.Desiccation enhanced nitrogen uptake rates in intertidal seaweeds.Marine Biology,94(2):293-298.
Villares R,Puente X,Carballeira A,1999.Nitrogen and phosphorus in Ulva sp.in the Galician Rias Bajas(northwest Spain):seasonal fluctuations and influence on growth.Boletin-instituto espanol de oceanografia,15(1/4):337-342.
Wallentinus I,1984.Comparisons of nutrient uptake rates for Baltic macroalgae with different thallus morphologies.Marine Biology,80(2):215-225.
Wang Ying,Wang You,Zhu Lin,et al,2012.Comparative Studies on the Ecophysiological Differences of Two Green Tide Macroalgae under Controlled Laboratory Conditions.PLoS One,8(7):1-16.
Woodhead P,Moss B,1975.The effects of light and temperature on settlement and germination of Enteromorpha.British Phycological Journal,10(3):269-272.
Ye N,Zhang X,Mao Y,et al,2011.“Green tides”are overwhelming the coastline of our blue planet:taking the world’s largest example.Ecological Research,26:477-485.
李俭平,赵卫红,付敏,等,2010.氮磷营养盐对浒苔(U.prolifera)生长影响的初步探讨.海洋科学,4:45-48.
乔方利,马德毅,朱明远,等,2008.2008年黄海浒苔(U.prolifera)爆发的基本状况与科学应对措施.海洋科学进展,26(3):409-410.
田千桃,霍元子,王阳阳,等,2010.浒苔对NH4+-N与NO3--N吸收的相互作用.海洋科学,41-45.
田千桃,霍元子,张寒野,等,2010.浒苔(U.prolifera)和条浒苔(U.clathrata)生长及其氨氮吸收动力学特征研究.上海海洋大学学报,19(2):252-258.
王建伟,阎斌伦,林阿朋,等,2007.浒苔(Enteromorpha prolifera)生长及孢子释放的生态因子研究.海洋通报,26(2):60-65.
吴洪喜,吴美宁,2000.浒苔(U.prolifera)实验生态的初步研究.浙江海洋学院学报:自然科学版,19(3):230-234.
