均三嗪类衍生物的合成及应用进展
2013-08-14刘亚清胡福临巨修练
刘亚清,胡福临,黄 翔,巨修练
(武汉工程大学化工与制药学院 绿色化工过程教育部重点实验室,湖北 武汉430074)
含氮杂环化合物具有广泛的用途,一直是研究的热点。其中均三嗪(1,3,5-三嗪)类化合物具有多种生理活性,从20世纪50年代开始就受到研究者的亲睐,合成了一系列的均三嗪类衍生物,并对其应用领域进行了广泛的研究。均三嗪类衍生物的母体结构是一个带有3个活泼氯原子的稳定的六元环,氯原子能够被-OH、-NH2、-SH、-NHR等官能团取代,从而生成不同的衍生物,广泛应用于各个领域。1952年合成了第一个均三嗪类除草剂阿特拉津(Atrazine),1957年,瑞士的H.盖辛和E.克努斯利发现其具有良好的除草性能,并在1958年由瑞士的Ciha-Gergy公司开发生产,后来成为世界上产量最大的除草剂[1,2]。此后均三嗪类衍生物得到了迅速的发展,迄今为止均三嗪类除草剂已经开发出了30多个品种,目前已上市的主要有:特丁津(Terbuthylazine)、西玛津(Simazine)、氰草津(Cyanazine)、扑草净(Prometryne)、莠灭净(Ametryn)、西 草 净 (Simetryne)、特 丁 净 (Terbutryn)、氟草净(SSH-108)、三嗪氟草胺(Triaziflum)等。灭蝇胺(Cyromazine)是瑞士Ciha-Gergy公司于20世纪80年代初期开发的均三嗪类昆虫生长调节剂,90年代初期我国从国外引进该品种,主要在蝇繁殖地进行喷洒,防治蝇的滋生。抗癌药特里塔明(Tretamine)临床上用于治疗血癌和其它癌症,能明显增强疗效。六甲蜜胺(HMM)和2-氨基-4-吗啉-1,3,5-三嗪广泛应用于肺癌、乳腺癌和卵巢癌的治疗,六甲蜜胺为嘧啶类抗代谢药物,主要抑制二氢叶酸还原酶,干扰叶酸代谢,选择性抑制DNA、RNA和蛋白质的合成。Lucknow药物研究报道的羟甲基五甲蜜胺(HMPMM)具 有 抗 肿 瘤 活 性[3-6]。 抗 菌 剂 敌 菌 灵(Anilazine)对烟草褐斑病、瓜类炭疽病、霜霉病、黑星病、马铃薯和番茄的早疫病、晚疫病及水稻和胡麻的叶斑病均有防治作用。印度针对氯喹啉耐药株的出现和迅速传播恶性疟原虫的抗药性,设计合成了4-氨基喹啉-1,3,5-三嗪类化合物,并通过体外活性筛选出对耐药菌株有较好抑制作用的化合物。目前,研究者正积极开发均三嗪类衍生物在生物能源、阻燃剂、新材料等方面的应用。
与此同时,均三嗪类衍生物的合成也从传统方法逐步拓展到新型的合成路线,例如利用组合化学法、无溶剂合成法、微波辐射法和大分子吸附树脂法等均得到了需要的化合物,为进一步的深入研究提供了可能。同时借助计算机辅助药物分子设计、利用电子等排原理设计更多具有较好活性的先导化合物,以进一步开拓其应用领域。
作者在此综述了均三嗪类衍生物在农药、医药、生物能源等领域的合成及应用状况,并介绍了均三嗪类衍生物金属配合物的研究进展。
1 农药领域
1.1 杀菌剂
1,3,5-三嗪是一类广谱的药效基团,可以作为连接基团广泛用于化合物二聚或三聚体的合成[7,8]。其衍生物具有良好的抗菌、抗病毒等活性。据美国纽约大学化学系与美国路易斯安那州立大学化学系联合报道[9-11],他们基于天然合成的抗菌肽带正电荷、具有疏水性的特点,以1,3,5-三嗪为母体结构,应用组合化学方法衍生化了一系列的均三嗪类衍生物。抗菌试验表明合成的衍生物具有很强的抗菌活性以及低溶血性,并且能够在低于最低抑菌浓度的条件下有效地抑制细菌生物膜的生长,这些特质与天然抗菌肽极为相似。该系列化合物对枯草杆菌、革兰氏阳性菌(包括鲍氏不动杆菌、炭疽杆菌和金黄色葡萄球菌)的抗菌活性很好,其中化合物1、2、3的抗菌活性最好。中国科学院化学研究所的专利[12]报道均三嗪类衍生物4、5、6对瓜类炭疽病、水稻纹枯病、黄瓜灰霉病、小麦赤霉病、番茄早疫病、苹果黑心病中一种或几种有很好的抗菌活性。2007年,印度Rajasthan Jaipur大学化学系合成的化合物7、8、9具有很好的抗真菌效果。
一些具有较好杀菌活性的均三嗪类衍生物见图1。

图1 具有较好杀菌活性的均三嗪类衍生物Fig.1 The structures of s-triazine derivatives with good fungicidal activities
研究者常在1,3,5-三嗪环上引入芳环、脂肪基和一些杂环基团,如吗啉、吡啶、吡唑等,以实现化合物的生物活性叠加。2011年,陈华等[13]利用药物设计的拼合原理,在均三嗪环上引入2-氨基嘧啶,筛选出活性较高的抗菌、抗肿瘤先导化合物,并在此抗菌、抗肿瘤杂环化合物基础上合成了系列新型含嘧啶氨基的三取代均三嗪类衍生物(化合物10),并初步测试了这类衍生物的抗苹果树腐烂病菌等作用[14]。其合成路线见图2。

图2 含嘧啶氨基的三取代均三嗪类衍生物的合成路线Fig.2 Synthesis of 2-amino-pyrimidine substituted 1,3,5-triazines
加拿大Zacharie等[15]合成了具有良好溶解性的均三嗪类衍生物抗炎药,这类药物主要是针对大部分由蛋白质A引起的自身免疫缺陷病,如风湿性关节炎、系统性红斑狼疮、特发性血小板减少紫癫、肾小球性肾炎等以及血管炎等与病原性抗体或免疫复合物相关的疾病。该课题组预先设计了一个三嗪二胺的通用结构(对形成蛋白结合配体支架的构成起有效作用[16])来模拟蛋白质A这个三嗪骨架,从而为抗炎性药物的研究提供平台。
高耐药性和多药耐药菌株的不断增加和扩散使得人们对新型抗生素的需要越来越迫切。周春晖等利用组合化学的优势合成一系列均三嗪类衍生物,从中筛选出了具有很强抗菌活性及低溶血性的化合物,这类化合物的侧链多为疏水性或带正电荷的均三嗪类衍生物[17,18];随后筛选抗枯草杆菌活性最佳化合物,在此基础上合成一组均三嗪类衍生物并测试了其抗枯草芽孢杆菌的活性,从中选出活性最好的几个化合物并作进一步的抗菌实验,分别测试了其对革兰氏阳性菌和革兰氏阴性菌(包括耐氨苄西林和耐链霉素的大肠埃希菌和多药耐药金黄色葡萄球菌)的活性,结果表明这些均三嗪类衍生物对革兰氏阳性菌的抗菌活性远优于其对革兰氏阴性菌的活性[9]。
1.2 除草剂
均三嗪类衍生物除草剂的开发比较早,自1952年合成第一个均三嗪类除草剂阿特拉津后,均三嗪类除草剂发展迅猛。均三嗪类衍生物除草剂是通过光合作用Ⅱ(PSⅡ)、以D1蛋白质为作用靶标,抑制电子从QA到QB,阻碍CO2的固定和ATP、NADH2的产生,从而抑制植物的光合作用达到除草作用。这类除草剂大部分也有茎叶处理的作用,主要防除一年生的杂草,对阔叶杂草和禾本科杂草的生长也有抑制作用。
1990年,Idemitsu Kosan公司开发出一种新型的均三嗪类除草剂三嗪氟草胺(Triaziflum,化合物11),其后这种类型的除草剂因较好的除草活性陆续被农用化学品公司采用[19-23],其结构特征在于1,3,5-三嗪环上包含以下取代基:氟烷基、一个取代的氨基和烷基氨基(包含苯基或苯氧基),含有大量不同的二环结构。含苯并口恶唑的化合物也具有除草活性,例如N-[1-(1,3-苯并口恶唑-2-取代基)烷基]-6-烷基-1,3,5-三嗪-2,4-二胺就曾在专利文献中报道过。
2000年,日本的Hitoshi Kohno课题组合成了一系列新型的抗阿特拉津藜植物的2-苄氨基-1,3,5-三嗪(如化合物14、15、16),这些化合物也是通过光合作用Ⅱ、以D1蛋白质为靶标,并研究了其在类囊体中进行光合作用的机理。
2005年,德国拜耳公司以三嗪氟草胺为研究对象[24,25],衍生合成了300个有针对性的除草剂(如化合物17、18、19),并研究了其SAR,运用不同于一般方法的物理化学性质筛选具有良好除草性质的化合物。
典型的均三嗪类除草剂见图3。
1.3 杀虫剂
均三嗪类衍生物昆虫生长调节剂是通过干扰昆虫蜕皮和化蛹的生理过程而发挥药效作用。其作用机理是抑制昆虫几丁质合成酶的活性,对几丁质的合成起阻碍作用,即对昆虫新表皮的形成起阻碍作用,使得昆虫幼虫和蛹在形态上发生畸变而致死。目前已经商品化生产的有灭蝇胺(Cyromazine,化合物20),它对双翅目害虫有非常好的效果,具有触杀、胃毒及内吸传导作用,导致蝇蛆和蛹成形。可用于防治蔬菜及公共卫生场所的双翅目害虫。
中国科学院化学研究所的专利报道合成了一系列均三嗪类衍生物(包括化合物21、22、23),具有很好的杀农田红蜘蛛的活性[26]。
余勇研究发现,含有对三氟甲基苯胺基结构片段和三嗪环结构的化合物具有良好的杀虫活性和较好的选择性,对合成的目标化合物进行了生物活性和危害性检测,结果发现,化合物2,4-二氯-6-(4-三氟甲基苯胺基)-1,3,5-三嗪(化合物24)在200μL·mL-1的浓度下对甜菜夜蛾的活体杀虫防治效果达40%,对大鼠脑蛋白的危害程度为23%,对化合物进行修饰得到6-氯-2-(6-氯吡啶-3-亚甲基氨基)-4-(4-三氟甲基苯亚氨基)-1,3,5-三嗪(化合物25),离体生物活性测试表明其对家蝇的生长具有一定的抑制作用。 典型的均三嗪类杀虫剂见图4。

图3 典型的均三嗪类除草剂Fig.3 The structures of typical s-triazine herbicides

图4 典型的均三嗪类杀虫剂Fig.4 The structures of typical s-triazine pesticides
2 医药领域
2.1 抗癌药
均三嗪类衍生物是很早就被广泛熟知的系列化合物,目前仍然是研究者极感兴趣的研究对象,主要归因于它们在不同领域的广泛应用。其中一些均三嗪类衍生物表现出重要的生物特性:如六甲蜜胺(HMM)(化合物26)和2-氨基-4-吗啉基-均三嗪(化合物27)被应用于临床得益于它们对肺癌、乳腺癌和卵巢癌的抗癌特性[27-29]。羟甲基五甲蜜胺(HMPMM)(化合物28)也是一种羟基化的代谢产物,与HMM具有相应的活性。近年来,又有许多结构类似的化合物对人类癌细胞和鼠科白细胞系表现出抗肿瘤活性[30]。
具有较好抗癌活性的均三嗪类衍生物见图5。
以细胞DNA为靶标的化学疗法药物已被确定为临床上治疗癌症最有效的药物类型。Kapil Arya课题组曾制备了一系列结构相关的化合物并对它们的细胞杀灭效果进行了广泛研究,大部分的这类分子设计依赖于与DNA相互作用产生的细胞毒性,随后引起大量的DNA损坏,最后导致细胞的死亡。
以分子筛为多相催化剂已被广泛应用于石油炼制和化学工业,同样也用于制备精细化学品,这归功于其特定的性质特征,如强酸性、天然性质、高的热稳定性和空间选择性。微波技术在有机合成中的应用潜力巨大,特别是在无溶剂条件下,由于反应简单、环境影响小和耗时短,为多样性分子的大量合成提供了一条捷径。
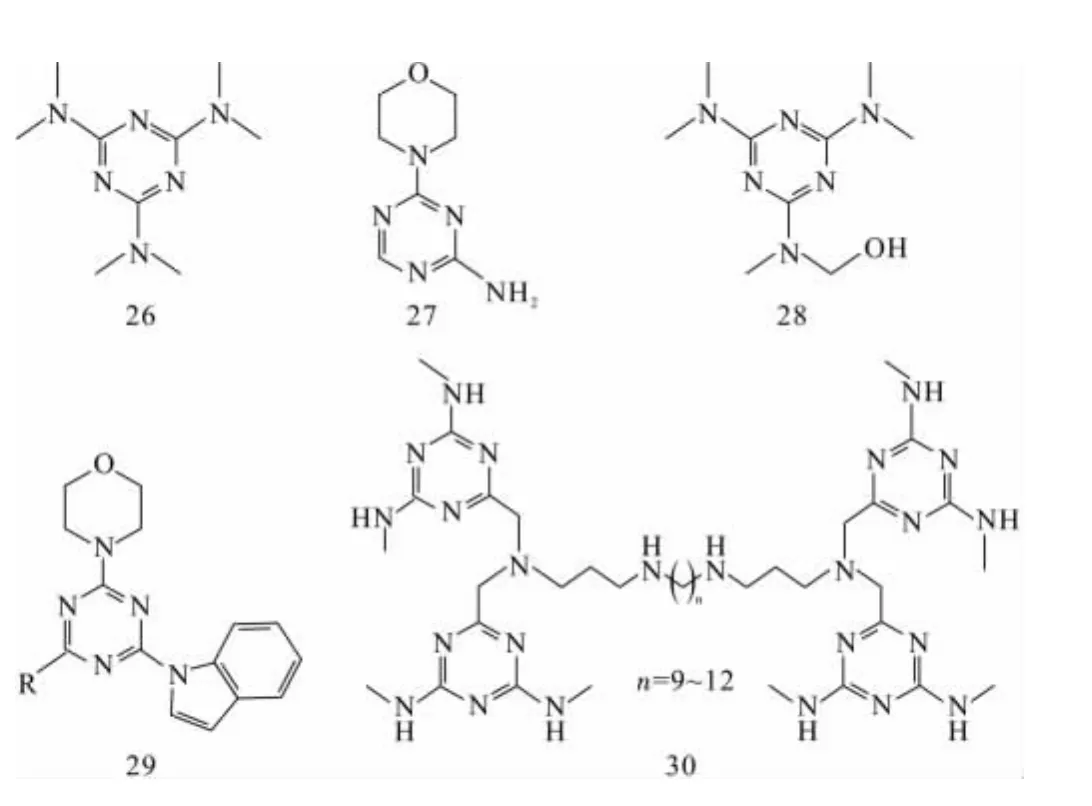
图5 具有较好抗癌活性的均三嗪类衍生物Fig.5 The structures of s-triazine derivatives with good antitumor activity

图6 2,4-二氨基-6-芳基-1,3,5-三嗪的固相合成Fig.6 Solid-phase synthesis of 2,4-diamino-6-aryl-1,3,5-triazines
从不同的包含了1,3,5-三嗪环的分子观察到了不同的生物活性,这促使研究者去发现新的潜在的包含1,3,5-三嗪环的化合物,以获得简单、环境友好、可行的合成方法来制得具有生物动力学的杂环取代的均三嗪类衍生物。
文献报道过一种一锅煮方法,即以HY型分子筛为催化剂,用三聚氯氰与芳香化合物或脂肪族化合物、酰胺和水在微波照射、无溶剂下合成2,4,6-三取代-1,3,5-三嗪。该方法操作简单、避免使用溶剂和固体负载、产率高、耗时短,合成得到的部分目标化合物表现出极高的抗结核和藻类活性[31]。
2009年,浙江大学药学院胡章等利用固相合成方法合成2,4-二氨基-6-芳基-1,3,5-三嗪(化合物31),并对其抗肿瘤(主要针对肿瘤细胞系如PC-3、K562、A549和HO8910)活性进行研究,发现大部分化合物对PC-3、K562、HO8910细胞系显示出显著的抗增殖活性,最后对其构效关系进行了分析。2,4-二氨基-6-芳基-1,3,5-三嗪的平行合成(图6)是在固相上利用“袋包茶”法合成的[32]。
2.2 酶抑制剂和以蛋白质为靶标的抑制剂
2002年,美国百时美施贵宝药物研究所利用电子等排的原理,借助CADD平台合成了一系列肌苷单磷酸脱氢酶(IMPDH)三嗪抑制剂。前药霉酚酸(MPA)和它的一些衍生物表现为潜在的、无竞争性和可逆的人类IMPDHⅠ型和Ⅱ型抑制剂[33,34]。由于其引起的一系列胃肠副反应,重新设计出VX-497作为IMPDH抑制剂,进而通过尿素等排体,发现苯肼与简单胺反应得到的类似杂环化合物三唑是一个潜在的IMPDH抑制剂。分析三唑的结构发现,以三嗪代替三唑骨架更容易衍生出不同类型的化合物。将MPA绑定到IMPDH上的晶体结构已报道,在此基础上,得到了一个将三嗪对接到IMPDH活性位点的模型,三嗪环上的氨基作为附加基团可以与甲硫氨酸420、谷氨酰胺441、丝氨酸276或溶剂形成一个试剂对接的连接点[35]。对接中得分较好的化合物在最后选择前先运用Lipinski规则进行预筛选,合成出更多的化合物以提供更完整的SAR研究。该合成路线以三聚氯氰为原料,与苄基溴化镁反应得到2,4-二氯-6-苯基-1,3,5-三嗪,再分别与含氨基和羟基或醇的盐经过一系列的亲核取代反应得到两种不同类型的化合物库。最后研究了这些化合物对IMPDHⅡ型抑制剂的催化活性的SAR,筛选出了活性比较好的几个化合物32、33、34、35、36、37[36]。
2013年,波士顿大学化学学院Ranjan Banerjee等的研究将三嗪作为流线型的目标识别共价抑制剂模式化骨架。小分子抑制剂能加速功能注释和验证具有治疗疾病潜力的蛋白质,表型筛选为确认这些药物提供了一个有效的平台,却常常受到与目标识别相关的障碍。对于许多蛋白质靶标,克服这些瓶颈问题可以通过整合成小分子的亲电试剂以共价键在体内作用,采用生物正交处理,从而直接由一个复杂的蛋白质组来丰富蛋白质靶标。三官能化三嗪作为一个比较理想的模式化骨架适用于生产多样性的靶标特异性的不可逆抑制剂化合物库,通过制定不同的合成方案衍生出带亲电试剂的三嗪对靶蛋白进行共价修饰。该项研究的平台集中在一个小分子库,包含以下几个部分:(1)刚性三嗪环;(2)氯乙酰胺、氯硝基苯甲基或丙烯酰胺(R2)类的半胱氨酸残基[37-39];(3)末端炔基(R1);(4)多样性的可变的基团(R3)。三官能化三嗪的合成路线采用曾报道过的固相合成路线来进行液相合成[40]。再将得到的化合物进行细胞溶菌作用研究,以期找到能够与蛋白质或蛋白质组进行特异性结合的靶标化合物。最后发现化合物38、39对单一的蛋白质靶标具有很高的选择性。目前作者所在实验室正在研究基于三嗪骨架的酪氨酸酶抑制剂的分子设计和合成,期望能够得到活性较好的化合物。
一些均三嗪类抑制剂见图7。

图7 一些均三嗪类抑制剂Fig.7 The structures of some s-triazine inhibitors
3 生物能源领域
随着社会的高速发展,能源的需求量与日俱增,寻求新能源势在必行,近年来研究者对均三嗪类衍生物的作用研究范围进一步扩大。脂类是生物研究对象中最重要的主题之一,因为很多疾病包括糖尿病、肥胖症和癌症都是由其异常的摄取、合成、新陈代谢、储存和调节引起的。此外,全球能源危机使脂类研究更加重要,微生物和植物产生的脂类能为人类社会提供持续的生物燃料,前景广阔。
2012年,韩国浦项科技大学和美国纽约大学化学系指出既然通过微生物和植物产生生物油脂,为人类的可持续能源提供了一条潜在的途径,那么就可以通过化学基因学的方法来达到这一目的,即利用化学方法寻找到新的化合物提高微生物和植物的生物能源的产量。他们筛选出新的含4,6-二芳基和4-芳基,6-烷基-1,3,5-三嗪库,期望利用化学遗传方法对这类化合物进行鉴别,旨在提高耶氏解脂酵母(因其脂质代谢途径广泛而得名)对于中性油脂的积累。Jaoon Y.H.Kim等利用组合化学固相合成方法合成4,6-二芳基和4-芳基,6-烷基-1,3,5-三嗪(化合物40)(图8),并研究其在生物燃料生产中的有效利用。针对易于控制和三嗪骨架广泛的生物特性,组合化学方法研究和衍生化研究进展很快。均三嗪类衍生物能够很容易由三聚氯氰与胺、硫醇和乙醇等含有C杂原子骨架的化合物制备。相反,由C-C骨架衍生化的三嗪骨架研究较少[41,42]。利用此方法合成了纯度为90%的120个化合物但并未进一步提纯,为了找出能够促进脂质在耶氏解脂酵母中积累的化合物,将细胞培养至对数期,用库中个别的化合物处理,用染色法分析中性脂质的含量,筛选发现只有一个均三嗪化合物能够显著地提高脂质产量,此化合物具有有效的生物脂质活性。

图8 4,6-二芳基-1,3,5-三嗪和4-芳基,6-烷基-1,3,5-三嗪的合成Fig.8 Synthesis of 4,6-diaryl-triazines and 4-aryl,6-alkyl-1,3,5-triazines
尽管芳基-芳基序列是一个众所周知的药效基团并被广泛用于此类骨架化合物的合成,二芳基或芳基和烷基取代的均三嗪的合成却很受限制[43]。Jaoon Y.H.Kim 课题组报道了利用 Grignard反应[44]和Suzuki偶联[45]有效合成含单个C-C骨架均三嗪的方法,并预测含2个C-C骨架的均三嗪衍生物将为新颖生物活性的发现开辟出新的空间。
4 均三嗪类衍生物金属配合物的研究进展
均三嗪类衍生物具有潜在的抗肿瘤活性[46,47]、酶抑制剂活性[48]、抗真菌活性、抗病毒活性以及其它的生物活性。然而这类化合物的金属配合物的生物应用却很少受到关注,原因主要是这类化合物在水和有机溶剂中的溶解性较差[49]。
2006年,Ma等[50]以小牛胸腺DNA为研究目标,合成了含均三嗪衍生物的钌配合物(化合物41)和铼配合物(化合物42),研究了其与DNA作用的位点和细胞毒性,发现配合物对人类癌细胞系 KB-3-1、HepG2和Hela以及多耐药性细胞系KB-V-1均具有中等强度的细胞毒性。
Chen等[51]研究合成了三核的2,4,6-三(二-2-吡啶基胺)-1,3,5-三嗪铜(Ⅱ)配合物,该配合物解决了水溶性差的缺陷,并显示出很好的DNA裂解活性,是第一个在水中显示出具有此种性质的基于三嗪骨架的金属配合物。
Koc等[52]合成了以手性铁和希夫碱相连接的2,4,6-三(2,5-二羧基苯胺-4-甲酰基苯氧基)-1,3,5-三嗪和2,4,6-三(4-二羧基苯胺-4′-甲酰基苯氧基)-1,3,5-三嗪两个类型的配合物(化合物43)。其合成路线是首先合成金属配体,然后合成均三嗪衍生物,最后将金属配体和衍生物结合起来得到目标化合物,其活性还在进一步研究中。
均三嗪类衍生物金属配合物见图9。
2007年,Shavit等[53]报道了基于氧配位体的非茂钛配合物抗肿瘤活性研究,在确定影响钛配合物抗肿瘤活性的因素和水解稳定性的作用时,发现以均系的羟基氨基-1,3,5-三嗪为配体的化合物44(合成路线见图10)具有很好的水解稳定性。并进一步研究了其对卵巢OVCAR-1和结肠HT-29细胞的抗肿瘤活性,与参考物Ti(OiPr)4和 TiCl4(THF)2比较,两种基准的钛配合物与肿瘤细胞毫无反应,而惰性的均系三嗪配体则具有温和的反应活性。
5 结语

图9 均三嗪类衍生物的金属配合物Fig.9 The complexes of s-triazine ligands with metals
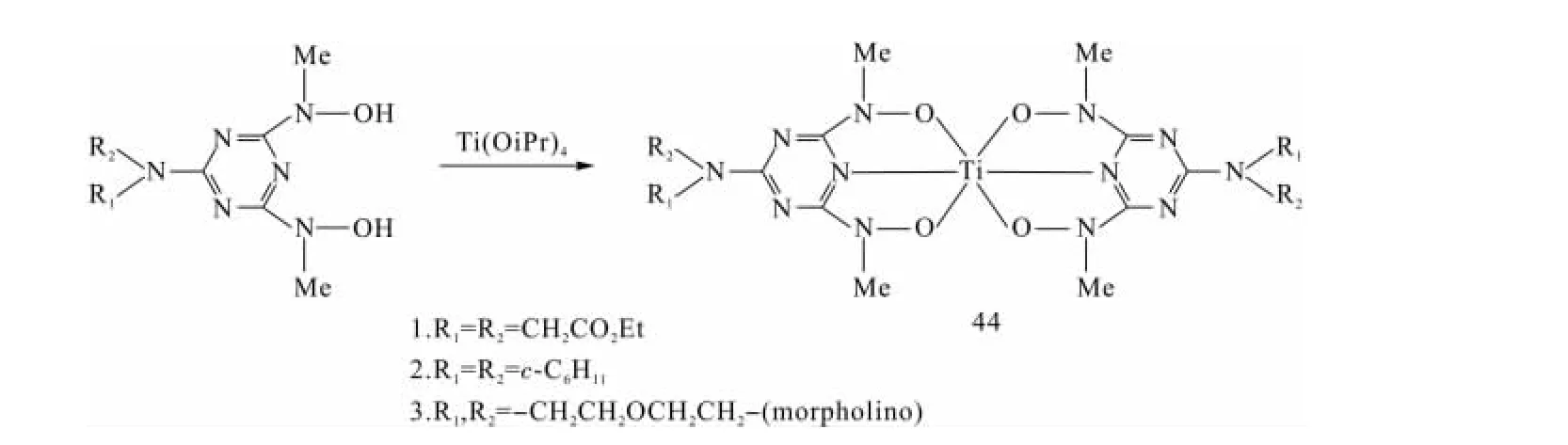
图10 基于均三嗪配体的非茂钛配合物的合成路线Fig.10 Synthetic route of non-metallocene titanium complexes of s-triazine-based ligands
除了农药、医药、生物能源等主要应用领域外,均三嗪类衍生物还广泛应用于多功能润滑油添加剂、阻燃剂、有机光电功能材料、紫外吸收剂以及糖尿病的治疗等。经过多年的研究,已有众多合成均三嗪类衍生物的方法,这些方法旨在寻找更高效、对环境友好的路线,更好地为人类服务。如借助计算机辅助药物分子设计手段,利用电子等排原理、药效基团拼接和SAR等原理,筛选出活性较好具有潜在应用价值的化合物结构,进一步扩大其应用领域。随着社会经济的高速发展,耐药性和不良反应的存在,迫使人们寻找出更好的新型药物,那么一方面需对已有化合物的结构进一步修饰,另一方面要设计并合成出潜在活性更好的化合物。研究者应用均三嗪类衍生物为配体与金属化合物配合,发展新型金属基础疗法,实现无机物与有机物的结合,例如与铜(Ⅱ)、铁(Ⅲ)、铼(Ⅰ)和钌(Ⅱ)等金属化合物的配合,具有抗癌、抑制剂和除草等方面显著的活性,应用前景广阔。此类研究的难点是配合物的水溶性和在常用有机溶剂中的溶解性比较差,必须克服这一缺点,从而使其具有更好的开发和应用价值。另外,目前研究的重点对象生物分子靶标如DNA,通过结构修饰的过渡金属配合物之间的相互作用来设计核酸酶类似物,使其具有显著DNA裂解活性。此外,均三嗪类衍生物的应用范围已进一步扩大到环境领域。Wang等[54]研制的偶氮苯类均三嗪化合物,可作为潜在的高能量密度材料。总之,未来均三嗪类衍生物还具有很大很广阔的发展空间。
[1]杨梅,林忠胜,姚子伟,等.均三嗪类除草剂莠去津的研究进展[J].农药科学与管理,2006,27(11):31-37.
[2]Gruessner B,Watzin M C.Patterns of herbicide contamination in selected vermont streams detected by enzyme immunoassay and gas chromatography/mass spectrometry[J].Environment Science& Technology,1995,29(11):2806-2813.
[3]Kumar A,Srivastava K,Kumar S R,et al.Synthesis and bioevaluation of hybrid 4-aminoquinoline triazines as a new class of antimalarial agents[J].Bioorganic & Medicinal Chemistry Letters,2008,18(24):6530-6533.
[4]Agarwal A,Srivastava K,Puri S K,et al.Synthesis of substituted indole derivatives as a new class of antimalarial agents[J].Bioorganic & Medicinal Chemistry Letters,2005,15(12):3133-3136.
[5]Katiyar S B,Srivastava K,Puri S K,et al.Synthesis of 2-[3,5-substituted pyrazol-1-yl]-4,6-trisubstituted triazine derivatives as antimalarial agents[J].Bioorganic & Medicinal Chemistry Letters,2005,15(22):4957-4960.
[6]Burgess S J,Selzer A,Kelly J X,et al.A chloroquine-like molecule designed to reverse resistance in Plasmodium falciparum [J].Journal of Medicine Chemistry,2006,49(18):5623-5625.
[7]Klenke B,Stewart M,Barrett M P,et al.Synthesis and biological evaluation of s-triazine substituted polyamines as potential new anti-trypanosomal drugs[J].J Med Chem,2001,44(21):3440-3452.
[8]Son Y A,Park Y M,Park S Y,et al.Exhaustion studies of spiroxazine dye having reactive anchor on polyamide fibers and its photochromic properties[J].Dyes and Pigments,2007,73(1):76-80.
[9]周春晖,杨安妮,李敏,等.组合化学方法合成1,3,5-均三嗪类化合物及其抗菌活性研究[J].国外医药:抗生素分册,2009,30(1):1-4.
[10]Silen J L,Lu A T,Solas D W,et al.Screening for novel antimicrobials from encoded combinatorial libraries by using a two-dimensional agar format[J].Antimicrob Agents Chemother,1998,42(6):1447-1453.
[11]Min J,Kim Y K,Cipriani P G,et al.Forward chemical genetic approach identifies new role for GAPDH in insulin signaling[J].Nature Chemical Biology,2007,3(1):55-59.
[12]敖宇飞,王德先,王梅祥.一种均三嗪类衍生物作为杀菌剂的新用途[P].CN 101 884 329A,2010-11-17.
[13]陈华,谷云景,苑香果,等.含嘧啶氨基的三取代三嗪衍生物的合成及其抗菌、抗肿瘤活性研究[J].有机化学,2011,31(8):1266-1271.
[14]赵莲,苑香果,赵建鹏,等.含嘧啶氨基的三氨基取代三嗪衍生物的设计、合成及抗苹果树腐烂病菌活性[J].高等学校化学学报,2011,32(12):2795-2799.
[15]Zacharie B,Wilb N,Abbott S D.1,3,5-Triazine derivatives as protein A mimetics for the treatment of autoimmune diseases[C].Christopher Penney 232nd ACS National Meeting,San Francisco,Sept.10-14,2006,MEDI-213.
[16]Lowe L R,Sproule K,Li R,et al.Triazine based ligands and use thereof[P].USP 6 117 996,2000-09-12.
[17]Min J,Kim Y K,Cipriani P G,et al.Forward chemical genetic approach identifies new role for GAPDH in insulin signaling[J].Nat Chem Biol,2007,3(1):55-59.
[18]Uttamchandani M,Walsh D P,Khersonsky S M,et al.Microarrays of tagged combinatorial triazine libraries in the discovery of small-molecule ligands of human IgG[J].J Comb Chem,2004,6(6):862-868.
[19]Garaj V,Puccetti L,Fasolis G,et al.Carbonic anhydrase inhibitors:Novel sulfonamides incorporating 1,3,5-triazine moieties as inhibitors of the cytosolic and tumour-associated carbonic anhydrase isozymesⅠ,ⅡandⅨ[J].Bioorg Med Chem Lett,2005,15(12):3102-3108.
[20]Brzozowski Z,Saczewski F.Synthesis and antitumor activity of novel 2-amino-4-(3,5,5-trimethyl-2-pyrazolino)-1,3,5-triazine derivatives[J].Eur J Med Chem,2002,37(9):709-720.
[21]Brzozowski Z,Saczewski F,Gdaniec M.Synthesis,structural characterization and antitumor activity of novel 2,4-diamino-1,3,5-triazine derivatives[J].Eur J Med Chem,2000,35(12):1053-1064.
[22]Kuo G H,Deangelis A,Emanuel S,et al.Synthesis and identification of[1,3,5]triazine-pyridine biheteroaryl as a novel series of potent cyclin-dependent kinase inhibitors[J].J Med Chem,2005,48(14):4535-4546.
[23]Robert J,Jarry C.Multidrug resistance reversal agents[J].J Med Chem,2003,46(23):4805-4817.
[24]Dietrich H,Giencke W,Klein R.The design and synthesis of a herbicide targeted library of N-[1-(1,3-benzoxazol-2-yl)alkyl]-6-alkyl-1,3,5-triazine-2,4-diamines[J].Combinatorial Chemistry& High Throughput Screening,2005,8(7):623-629.
[25]Giencke W,Willms L,Bauer K,et al.2,4-Diamino-1,3,5-triazines,their preparation,and their use as herbicides and plant growth regulators[P].WO 97 029 095,1997-08-14.
[26]敖宇飞,王德先,王梅祥.均三嗪类衍生物及其制备方法与作为杀虫剂的新用途[P].CN 101 885 707B,2012-08-29.
[27]Nishii M,Kobayashi I,Uemura M,et al.Preparation of triazine derivatives as herbicides[P].EP 1994 0 104 027,1994-10-19.
[28]Giencke W,Minn K,Willms L,et al.2,4-Diamino-1,3,5-triazines,process for their preparation,and their use as herbicidesand plant growth regulators[P].USP 6 239 071B1,2001-05-29.
[29]Riebel H J,Lehr S,Stelzer U,et al.Substituting of 2-amino-4-alkylamino-1,3,5-triazines as herbicides[P].USP 6 284 710B1,2001-09-04.
[30]Matsuno T,Karo M,Sasahara H,et al.Synthesis and antitumor activity of benzimidazolyl-1,3,5-triazine and benzimidazolylpyrimidine derivatives[J].Chem Pharm Bull,2000,48(11):1778-1781.
[31]Arya K,Dandia A.Synthesis and cytotoxic activity of trisubstituted-1,3,5-triazines[J].Bioorg Med Chem Lett,2007,17(12):3298-3304.
[32]Hu Z,Ma T,Chen Z,et al.Solid-phase synthesis and antitumor evaluation of 2,4-diamino-6-aryl-1,3,5-triazines[J].J Comb Chem,2009,11(2):267-273.
[33]Anderson W K,Boehm T L,Makara G M,et al.Synthesis and modeling studies with monocyclic analogues of mycophenolic acid[J].J Med Chem,1996,39(1):46-55.
[34]Nelson P H,Eugui E,Wang C C,et al.Synthesis and immunosuppressive activity of some side-chain variants of mycophenolic acid[J].J Med Chem,1990,33(2):833-838.
[35]Sun Y,Ewing T J A,Skillman A G,et al.CombiDOCK:Structure-based combinatorial docking and library design[J].J Comput Aided Mol Des,1998,12(6):597-604.
[36]Pitts W J,Guo J,Dhar T G M,et al.Rapid synthesis of triazine inhibitors of inosine monophosphate dehydrogenase[J].Bioorg Med Chem Lett,2002,12(16):2137-2140.
[37]Weerapana E,Simon G M,Cravatt B F.Disparate proteome reactivity profiles of carbon electrophiles[J].Nature Chem Biol,2008,4(7):405-407.
[38]Leesnitzer L M,Parks D J,Bledsoe R K,et al.Functional consequences of cysteine modification in the ligand binding sites of peroxisome proliferator activated receptors by GW9662[J].Biochemistry,2002,41(21):6640-6650.
[39]Sechi S,Chait B T.Modification of cysteine residues by alkylation:A tool in peptide mapping and protein identification[J].A-nal Chem,1998,70(24):5150-5158.
[40]Zhou C,Min J,Liu Z,et al.Synthesis and biological evaluation of novel 1,3,5-triazine derivatives as antimicrobial agents[J].Bioorg Med Chem Lett,2008,18(4):1308-1311.
[41]Tounge B A,Reynolds C H.Defining privileged reagents using sub-similarity comparison:A method for reagent ranking[J].J Chem Inf Comput Sci,2004,44(5):1810-1815.
[42]Tejedor D,Garcia-Tellado F.Chemo-differentiating ABB′multicomponent reactions:Privileged building blocks[J].Chem Soc Rev,2007,36(3):484-491.
[43]Konno S,Osawa N,Yamanaka H.Synthesis of 6-substituted 3,5-diaryl-1,2,4-triazines as potential herbicidal agents[J].J Agric Food Chem,1995,43(3):838-842.
[44]Lee J W,Bork J T,Ha H H,et al.Novel orthogonal synthesis of tagged combinatorial triazine library via Grignard reaction[J].Aust J Chem,2009,62(9):1000-1006.
[45]Lee J W,Ha H H,Vendrell M,et al.Combinatorial solid-phase synthesis of 6-aryl-1,3,5-triazines via Suzuki coupling[J].Aust J Chem,2011,64(5):540-544.
[46]Menicagli R,Samaritani S,Signore G,et al.In vitro cytotoxic activities of 2-alkyl-4,6-diheteroalkyl-1,3,5-triazines:New molecules in anticancer research[J].J Med Chem,2004,47(19):4649-4652.
[47]Balaban A T,Oniciu D C,Katritzky A R.Aromaticity as a cornerstone of heterocyclic chemistry[J].Chem Rev,2004,104(5):2777-2812.
[48]Mylari B L,Oates P J,Zembrowski W J,et al.A sorbitol dehydrogenase inhibitor of exceptional in vivo potency with a long duration of action:1-(R)-{4-[4-(4,6-dimethyl[1,3,5]triazin-2-yl)-2R,6S-dimethylpiperazin-1-yl]pyrimidin-2-yl}ethanol[J].J Med Chem,2002,45(20):4398-4401.
[49]Khersonsky S M,Jung D W,Kang T W,et al.Facilitated forward chemical genetics using a tagged triazine library and zebrafish embryo screening[J].J Am Chem Soc,2003,125(39):11804-11805.
[50]Ma D L,Che C M,Siu F M,et al.DNA Binding and cytotoxicity of ruthenium(Ⅱ)and rhenium(Ⅰ)complexes of 2-amino-4-phenylamino-6-(2-pyridyl)-1,3,5-triazine[J].Inorganic Chemistry,2007,46(3):740-749.
[51]Chen J W,Wang X Y,Shao Y,et al.A trinuclear copper(Ⅱ)complex of 2,4,6-tris(di-2-pyridylamine)-1,3,5-triazine shows prominent DNA cleavage activity[J].Inorganic Chemistry,2007,46(8):3306-3312.
[52]Koc Z E,Ucan H I.Complexes of iron(Ⅲ)salen and saloph Schiff bases with bridging 2,4,6-tris(2,5-dicarboxyphenylimino-4-formylphenoxy)-1,3,5-triazine and 2,4,6-tris(4-carboxyphenylimino-4′-formylphenoxy)-1,3,5-triazine[J].Transition Metal Chemistry,2007,32(5):597-602.
[53]Shavit M,Peri D,Melman A,et al.Antitumor reactivity of nonmetallocene titanium complexes of oxygen-based ligands:Is ligand lability essential?[J].J Biol Inorg Chem,2007,12(6):825-830.
[54]Wang F,Du H C,Zhang J Y,et al.Comparative theoretical studies of energetic azo-s-triazines[J].J Phys Chem A,2011,115(42):11852-11860.
