肾细胞癌靶向治疗的现状与进展
2013-04-04邹鲁佳姜昊文丁强
邹鲁佳 姜昊文 丁强
(复旦大学附属华山医院泌尿外科 上海 200040)
肾癌(renal cell carcinoma, RCC)是肾脏最常见的恶性疾病,约占成人恶性肿瘤的2.0%~3.0%[1]。肾癌对放疗及化疗多不敏感,手术根治是以往肾癌的主要治疗手段。研究发现,由于VHL(Von Hippel Lindau)基因失活致使缺氧诱导因子(HIF)蓄积,导致血管内皮生长因子(VEGF)和血小板衍化生长因子(PDGF)的过度表达,最终促进肿瘤血管生成[2-4]。该过程加速了肾癌的发生与发展,这也是肾癌靶向治疗的基础。
自2005年美国FDA批准索拉非尼(多吉美)用于治疗转移性肾癌以来,陆续有舒尼替尼(索坦)、贝伐单抗联合干扰素α、帕唑帕尼(votrient)、替西罗莫司(替西莫司)(torisel)、依维莫司(afinitor)、阿西替尼(inlyta)等分子靶向药物面世。新的以肿瘤血管生成为靶向的药物正在研究当中,而新药物之间或与细胞因子联合使用的研究也正在开展。目前我国仅有索拉非尼与舒尼替尼上市。本文就2013版EAU《肾癌指南》(European Association of Urology)对肾细胞癌靶向治疗药物的临床疗效、不良反应、药物间联合及序贯使用等情况进行介绍。
1 数据库联盟模型
目前已批准的靶向药物在其III期临床试验中,患者的风险分层主要是根据2002年版Sloan-Kettering纪念癌症中心(MSKCC)模型制定的[5]。由于MSKCC模型建立于细胞因子治疗的时代,国际数据库联盟建立了一个新的风险分层模型-数据库联盟模型(DCM模型)。DCM模型对靶向治疗时代患者的预后具有更准确的预测作用。DCM模型在MSKCC模型的原有基础上,加入了中性粒细胞增多症和血小板增多症两项标准,而乳酸脱氢酶(LDH)则不再被认为是与预后相关的因素[6]。该模型目前已证实其有效性,同时与克利夫兰临床基金会(CCF)风险模型、法国模式、美国模式和国际肾脏肿瘤工作组(IKCWG)模型有相当的预测作用[7]。
2 酪氨酸激酶抑制剂(TKI)
2.1 索拉非尼
索拉非尼为口服制剂,其具有多激酶抑制剂活性,可抑制Raf-1丝氨酸/苏氨酸激酶、B-Raf、血管内皮生长因子受体2(VEGFR-2)、血小板衍化生长因子受体(PDGFR)、Fms样酪氨酸激酶3(FLT-3)与c-KIT的活性。其III期临床试验比较了索拉非尼和安慰剂用于系统免疫治疗无效或不适合免疫治疗的患者的疗效,试验结果显示,索拉非尼组较安慰剂组无进展生存期延长3个月[8]。由安慰剂改用索拉非尼治疗,患者的生存期有所提高[9]。
2.2 舒尼替尼
舒尼替尼是一种羟吲哚酪氨酸激酶(TK)抑制剂,其选择性地抑制PDGFR、VEGFR、c-KIT和FLT-3,并具有抗肿瘤和抗血管生成活性。其II期临床试验证实:舒尼替尼作为二线单药治疗转移性肾癌,34.0%~40.0%的患者表现出部分反应,27.0%~29.0%的患者病情稳定达3个月以上[10]。
一项重要的III期临床试验比较了舒尼替尼与干扰素α(IFN-α)作为一线单药的治疗作用,舒尼替尼组具有更长的无进展生存期(11个月vs5个月,P<0.0001)。该结果表明:对于中低风险的转移性肾癌患者,IFN-α单药治疗效果不如舒尼替尼[11]。舒尼替尼组与IFN-α组的总体生存期分别为26.4个月和21.8个月(P=0.05)[11]。对于由IFN-α改用舒尼替尼的患者(n=25),两组的中位生存期分别为26.4个月与20个月(P=0.03)。对于研究后未接受任何治疗的患者,舒尼替尼组和IFN-α组的总体中位生存期分别为28.1个月与14.1个月(P=0.003)。
另一项II期临床随机试验纳入292例患者,比较了舒尼替尼50 mg/d(用药4周+停药2周)与舒尼替尼37.5 mg/天(连续用药)治疗转移性肾癌的效果[12]。舒尼替尼50 mg组(n=146)的中位疾病进展时间为9.9个月,而连续给药37.5 mg组(n=146)为7.1个月。舒尼替尼50 mg组的总体反应率为32.0%,而连续给药37.5 mg组为28.0%。两组的总体生存期(23.1个月和23.5个月,P=0.615)、常见不良事件或患者的肾癌症状主诉未见显著差异。虽在统计学上无显著意义,然而50 mg组的疾病进展时间在数值上更长,因此作者推荐此方案。
2.3 帕唑帕尼
帕唑帕尼是一种口服的血管生成抑制剂,其可抑制VEGFR、PDGFR与c-KIT活性。一项前瞻性随机试验比较了帕唑帕尼与安慰剂分别用于未经治疗的转移性肾癌患者和细胞因子治疗后的患者,前者无进展生存期和肿瘤反应具有显著的改善(9.2个月vs4.2个月)[13]。该试验表明,帕唑帕尼可作为转移性肾癌患者的一线用药选择。但由于其III期试验初始阶段较其他靶向药物的III期临床研究纳入的患者数量少,故将帕唑帕尼推荐作为一线治疗的第二选择。最近,一项III期非劣效性随机试验(COMPARZ)显示,帕唑帕尼与舒尼替尼的治疗效果并无显著差异,其不同表现在两种药物的毒性反应。由于随访时间较短,这些数据并不成熟,尤其是对于肿瘤缓解而言。COMPARZ试验一个主要的缺陷是研究招募的近1/3患者为亚洲患者。由于药物副作用具有种族差异,对于本试验的总体评价仍应相对保守,因此也难以以此作为所有患者群体的参考。尽管如此,COMPARZ试验依然确立了帕唑帕尼作为一线治疗的选择。
2.4 阿西替尼
阿西替尼是一种口服制剂,为第二代的VEGFR-1、2、3选择性抑制剂,其可在纳摩尔药物浓度水平阻滞VEGFR受体,而对其他靶蛋白达到最小程度的抑制,并具有较短的半衰期。一项III期随机试验(AXIS)比较了阿西替尼与索拉非尼用于治疗细胞因子或其他靶向药物治疗无效患者的疗效[14]。由于当时的试验设计缺乏VEGF靶向治疗无效后二线治疗的标准方案,因此将索拉非尼作为对照。该试验纳入了723例患者,随机接受阿西替尼治疗的患者,其中位无进展生存期从5个月提高到了7个月,改善达40.0%。阿西替尼组总体中位无进展生存期为6.7个月,索拉非尼组则为4.7个月(HR=0.67;95%CI: 0.54~0.81)。而细胞因子治疗无效患者的无进展生存期差异最为显著。对于舒尼替尼治疗无效的患者(阿西替尼组n=194,索拉非尼组n=195),阿西替尼组无进展生存期为4.8个月(95%CI,4.5~6.4),索拉非尼组则为3.4个月(95%CI,2.6~4.7)。
AXIS试验显示,阿西替尼具有不低于3级的毒性作用,包括11.0%患者的腹泻、16.0%的高血压和11.0%的乏力。总体上,32.0%、24.0%和21.0%的患者分别出现恶心、呕吐或虚弱。然而由于该试验不允许两种VEGFR抑制剂交叉用药,作为二线治疗,阿西替尼和索拉非尼并没有表现出显著的差异。
2.5 Tivozanib
Tivozanib是一种口服制剂,为选择性的酪氨酸激酶抑制剂,其以全部3种VEGFR亚型为靶体,且具有较长的半衰期。在II期试验中Tivozanib显示出良好的药物活性和耐受性。总体反应率为24.0%(95%CI,19%~30%),中位无进展生存期为11.7个月(95%CI,8.3-14.3个月)。最常见的3、4级治疗相关不良事件为高血压(12.0%)[15]。2012年美国临床肿瘤学会(ASCO)会议报告了一项III期临床试验,比较了Tivozanib与索拉非尼用于未经治疗的或曾接受系统性非VEGF靶向治疗或哺乳动物雷帕霉素靶蛋白(mTOR)抑制剂治疗的转移性肾癌患者,但结果目前尚未完整公布。70.0%未经治疗的患者接受治疗后,Tivozanib组中位无进展生存期为12.7个月,索拉非尼组则为9.1个月(HR= 0.756;95%CI: 0.580~0.985)。对于所有患者群体,Tivozanib组与索拉非尼组的客观反应率分别为33.0%和23.0%。Tivozanib最常见的不良事件(所有等级≥3级)为高血压(46.0%/26.0%)、腹泻(22.0%/2.0%)、乏力(18.0%/5.0%)和中性粒细胞减少症(10.0%/2.0%)[16]。就该结果而言,若获得批准,Tivozanib将是一种有效性不亚于索拉非尼的酪氨酸激酶抑制剂。
3 抗VEGF单克隆抗体
贝伐单抗是一种人源化的与VEGF-A结合的单克隆抗体。对于免疫治疗难治性的患者,贝伐单抗10 mg/kg/2周给药可使总体反应率提高10.0%,同时与安慰剂组对照可提高无进展生存期[13]。一项双盲III期临床试验(AVOREN)(N=649)比较了贝伐单抗+IFN-α与IFN-α单一治疗用于转移性肾癌患者的疗效[17]。贝伐单抗+IFN-α组的总体反应率为31.0%,IFN-α单药组则为13.0%(P<0.0001)。贝伐单抗 +IFN-α组与 IFN-α单药组的中位无进展生存期分别为10.2个月和5.4个月,具有显著性差异(P<0.0001),但仅限中低风险患者,而高风险患者则无明显获益。AVOREN试验允许肿瘤进展后交叉更换药物。在该试验结果最近的一次更新中,贝伐单抗+IFN-α组与IFN-α单药组的中位总体生存期分别为23.3 个月和 21.3 个月(P<0.336)[18]。
另一项类似的试验(CALGB 90206)纳入了732例患者,比较了贝伐单抗(10mg/kg/2周静脉注射)联合IFN-α(900万单位,每周3次皮下注射)和IFN-α(900万单位,每周3次皮下注射)的治疗效果[19-20]。结果显示,联合用药的中位无进展生存期为8.5个月,而单一用药为5.2个月,两组使用交叉设计的中位总体生存期分别为18.3个月和17.4个月。与IFN-α单一用药相比,贝伐单抗联合IFN-α治疗有较高的客观反应率(ORR)[25.5%(95%CI,20.9%~30.6%)vs13.1%(95%CI:9.5%~17.3%),P<0.0001]。贝伐单抗联合 IFN-α的总体毒性率较高,3级高血压(9.0%vs0.0%)、厌食症(17.0%vs8.0%)、乏力(35.0%vs28.0%)和蛋白尿(13.0%0.0%)的发生明显更多。
4 哺乳动物雷帕霉素靶蛋白(mTOR)抑制剂
4.1 替西罗莫司
替西罗莫司是一种特异性的哺乳动物雷帕霉素靶蛋白(mTOR)抑制剂[21]。在一项III期临床试验(NCT00065468)中,高危的转移性肾癌患者随机分配接受替西罗莫司、IFN-α单药治疗或两种药物联合治疗。替西罗莫司组的总体生存期为10.9个月,IFN-α组则为7.3个月(P<0.0069),而联合用药组的总体生存期则改善不明显[22]。
4.2 依维莫司
依维莫司是一种口服mTOR抑制剂。一项III期试验(RECORD-1)比较了依维莫司联合最佳支持治疗(BSC)与安慰剂联合BSC用于抗VEGFR治疗无效的患者。依维莫司组的中位无进展生存期为4个月,安慰剂组则为1.9个月(P<0.001)。该试验中124例患者(46.0%)曾接受舒尼替尼作为唯一系统性治疗,其无进展生存期为4个月(95%CICI: 3.7~5.5个月)。由于RECORD-1试验中53.0%的患者在疾病进展前至少曾接受一种靶向治疗,往往在使用酪氨酸激酶抑制剂(TKIs)之前接受过细胞因子治疗,因此将该试验结果与AXIS试验相比分析具有一定复杂性。此外,该试验对曾接受舒尼替尼治疗患者的无进展生存期未予特别分析[2,23]。
5 序贯靶向治疗
目前尚无可以作为最佳序贯靶向治疗的推荐。AXIS试验是目前唯一比较两种TKI在曾使用TKI治疗无效后疗效的优效性III期随机试验。该试验结果如上所述。对于曾接受过舒尼替尼治疗的患者亚组,阿西替尼组与索拉非尼组无进展生存期的差异并不具统计学意义,且总体生存期也同样未见差异。目前有随机III期临床试验正在进行中,包括比较先索拉非尼、后舒尼替尼与先舒尼替尼、后索拉非尼的安全性和疗效的研究(SWITCH-I),以及比较序贯使用帕唑帕尼和索拉非尼与序贯使用索拉非尼和帕唑帕尼疗效的研究(SWITCH-II)。
6 靶向药物联合用药
由于尚无比较两种靶向药物联合使用与单药治疗的III期临床试验,目前尚无联合用药的推荐。曾有一项II期随机试验(TORAVA)报告了严重的毒性反应[24]。该试验表明,联合使用替西罗莫司和贝伐单抗的毒性反应较预期明显更多,并且与舒尼替尼或贝伐单抗+ IFN-α的标准治疗相比,毒性反应限制了治疗的可持续性。此外,与各种靶向序贯疗法的预期效益相比,联合用药的有效性较低。此项联合用药治疗缺乏进一步的研究。在一项II期非随机临床试验中,依维莫司与贝伐单抗的联合用药治疗被证实有效,并且除25.0%的患者出现了3/4级的蛋白尿,该联合治疗的毒性反应在可接受范围内[25]。另有一项比较依维莫司联合贝伐单抗+ IFN-α与IFN-α单一用药的II期随机试验正在进行中。
7 非透明细胞肾癌的靶向治疗
由于尚无针对非透明细胞肾癌患者系统性治疗的III期临床试验报道,目前尚无推荐用药方案。在一项II期非随机临床试验中,乳头状肾癌患者接受MET/VEGFR2双重抑制剂Foretinib治疗,证实该药物对于生殖细胞MET突变的患者有效,且具有可接受范围的毒性反应和较高的反应率[26]。若无临床试验作为依据,则可使用与肾透明细胞癌患者一致的治疗。
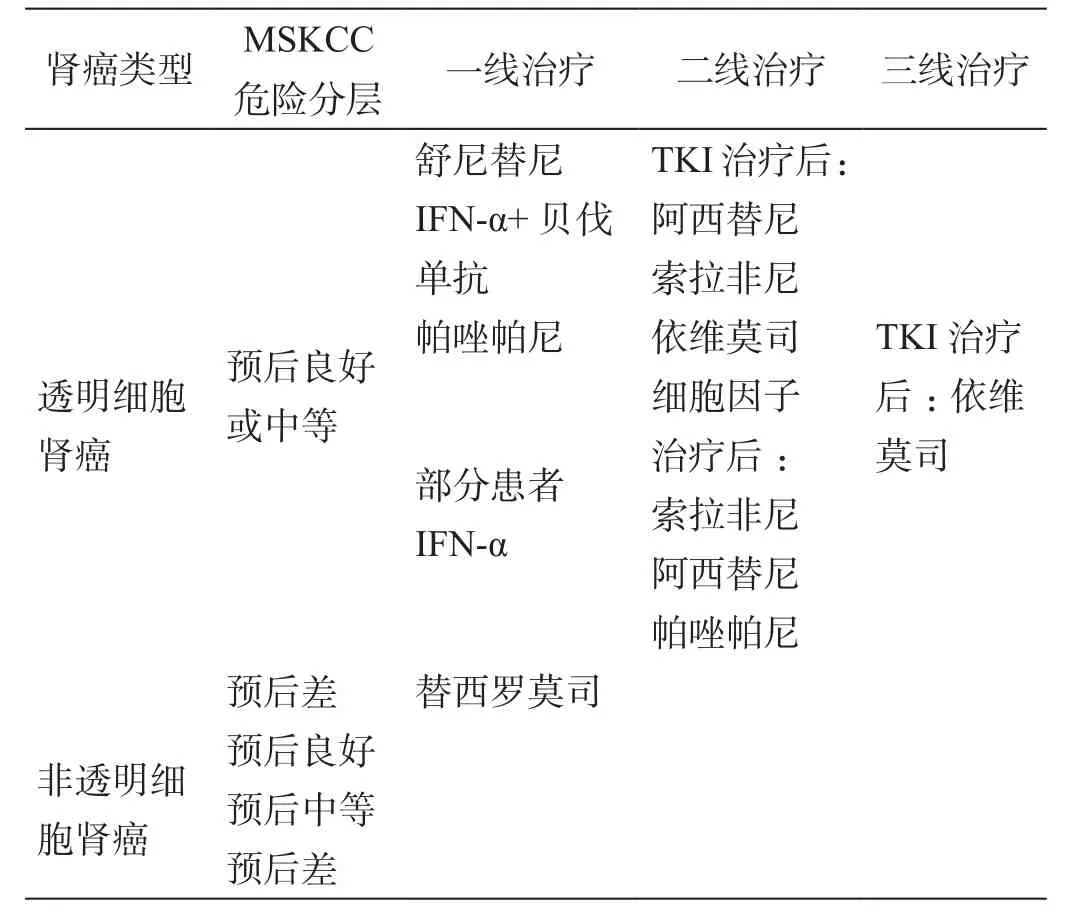
表1 2013年EAU循证医学关于转移性肾癌患者靶向治疗的一、二线推荐用药
8 总结与展望
自索拉非尼作为第一个用于转移性肾癌靶向的药物问世以来,越来越多的靶向药物投入了临床研究与应用,并取得了巨大的成功。随着诸多新药的面世,转移性肾癌的治疗方案也发生了日新月异的变化,但仍有相当严峻的挑战摆在面前。肾癌发生机制复杂,因此我们期待更多序贯用药、联合用药方案的出现,能够达到多靶点联合阻断的效果,并提高治疗效果,同时不增加毒性反应。转移性肾癌靶向治疗的发展空间,还有待我们的进一步探索。
参考文献
[1]李恩惠,夏术阶.晚期肾癌靶向治疗的现状与进展[J].现代肿瘤医学, 2012, 20(7): 1514-1518.
[2]Patel PH, Chadalavada RS, Chaganti RS,et al.Targeting von Hippel-Lindau pathway in renal cell carcinoma[J].Clin Cancer Res, 2006, 12(24): 7215-7220.
[3]Yang JC, Haworth L, Sherry RM,et al.A randomized trial of bevacizumab, an anti-vascular endothelial growth factor antibody, for metastatic renal cancer[J].N Engl J Med, 2003,349(5): 427-434.
[4]Patard JJ, Rioux-Leclercq N, Fergelot P.Understanding the importance of smart drugs in renal cell carcinoma[J].Eur Urol, 2006, 49(4): 633-643.
[5]Medical Research Council Renal Collaborators.Interferonalpha and survival in metastatic renal carcinoma: early results of a randomised controlled trial.Medical Research Council Renal Cancer Collaborators[J].Lancet, 1999, 353(9146): 14-17.
[6]Heng DY, Xie W, Regan MM,et al.Prognostic factors for overall survival in patients with metastatic renal cell carcinoma treated with vascular endothelial growth factortargeted agents: results from a large, multicenter study[J].J Clin Oncol, 2009, 27(34): 5794-5799
[7]Heng DY, Xie W, Regan MM,et al.External validation and comparison with other models of the International Metastatic Renal-Cell Carcinoma Database Consortium prognostic model: a population-based study[J].Lancet Oncol, 2013,14(2): 141-148.
[8]Escudier B, Eisen T, Stadler WM,et al.Sorafenib in advanced clear-cell renal-cell carcinoma[J].N Engl J Med, 2007,356(2): 125-134.
[9]Bellmunt J, Négrier S, Escudier B,et al.The medical treatment of metastatic renal cell cancer in the elderly:position paper of a SIOG Taskforce[J].Crit Rev Oncol Hematol, 2009, 69(1): 64-72.
[10]Motzer RJ, Michaelson MD, Redman BG,et al.Activity of SU11248, a multitargeted inhibitor of vascular endothelial growth factor receptor and platelet-derived growth factor receptor, in patients with metastatic renal cell carcinoma[J].J Clin Oncol, 2006, 24(1): 16-24.
[11]Motzer RJ, Hutson TE, Tomczak P,et al.Overall survival and updated results for sunitinib compared with interferon alfa in patients with metastatic renal cell carcinoma[J].J Clin Oncol,2009, 27(22): 3584-3590.
[12]Motzer RJ, Hutson TE, Olsen MR,et al.Randomized phase II trial of sunitinib on an intermittent versus continuous dosing schedule as first-line therapy for advanced renal cell carcinoma[J].J Clin Oncol, 2012, 30(12): 1371-1377.
[13]Sternberg CN, Davis ID, Mardiak J,et al.Pazopanib in locally advanced or metastatic renal cell carcinoma: results of a randomized phase III trial[J].J Clin Oncol, 2010, 28(6):1061-1068.
[14]Rini BI, Escudier B, Tomczak P,et al.Comparative effectiveness of axitinib versus sorafenib in advanced renal cell carcinoma (AXIS): a randomised phase 3 trial[J].Lancet,2011, 378(9807): 1931-1939.
[15]Nosov DA, Esteves B, Lipatov ON,et al.Antitumor activity and safety of tivozanib (AV-951) in a phase II randomized discontinuation trial in patients with renal cell carcinoma[J].J Clin Oncol, 2012, 30(14): 1678-1685.
[16]Berge EM, Bowles DW, Flaig TW,et al.Tivozanib: practical implications for renal cell carcinoma and other solid tumors[J].Drugs Today (Barc), 2013, 49(5): 303-315.
[17]Escudier B, Pluzanska A, Koralewski P,et al.Bevacizumab plus interferon alfa-2a for treatment of metastatic renal cell carcinoma: a randomised, double-blind phase III trial[J].Lancet, 2007, 370(9605): 2103-2111.
[18]Escudier B, Bellmunt J, Négrier S,et al.Phase III trial of bevacizumab plus interferon alfa-2a in patients with metastatic renal cell carcinoma (AVOREN): final analysis of overall survival[J].J Clin Oncol, 2010, 28(13): 2144-2150.
[19]Rini BI, Halabi S, Rosenberg JE,et al.Bevacizumab plus interferon alfa compared with interferon alfa monotherapy in patients with metastatic renal cell carcinoma: CALGB 90206[J].J Clin Oncol, 2008, 26(33): 5422-5428.
[20]Rini BI, Halabi S, Rosenberg JE,et al.Phase III trial of bevacizumab plus interferon alfa versus interferon alfa monotherapy in patients with metastatic renal cell carcinoma:final results of CALGB 90206[J].J Clin Oncol, 2010, 28(13):2137-2143.
[21]Larkin JM, Eisen T.Kinase inhibitors in the treatment of renal cell carcinoma[J].Crit Rev Oncol Hematol, 2006, 60(3): 216-226.
[22]Hudes G, Carducci M, Tomczak P,et al.Temsirolimus,interferon alfa, or both for advanced renal-cell carcinoma[J].N Engl J Med, 2007, 356(22): 2271-2281.
[23]Motzer RJ, Escudier B, Oudard S,et al.Efficacy of everolimus in advanced renal cell carcinoma: a double-blind,randomised, placebo-controlled phase III trial[J].Lancet,2008, 372(9637): 449-456.
[24]Negrier S, Gravis G, Perol D,et al.Temsirolimus and bevacizumab, or sunitinib, or interferon alfa and bevacizumab for patients with advanced renal cell carcinoma (TORAVA): a randomised phase 2 trial[J].Lancet Oncol, 2011, 12(7): 673-680.
[25]Hainsworth JD, Spigel DR, Burris HA 3rd,et al.Phase II trial of bevacizumab and everolimus in patients with advanced renal cell carcinoma[J].J Clin Oncol, 2010, 28(13): 2131-2136.
[26]Choueiri TK, Vaishampayan U, Rosenberg JE,et al.Phase II and biomarker study of the dual MET/VEGFR2 inhibitor foretinib in patients with papillary renal cell carcinoma[J].J Clin Oncol, 2013, 31(2): 181-186.
