交联草酸脱羧酶聚集体的制备及其性质
2013-03-07林日辉黄文勤李香香何美卿郑元博
梁 跃,林日辉,*,黄文勤,秦 梦,李香香,何美卿,郑元博
(1.广西民族大学化学化工学院,化学与生物转化过程新技术广西高校重点实验室,广西 南宁 530006;2.南宁奕德环境科技有限公司,广西 南宁 530003;3.东北大学理学院,辽宁 沈阳 110819)
交联草酸脱羧酶聚集体的制备及其性质
梁 跃1,林日辉1,*,黄文勤2,秦 梦1,李香香1,何美卿1,郑元博3
(1.广西民族大学化学化工学院,化学与生物转化过程新技术广西高校重点实验室,广西 南宁 530006;2.南宁奕德环境科技有限公司,广西 南宁 530003;3.东北大学理学院,辽宁 沈阳 110819)
为了获得缓解泌尿系统草酸盐结石病症的酶制剂,用无载体固定化方法üü交联酶聚集体(CLEAs)制备交联草酸脱羧酶聚集体。使用基因工程菌E.coli BL21(DE3)/pET32a/YvrK诱导表达制备草酸脱羧酶粗酶液,用30%的乙醇进行沉淀分离提纯,纯化倍数为2.7倍,酶活回收率91.2%;在戊二醛添加量为0.06%、pH5、牛血清白蛋白添加量0.5g/L、4℃的条件下处理该酶2h,得到交联草酸脱羧酶聚集体(oxdc-CLEAs),酶活回收率达95.4%;酶学性质研究表明,相对游离草酸脱羧酶,交联草酸脱羧酶聚集体的耐酸性、耐热性、耐胰蛋白酶降解能力均有提高。
草酸脱羧酶;交联酶聚集体(CLEAs);制备;性质
草酸(HOOCüCOOH)是自然界中酸性最强的有机二元酸,它以草酸盐的形式广泛的存在于植物、微生物和包括人在内的动物体内[1]。人体内没有降解草酸盐的相关酶,人们食用一些高草酸含量的食物后容易的造成草酸在人体内的积累,进而引发多种病理状态,如尿结石、肾结石、高草酸尿、低血钙症、VB6缺乏等[2-3],对结石主要成分的分析表明,80%为难溶的草酸钙[3]。在西方国家中,12%的人患有结石相关的疾病,而且泌尿系统结石病人经排石治疗后易复发,在中国复发率高达60%~80%[4]。目前对草酸水平升高的治疗方法都不是非常有效,主要通过限制草酸的摄入量来预防结石,而且许多原发性的高草酸尿患者需要密集的透析和器官移植,这大大增加了患者的痛苦和经济压力,因此需要寻求一种安全的从体内去除草酸盐的方法。通过服用某种酶制剂降解摄入体内的草酸盐,是缓解泌尿系统草酸盐结石病症,降低患者痛苦的有效方法[5]。
草酸脱羧酶(EC 4.1.1.2)是一种含锰的金属酶,它可以催化草酸脱羧为甲酸和CO2,是植物、微生物中草酸代谢降解的主要催化酶之一[6]。它主要来源于木材腐朽真菌,尤其是白腐菌,在动物中只有天竺鼠的肝脏中有发现该酶[7]。草酸脱羧酶在医疗、食品、工业生产和生物监测等领域都有非常大的应用潜力[8-9]。目前已有交联酶晶体法(CLECs)制成草酸脱羧酶酶制剂用于治疗草酸盐结石症的报道[10],但交联草酸脱羧酶晶体(oxdc-CLECs)的制备必须首先经过酶分子的结晶,所需的酶纯化程度和结晶条件都很高,操作困难,费用较高。2000年,荷兰Delft大学的Sheldon小组提出了交联酶聚集体(CLEAs)的固定化酶技术,该方法经过聚集和交联两个过程,聚集过程并没有造成蛋白质的失活[11-12]。与交联酶晶体法固定化技术相比,交联酶聚集体(CLEAs)方法具有对酶的纯化度要求不高、操作简单、成本低廉、设备简单、单位体积活性大、空间效率高的优点[11,13]。本实验对Bacillus subtilis来源的草酸脱羧酶进行诱导表达,制取草酸脱羧酶粗酶液,研究交联草酸脱羧酶聚集体(oxdc-CLEAs)制备的最适条件,并对交联草酸脱羧酶的性质进行研究,为草酸脱羧酶进一步的开发应用提供理论基础。
1 材料与方法
1.1 菌种与培养基
基因工程菌E.coli BL21(DE3)/pET32a/YvrK 本实验室保存。
LB培养基组成(g/L):培养基含蛋白胨 10、酵母提取物5、氯化钠10g,pH7.0。LB固体培养基添加18g琼脂粉。
1.2 试剂与仪器
草酸钾、甲酸脱氢酶 美国Sigma公司;氨苄青霉素、异丙基硫代-β-D-半乳糖苷(IPTG)、烟酰胺腺嘌呤二核苷酸磷酸(NAD)、牛血清白蛋白(BSA)、胰蛋白酶生工生物工程(上海)有限公司;无水乙醇、丙酮、戊二醛、甲酸钠、硫酸铵、柠檬酸、磷酸氢二钠、磷酸二氢钠、磷酸氢二钾、MnCl2均为国产分析纯。
TU-1901紫外-可见分光光度计 北京普析通用仪器;CR-22G高速冷冻离心机 日本日立公司; 1-13高速台式离心机 美国Sigma公司;超低温冰箱 美国Beckman公司;冰箱 中国海尔公司;JY92-Ⅱ超声波细胞粉碎机 宁波新芝公司;KJMR-Ⅳ血液混匀器、HH-2数显恒温水浴锅 国华电器公司。
1.3 方法
1.3.1 草酸脱羧酶的诱导表达
[14]方法,发酵培养基因工程菌E.coli BL21(DE3)/pET32a/YvrK,加入0.4mmol/L IPTG诱导表达草酸脱羧酶,收获菌体以50mmol/L pH8.0磷酸盐缓冲液提取获得粗酶液。
1.3.2 草酸脱羧酶的纯化
草酸脱羧酶粗酶液分别加入不同添加量的硫酸铵,无水乙醇和丙酮,4℃冰箱中过夜沉淀,10000r/min离心5min,收集沉淀,用50mmol/L pH8.0磷酸盐缓冲液重新溶解,分析酶活力回收及纯化效果。
1.3.3 草酸脱羧酶聚集体的制备与交联
取纯化酶液加入适量沉淀剂,4℃冰箱沉淀过夜,得到草酸脱羧酶聚集体悬浮液。添加戊二醛溶液至一定添加量,置于血液混合器进行振荡反应,10000r/min离心5min,弃上清液,用50mmol/L pH8.0磷酸盐缓冲液冲洗沉淀数次,获得交联草酸脱羧酶聚集体,4℃保存待用。
1.3.4 游离草酸脱羧酶和交联草酸脱羧酶聚集体的活性测定
草酸脱羧酶活力测定采用终止反应法[15]。反应液含76mmol/L草酸钾,50mmol/L pH 4.0 柠檬酸缓冲液,37℃水浴2min,加入草酸脱羧酶液开始反应,10min后加入等体积的0.2mol/L磷酸氢二钾使体系pH值上升至中性终止反应。反应液加入辅酶NAD以及甲酸脱氢酶,分光光度法检测分析,计算甲酸的量。酶活力单位定义为:每分钟催化转化草酸产生1μmol甲酸的酶量。
蛋白含量采用考马斯亮蓝法测定,以BSA作为标准品。
1.3.5 交联草酸脱羧酶聚集体的制备与条件优化
在不同戊二醛添加量、交联pH值、交联时间、BSA添加量条件下,比较制备交联草酸脱羧酶聚集体的酶活回收率,以初始草酸脱羧酶酶活力为100%。
1.3.6 游离草酸脱羧酶与交联草酸脱羧酶聚集体的性质
1.3.6.1 最适pH值
在pH2.5~7.0的不同柠檬酸缓冲液反应体系中分别测定酶活力,以酶活力最高数据为100%,计算相对酶活力,观察pH值对游离酶和交联酶聚集体活性的影响。
1.3.6.2 最适反应温度
反应柠檬酸缓冲液pH 4.0,在不同温度条件下分别测定酶活力,以酶活力最高数据为100%,计算不同温度条件下的相对酶活力,观察游离酶和交联酶聚集体反应的最适温度。
1.3.6.3 耐热性
游离酶与交联酶聚集体在不同温度条件下热处理30min后测残余酶活力,以初始酶活力为100%,观察处理后酶活力的变化。将游离酶和交联酶聚集体置于65℃水浴,每30min取样检测残余酶活力,以初始时间的酶活力为100%。
1.3.6.4 对胰蛋白酶的耐受性
分别取4.5mL游离酶和交联酶聚集体,加入2.5g/L的胰蛋白酶溶液0.5mL,37℃水浴,定时取样检测剩余酶活力,以原始活性数据为100%酶活力,观察游离酶和交联酶聚集体对抗胰蛋白酶消化的能力。
2 结果与分析
2.1 草酸脱羧酶的表达
基因工程菌E.coli BL21(DE3)/pET32a/YvrK经IPTG诱导及超声破碎细胞提取后得到草酸脱羧酶粗酶液,酶活力为7.078U/mL,蛋白含量为1.12mg/mL,酶比活力为6.315U/mg。
2.2 草酸脱羧酶的分离纯化
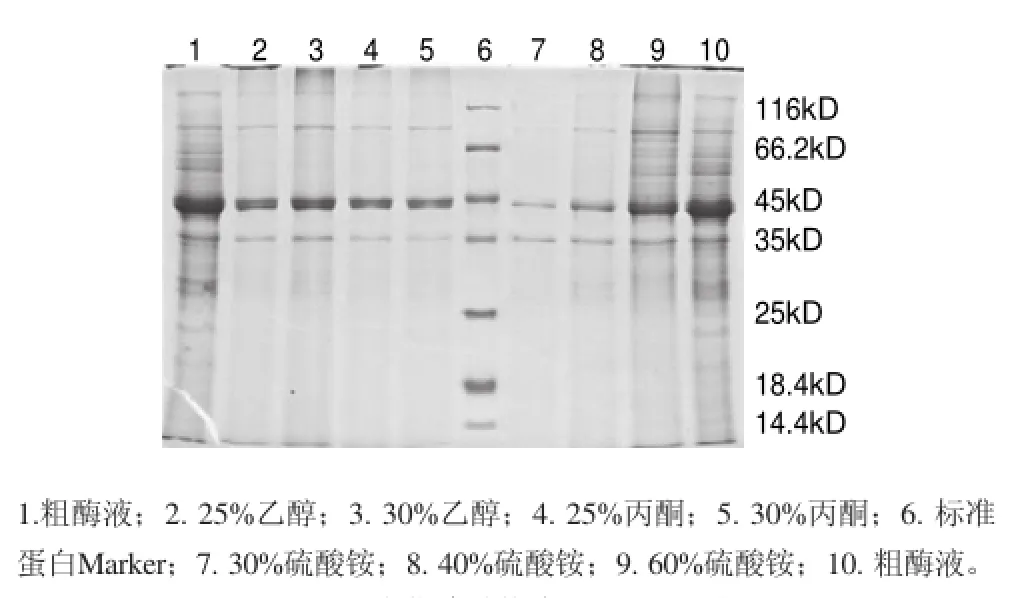
图 1 沉淀草酸脱羧酶SDS-PAGE结果Fig.1 SDS-PAGE of crude enzyme solution and different solvent precipitates
用不同质量分数的硫酸铵、丙酮和乙醇对草酸脱羧酶进行沉淀分离,重溶沉淀SDS-PAGE结果如图1所示。草酸脱羧酶易于被实验所用3种沉淀剂沉淀释出,但丙酮和乙醇对草酸脱羧酶沉淀的选择性优于硫酸铵。其中,使用30%乙醇分离纯化草酸脱羧酶效果良好,可去除粗酶液中66.2%的蛋白,酶活回收率达91.2%,纯化倍数为2.7倍,比30%丙酮纯化倍数提高了17.4%,因此后续实验选择30%乙醇做为沉淀剂。
2.3 交联草酸脱羧酶聚集体的制备与条件优化
2.3.1 酶聚集体的制备
取适量纯化酶液于2mL离心管缓慢滴加无水乙醇至乙醇体积分数30%,4℃冰箱沉淀过夜得到草酸脱羧酶聚集体悬浮液。
2.3.2 交联剂添加量的确定
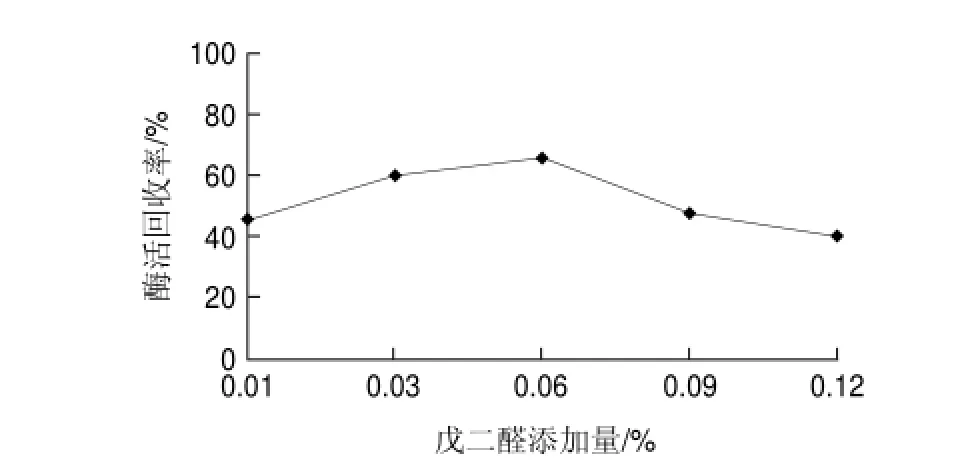
图 2 戊二醛添加量对交联反应的影响Fig.2 Effect of glutaraldehyde concentration on activity recovery
由图2可知,当戊二醛添加量低于0.06%,交联酶聚集体活力回收随戊二醛添加量的增加而增加,但当戊二醛添加量到达0.06%之后,酶活回收率随戊二醛添加量的增加而显著降低。推测是由于戊二醛添加量过高时,会造成一定的空间范围内酶分子的交联过于紧密,产生空间位阻而影响酶的活性[16],而且过高添加量戊二醛对酶分子的变性失活也是影响因素之一,因此0.06%的戊二醛是进行交联反应的适宜添加量。
2.3.3 交联反应pH值的确定
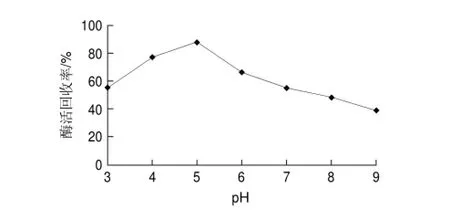
图 3 不同交联pH值对交联反应的影响Fig.3 Effect of cross-linking pH on activity recovery
由图3可知,在磷酸盐缓冲液pH5条件下获得交联酶聚集体的酶活回收率最高。这是由于草酸脱羧酶的等电点在5附近[17],在此pH值条件下草酸脱羧酶聚集体沉淀较完全,经交联反应后酶活回收率也较高,因此选择交联反应pH值为5。
2.3.4 交联时间的确定
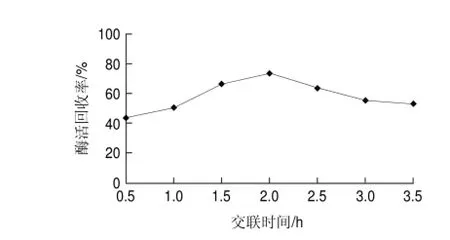
图 4 不同交联时间对交联反应的影响Fig.4 Effect of cross-linking time on activity recovery
由图4可知,在2h反应时间内,交联酶聚集体的酶活回收率随着交联时间的增加而增加,2h后,随着时间的延长,酶活回收率反而不断下降,该结果与董晓毅等[18]在制备交联脲酶聚集体研究相似,可见,交联反应过度反而会降低交联酶聚集体的酶活回收率,因此确定2h为适宜的交联反应时间。
陶行知先生说:“先生的责任不在教,而在教学,而在教学生学。”在“学为中心”的课堂中,教师要设法将如何“教”的预设,转化成学生的“学”的引导,以极大地激发学生的学习兴趣。
2.3.5 添加BSA对交联效果的影响
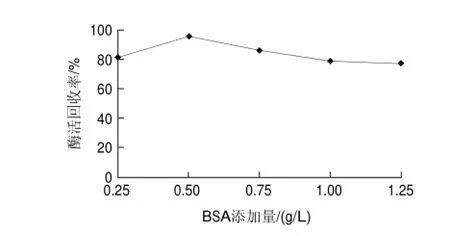
图 5 BSA添加量对交联反应的影响Fig.5 Effect of BSA concentration on activity recovery
Shah等[19]研究表明,对于酶蛋白浓度较低或戊二醛对酶活力影响比较大的酶,在制备交联酶聚集体的反应中加入适量的BSA,可以显著提高交联酶聚集体的酶活回收率。由图5可知,添加到终质量浓度为0.5g/L的效果最佳,过量添加BSA可能会影响酶活性中心与底物的接触,而降低交联草酸脱羧酶聚集体活性。
2.4 游离酶与交联酶聚集体的性质比较
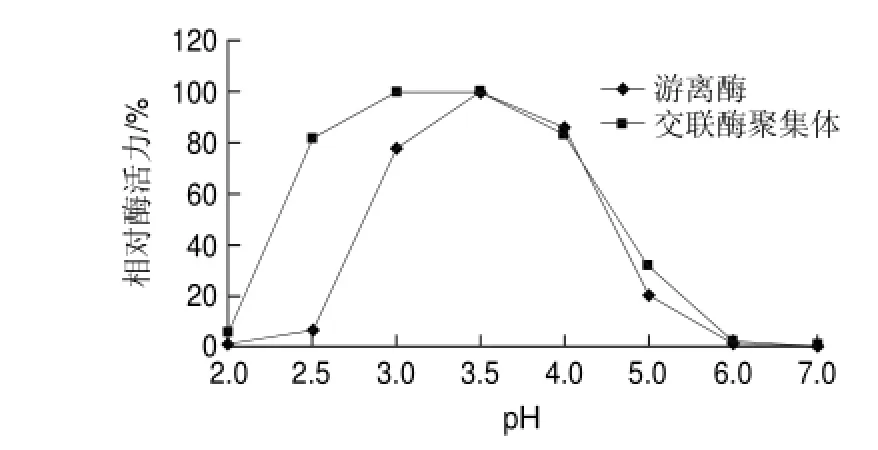
图 6 游离草酸脱羧酶与交联草酸脱羧酶聚集体的最适pH值Fig.6 Optimal reaction pH for oxdc-CLEAs and free oxdc
2.4.1 交联酶聚集体的最适反应pH值由图6可知,交联草酸脱羧酶聚集体的反应pH值范围比游离草酸脱羧酶宽泛,在pH2.5时交联草酸脱羧酶聚集体还有80%的相对酶活力,而游离草酸脱羧酶只剩10%不到,这与潘延芳等[20]在交联重组枯草杆菌纤溶酶聚集体的制备及其性质研究中的结果相似,说明交联聚集后的酶对酸性环境耐受能力更强。
2.4.2 交联酶聚集体的最适反应温度
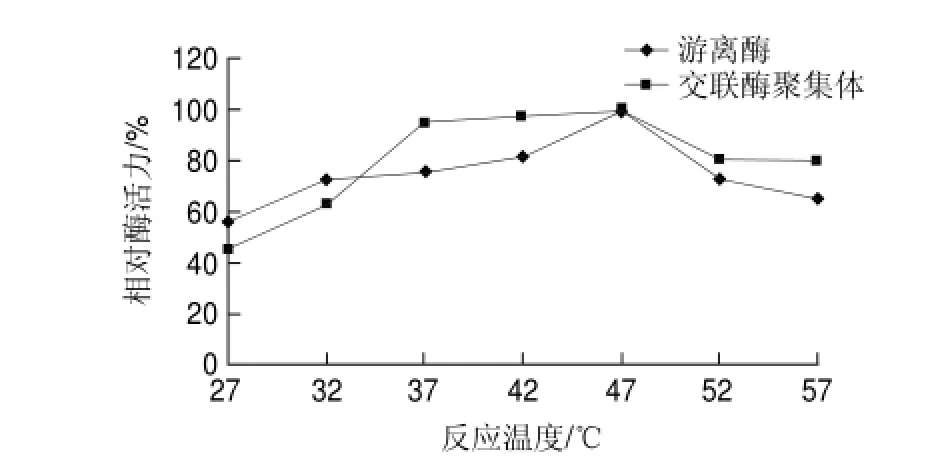
图 7 游离草酸脱羧酶与交联草酸脱羧酶聚集体的最适反应温度Fig.7 Optimal reaction temperature for oxdc-CLEAs and free oxdc
由图7可知,游离草酸脱羧酶和交联草酸脱羧酶聚集体的最适反应温度均在47℃左右。
2.4.3 交联酶聚集体的耐热性
分别在45、50、55、60、65、70、75℃条件下处理游离草酸脱羧酶与交联草酸脱羧酶聚集体30min,检测残余酶活力,结果如图8所示,交联草酸脱羧酶聚集体比游离草酸脱羧酶更耐热。在实验条件下,游离草酸脱羧酶的变性失活温度低于65℃,交联草酸脱羧酶聚集体的变性失活温度高于70℃;其中,在75℃处理30min,游离草酸脱羧酶的残余酶活力仅为13.4%,而交联草酸脱羧酶聚集体的残余酶活力高达77.1%。将游离草酸脱羧酶与交联酶聚集体分别置于65℃水浴,每隔30min测酶活力,结果如图9所示。3.5h内,交联草酸脱羧酶聚集体酶活力基本无损失,游离草酸脱羧酶在65℃温浴酶活逐渐发生变性失活,半衰期t1/2为2h。推测是由于酶交联后分子质量变大,刚性增强进而可以耐受较高的温度。此结论与交联脲酶优良的耐热性有相似之处[18]。
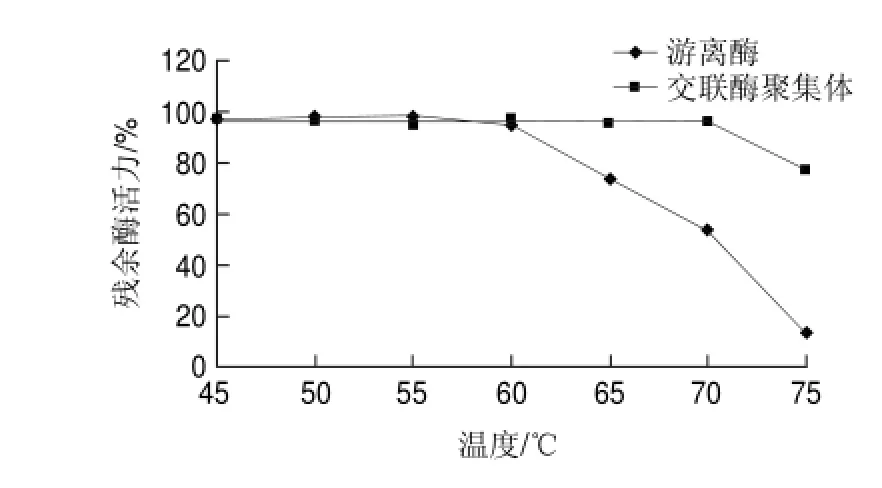
图 8 游离草酸脱羧酶与交联草酸脱羧酶聚集体的耐热性Fig.8 Heat tolerance of free oxdc and oxdc-CLEAs
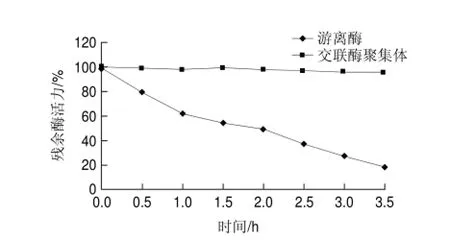
图 9 65℃游离草酸脱羧酶与交联草酸脱羧酶聚集体的热稳定性Fig.9 Thermal stability of free oxdc and oxdc-CLEAs at 65 ℃
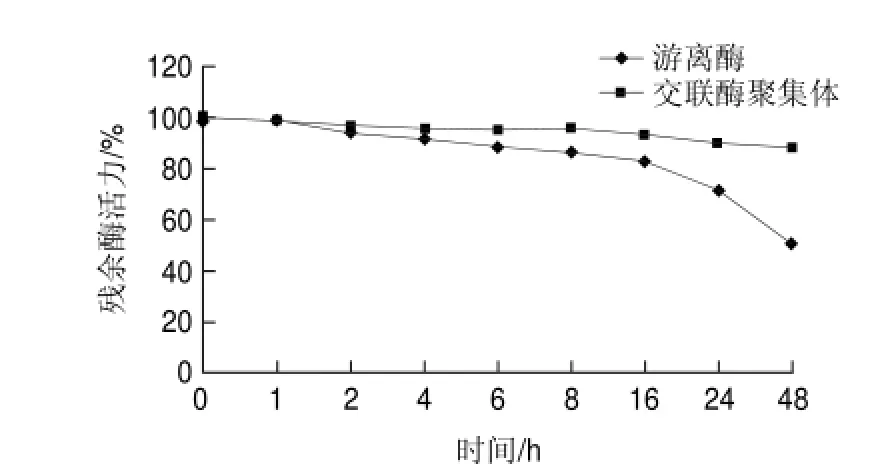
图 10 游离草酸脱羧酶与交联草酸脱羧酶聚集体对胰蛋白酶的耐受性Fig.10 Tripsin resistance of free oxdc and oxdc-CLEAs
由图10可知,交联草酸脱羧酶聚集体对胰蛋白酶消化的耐受能力显著高于游离草酸脱羧酶,其中,使用胰蛋白酶处理48h后,交联草酸脱羧酶残余酶活力大于80%,而游离草酸脱羧酶残余酶活力低于50%。这是由于交联草酸脱羧酶具有相对有序的蛋白质三维结构,大分子的蛋白水解酶被排斥在外而降低了它对酶的水解作用。交联草酸脱羧酶聚集体要做成酶制剂药物作用于人体内就必须能够通过胃酸屏障并对胃肠道内的蛋白水解酶如胰蛋白酶等有一定耐受性,使其药效不至于损失过快。实验结果表明,通过制备交联酶聚集体,可体提高草酸脱羧酶抵抗胰蛋白酶消化的能力,适用于开发药用酶制剂。
3 结 论
草酸盐在人体内的积累是形成泌尿系统结石的主要因素,现有的治疗草酸盐升高的方法如食用高剂量药物,调节饮食和透析等仅仅是部分或暂时有效的,而且它们还可能产生不利的副作用,因此需要一种安全的从人体去除草酸盐的方法。草酸脱羧酶是一种极具开发潜力的酶,它可以高效专一的分解草酸盐生成无害的甲酸。为了探索利用草酸脱羧酶制成酶制剂以缓解泌尿系统结石病患者的痛苦,国外已有学者对高纯度的草酸脱羧酶进行结晶处理并进行交联固定制成CLECs酶制剂,此种方法需要高纯度的酶和结晶处理,操作难度大,制作成本高。为了降低获得草酸脱羧酶酶制剂的成本,本实验研究了无载体固定化方法制备交联草酸脱羧酶聚集体的方法,用30%乙醇对草酸脱羧酶粗酶液进行沉淀分离,操作简单,费用低廉,纯化效果好;用0.06%戊二醛添加量在pH5的磷酸盐缓冲液中添加0.5g/L的BSA交联2h得到交联草酸脱羧酶聚集体,酶活回收率达95.4%。对其性质进一步研究表明交联草酸脱羧酶聚集体的耐酸性、耐热性、对胰蛋白酶的耐受性均比游离草酸脱羧酶稳定。本研究为草酸脱羧酶作为预防、治疗结石的酶制剂的开发应用提供一定的参考。
CLEAs技术是一种新的无载体技术,它不需要纯度较高的酶就能用于交联,操作简便,在一般实验室就能完成,而且成本低廉,不需要复杂的酶纯化结晶处理,是一种非常有前景的固定化技术,本研究考察了用草酸脱羧酶粗酶液经一步沉淀分离后进行无载体交联固定化的方法,为交联酶聚集体技术的进一步运用提供了理论依据。
参考文献:
[1] JUST V J, STEVENSON C E M, BOWATER L, et al. A Closed conformation of Bacillus subtilis oxalate decarboxylase oxdc provides evidence for the true identity of the active site[J]. The Journal of Biological Chemistry, 2004, 279(19): 19867-19874.
[2] 董婷婷, 袁杰利. 利用乳酸菌降解草酸预防结石的研究进展[J]. 中国微生态学杂志, 2011, 23(3): 266.
[3] COE F L, EVAN A, WORCESTER E. Kidney stone disease[J]. The Journal of Clinical Investigation, 2005, 115(10): 2598-2608.
[4] 代海涛, 陈志强, 叶章群. 草酸、草酸钙晶体-上皮细胞相互作用与肾结石[J]. 国际泌尿系统杂志, 2006, 26(2): 254.
[5] GRUJIC D, SALIDO E C, SHENOY B C, et al. Hyperoxaluria is reduced and nephrocalcinosis prevented with an oxalate-degrading enzyme in mice with hyperoxaluria[J]. Am J Nephrol, 2009, 29(2): 86-93.
[6] 赵树田, 张士青. 草酸代谢酶的研究进展[J]. 上海交通大学学报: 医学版, 2007, 27(10): 1274-1277.
[7] TALWAR H S, MURTHY M S R, NATH R, et al. Oxalate decarboxylase from guinea-pig liver[J]. Biochem Biophys, 1981, 18: 105-109.
[8] 曹茂新, 洪枫, 朱利民. 草酸脱羧酶及其应用[J]. 中国生物工程杂志, 2005(增刊1): 170-175.
[9] SJODE A, WINESTRAND S, NILVEBRANT N O, et al. Enzymebased control of oxalic acid in the pulp and paper industry[J]. Enzyme and Microbial Technology, 2008, 43(4): 78-83.
[10] 阿尔特斯制药公司. 结晶化的草酸脱羧酶和使用方法: 中国, 200780035792[P]. 2009-11-18.
[11] 张茜, 王家东. 交联糖化酶聚集体的制备[J]. 中国酿造, 2008(23): 67-69.
[12] AYTAR B S, BAKIR U. Preparation of cross-linked tyrosinase aggregates[J]. Proeess Biochemistry, 2008, 43: 125-131.
[13] 武仙山, 何立千, 叶磊. 交联酶聚集体: 一种无载体固定化方法[J].生物技术, 2005, 15(2): 90-92.
[14] 林日辉, 许丽莉, 农勉, 等. 重组草酸脱羧酶的表达及酶学性质研究[J]. 食品与发酵工业, 2011, 37(2): 57-61.
[15] SVEDRUZIĆ D, LIU Y, REINHARDT L A, et al. Investigating the roles of putative active site residues in the oxalate decarboxylase from Bacillus subtilis[J]. Arch Biochem Biophys, 2007, 464(1): 36-47.
[16] MONTORO-GARCÍA S, GIL-ORTIZ F, NAVARRO-FERNÁNDEZ J, et al. Improved cross-linked enzyme aggregates for the production of desacetyl β-lactam antibiotics intermediates[J]. Bioresource Technology, 2010, 101(1): 331-336.
[17] ANAND R, DORRESTEIN P C, KINSLAND C, et al. Structure of oxalate decarboxylase from Bacillus subtilis at 1.75 Å resolution[J]. Biochemistry, 2002, 41(24): 7659-7669.
[18] 董晓毅, 夏仕文. 交联脲酶聚集体的制备和初步应用[J]. 生物工程学报, 2003, 19(3): 332-336.
[19] SHAH S, SHARMA A, GUPTA M N. Preparation of cross-linked enzyme aggregates by using bovine serum albumin as a proteic feeder[J]. Analytical Biochemistry, 2006, 351: 207-213.
[20] 潘延芳, 孔珊珊, 陈怡倩, 等. 交联重组枯草杆菌纤溶酶聚集体的制备及其性质研究[J]. 中国生化药物杂志, 2007, 28(5): 318-321.
Preparation and Properties of Cross-Linked Oxalate Decarboxylase Aggregates
LIANG Yue1,LIN Ri-hui1,*,HUANG Wen-qin2,QIN Meng1,LI Xiang-xiang1,HE Mei-qing1,ZHENG Yuan-bo3
(1. Key Laboratory of New Techniques for Chemical and Biological Conversion Process, College of Chemistry and Chemical Engineering, Guangxi University for Nationalities, Nanning 530006, China;2. Nanning Yide Environment Technology Co. Ltd., Nanning 530003, China;3. College of Sciences, Northeastern University, Shenyang 110819, China)
Cross-linked oxalate decarboxylase aggregates (oxdc-CLEAs) for use as an enzyme preparation to relieve urinary oxalate stone disease were prepared by a carrier-free immobilization method. Crude enzyme solution was obtained from the induced expression of the genetically engineered strain E.coli BL21(DE3)/pET32a/YvrK, and oxalate decarboxylase was separated by adding 30% ethanol with a purification factor of 2.7 and an activity recovery of 91.2%. Cross-linked oxdc-CLEAs were further obtained after 2 h of cold treatment at 4 ℃ in the presence of 0.5 g/L bovine serum albumin (BSA) and 0.06% glutaraldehyde at pH 5, resulting in an activity recovery of 95.4%. Enzymatic characterization showed that cross-linked oxdc-CLEAs had improved tolerance to acid, heat and trypsin degradation when compared to free oxalate decarboxylase.
oxalate decarboxylase;cross-linked enzyme aggregates;preparation;properties
Q814.4
A
1002-6630(2013)01-0215-05
2011-11-11
广西化工过程创新技术研发平台建设项目(桂科能0992028-13);广西自然科学基金项目(2011GXNSFC018015)
梁跃(1985ü),男,硕士研究生,主要从事化学与生物转化研究。E-mail:lyyue1013@126.com.cn
*通信作者:林日辉(1972ü),男,副教授,博士,主要从事发酵工程、酶工程研究。E-mail:linrihui_0@yahoo.com.cn
