瓠瓜胰蛋白酶抑制剂水提工艺条件优化及不同部位胰蛋白酶抑制剂活性
2013-02-13邵悦,张琪,张程,马勇*
邵 悦,张 琪,张 程,马 勇*
(渤海大学化学化工与食品安全学院,辽宁 锦州 121013)
瓠瓜又名长瓠、扁蒲、瓠子、蒲瓜、葫芦等,属葫芦科一年生草本植物[1]。瓠瓜中含有胰蛋白酶抑制剂,它能与相应的蛋白水解酶形成一定的动态平衡,调节生物体内许多重要的生命活动[2]。据报道,大豆[3]、豆豉胰蛋白酶抑制剂能促进胰腺释放胰岛素,从而降低血糖浓度[4];大黄中胰蛋白酶抑制剂具有抗肿瘤、保肝利胆、改善肾功能、活血止血、降血脂等多方面的作用[5]。目前,对瓠瓜的研究主要集中在育种和种植[6-8]方面,对瓠瓜中脂肪、蛋白质、维生素、微量元素等常见成分的测定也有报道[9-12],对于瓠瓜中胰蛋白酶抑制剂的研究,国内外报道较少。本实验从瓠瓜肉、瓤、籽等不同部位中提取胰蛋白酶抑制剂,并进行活性和含量的测定[13],但由于瓠瓜皮、叶、茎的色泽较深,难于脱色,不便测定,本实验未作深入研究。
1 材料与方法
1.1 材料与试剂
鲜嫩瓠瓜采自锦州闾山。
牛胰蛋白酶(1:250) 上海维编科贸有限公司;苯甲酰DL-精氨酸对硝基苯胺(BAPNA,纯度≥98%) 上海三杰生物技术有限公司;大豆蛋白酶抑制剂 国药集团化学试剂有限公司;二甲基亚砜、三-羟甲基-氨基甲烷(Tris)、无水氯化钙、盐酸、三氯乙酸、氢氧化钠等均为国产分析纯。
缓冲溶液:称取Tris 3.025g、CaCl2·H2O 1.26g,溶于400mL去离子水中,用1mol/L盐酸调pH值,使溶液在37℃时的pH值为8.2,以去离子水溶解并稀释至500mL。BAPNA[7]溶液:称取BAPNA 20mg溶于0.5mL二甲基亚砜中,并将缓冲溶液预热至37℃作为溶剂将上述试剂稀释至50mL。胰蛋白酶溶液:称取胰蛋白酶10mg,转移至500mL容量瓶,用0.001mol/L盐酸[7]20mL溶解,以去离子水稀释定容并混匀,活性单位数≥2500U/mg,pH5.0~7.0。
1.2 仪器与设备
RE 52-86A旋转蒸发器 上海亚荣生化仪器厂;PB-10 Sartorius酸度计、TU-1901双光束紫外-可见分光光度计 北京普析通用仪器有限责任公司。
1.3 方法[13]
1.3.1 胰蛋白酶抑制剂抑制率测定
以BAPNA为底物,建立一个特定的酶反应体系。胰蛋白酶可催化水解BAPNA,引起410nm波长处吸光度增加;胰蛋白酶抑制剂加入上述体系后,抑制了胰蛋白酶的活性,使吸光度增加的幅度有所减少,以其减少程度表示抑制剂的抑制能力,从而计算出抑制活性,其中抑制活性定义为:每克蛋白质抑制纯胰蛋白酶的毫克数[14-15]。
分别取鲜嫩瓠瓜肉、瓤、籽20g,磨碎,加入蒸馏水150mL,分别调节pH值至3、5、7、9、11,水浴加温提取。抽滤,减压浓缩至20mL,1000r/min离心20min,上清液即为样品提取液。
在10mL反应体系中,加1mL样品提取液,加蒸馏水至2mL,加入2mL胰蛋白酶溶液,振荡混匀,加入5mL BAPNA溶液,恒温37℃,反应10min后,立即加入1mL 30%三氯乙酸混匀,以终止反应,于410nm波长处测定吸光度。同时,以对应的空白溶液作为参照。按照式(1)计算抑制率。

式中:η为样品提取液对胰蛋白酶的抑制率/%;A0为胰蛋白酶溶液的吸光度;Ai为样品溶液的吸光度;Ab为样品溶液对照空白的吸光度。
1.3.2 胰蛋白酶抑制剂活性测定[16-17]
在空白试管中加入2mL蒸馏水、5mL BAPNA溶液,37℃水浴恒温10min后,加入1mL乙酸溶液、2mL胰蛋白酶溶液,混匀,过滤。
在酶反应试管中,分别加入稀释后的样品溶液1.0、2.0mL,各加入蒸馏水至2mL,水浴恒温37℃。加入2mL胰蛋白酶溶液,振荡混匀;加入5mL BAPNA溶液,37℃水浴恒温10min后,加入1mL 30%三氯乙酸溶液,混匀,以终止反应,过滤。用光程1cm比色皿,于410nm波长处测定吸光度,以对应的空白溶液作为参照。按式(2)、(3)计算胰蛋白酶抑制剂活性(TIU)和样品稀释液中胰蛋白酶抑制剂活性(T)。

式中:A标准为未抑制的酶反应体系的吸光度;A样品为抑制的酶反应体系的吸光度。

式中:TIU1.0、TIU2.0为分别加入稀释后的样品溶液1.0、2.0mL的胰蛋白酶抑制剂活性。因瓠瓜籽、肉和瓤均为固体,在此以TIU/g为抑制活性单位。
1.3.3 胰蛋白酶抑制剂含量测定[18-19]
采用BAPNA法测定瓠瓜胰蛋白酶抑制剂含量,配制5、10、20、30、40μg/mL的胰蛋白酶抑制剂标准溶液,以试剂空白作为参照溶液,在410nm波长处测定吸光度,测定其对胰蛋白酶的抑制率。以胰蛋白酶抑制剂质量浓度为横坐标,抑制率为纵坐标作标准曲线,得线性回归方程:y=2.0393x-0.3082(R2=0.9994),从而计算出样品中胰蛋白酶抑制剂的含量。
1.3.4 瓠瓜胰蛋白酶抑制剂提取单因素试验[20]
1.3.4.1 温度的影响
取磨碎的鲜嫩瓠瓜肉20g,按料液比1:6(m/V)加入蒸馏水120mL,pH7,温度分别为50、60、70、80、90、100℃,提取1h,过滤、离心后取上清液,减压浓缩到一定体积后测定对胰蛋白酶的抑制率。
1.3.4.2 料液比的影响
取磨碎的鲜嫩瓠瓜肉20g,pH7,温度70℃,料液比分别按1:2、1:4、1:6、1:8、1:10加入蒸馏水,提取1h,过滤、离心后取上清液,减压浓缩到一定体积后测定对胰蛋白酶的抑制率。
1.3.4.3 pH值的影响
取磨碎的鲜嫩瓠瓜肉20g,在70℃条件下,料液比按1:6加入120mL蒸馏水,pH值分别为4、5、6、7、8、9的条件下提取1h,过滤、离心后取上清液,减压浓缩到一定体积后测定对胰蛋白酶的抑制率。
1.3.4.4 时间的影响
取磨碎鲜嫩瓠瓜肉20g,温度为70℃,料液比按1:6加入120mL蒸馏水,pH7,提取时间分别为0.5、1、2、3、4h,过滤、离心后取上清液,减压浓缩到一定体积后测定对胰蛋白酶的抑制率。
1.3.5 瓠瓜胰蛋白酶抑制剂提取正交试验
以胰蛋白酶活性大小为指标,从温度、pH值、料液比、提取时间等条件中,选择对胰蛋白酶抑制剂提取率有显著影响的3项因素,进行L9(33)正交试验,探索从瓠瓜中提取胰蛋白酶抑制剂最佳条件。
1.3.6 测定瓠瓜不同部位的胰蛋白酶抑制剂的含量及活性
1.3.6.1 瓠瓜不同部位胰蛋白酶抑制剂活性的测定
分别取鲜嫩瓠瓜瓤、肉、籽的样品溶液,按1.3.2节方法测定其活性。
1.3.6.2 瓠瓜不同部位胰蛋白酶抑制剂含量测定
分别取鲜嫩瓠瓜瓤、肉、籽的样品溶液,按1.3.3节方法测定其含量,通过标准曲线得到不同部位的胰蛋白酶抑制剂的含量。
2 结果与分析
2.1 单因素试验结果
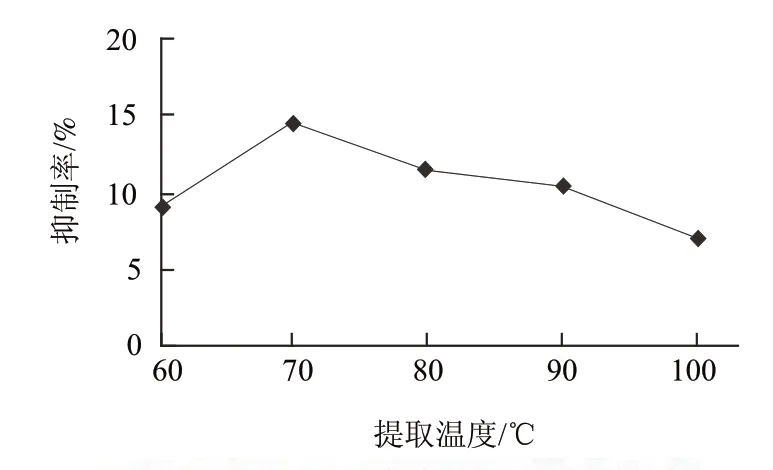
图1 提取温度对提取液抑制率的影响Fig.1 Influence of temperature on trypsin inhibitor activity of extracts
由图1可知,随着提取温度的上升,胰蛋白酶抑制剂的抑制率逐渐增大;当样品的提取温度达到70℃时,抑制率达到最高;继续升高温度,胰蛋白酶抑制剂的活性受到抑制,使得抑制率逐渐降低。故选取提取温度70℃。

图2 料液比对提取液抑制率的影响Fig.2 Influence of solid-to-solvent ratio on trypsin inhibitor activity of extracts
由图2可知,随着加入蒸馏水的量不断增多,抑制率也随之增加,当料液比达到1:6时,抑制率达到最大且相对稳定,继续加入蒸馏水时,抑制率无明显变化。故选择料液比1:6。

图3 pH值对提取液抑制率的影响Fig.3 Influence of extraction pH on trypsin inhibitor activity of extracts
由图3可知,随着pH值的增大,抑制率逐渐增大,到 pH7时达到最大,继续增大pH值时,抑制率降低。因此,选择提取的pH值为7。

图4 提取时间对提取液抑制率的影响Fig.4 Influence of extraction time on trypsin inhibitor activity of extracts
由图4可知,在提取1h后提取液的抑制率没有太大的变化。综合考虑后选用提取时间为1h,并不将其作为正交因素。
2.2 正交试验
在单因素试验的基础上,采用料液比、提取温度、pH值三因素进行L9(33)正交试验,以测定样品提取液胰蛋白酶抑制剂抑制率为指标,试验设计方案及结果见表1。

表1 L9(33)正交试验结果Table 1 Factors and levels for orthogonal array design
由表1极值R可以看出,各因素对结果的影响次序为B>C>A,即pH值对抑制率影响最大,料液比次之,温度影响最小。由K值可以看出最优组合是A2B3C1,即最佳提取条件为:pH8、料液比1:4、提取温度70℃、提取时间1h,此条件下获得的抑制率最高达36.45%。
2.3 瓠瓜不同部位的胰蛋白酶抑制剂含量及活性测定
2.3.1 抑制剂含量测定结果
由图5可知,瓠瓜籽中胰蛋白酶抑制剂的含量最高为38.66μg/mL,瓠瓜肉中的含量次之为37.06μg/mL,瓠瓜瓤中的含量最少为25.33μg/mL。瓠瓜籽中的胰蛋白酶抑制剂含量最高是由于瓠瓜籽中水分含量很少,蛋白质含量较高。

图5 不同部位胰蛋白酶抑制剂含量Fig.5 Trypsin inhibitor content of different parts of gourd
2.3.2 抑制剂活性测定结果

图6 不同部位胰蛋白酶抑制剂活性Fig.6 Trypsin inhibitor activity of different parts of gourd
由图6可知,其中瓠瓜籽的抑制活性最高为29.8TIU/g,瓠瓜肉次之为28.3TIU/g,瓠瓜瓤最小为19.1TIU/g。
3 结 论
本实验确定了瓠瓜胰蛋白酶抑制剂的最佳提取条件,即pH8、料液比1:4(m/V)、提取温度70℃、提取时间1h;测定了瓠瓜不同部位的胰蛋白酶抑制剂含量,瓠瓜籽为38.66μg/mL、瓠瓜肉为37.06μg/mL、瓠瓜瓤为25.33μg/mL;测定了瓠瓜不同部位胰蛋白酶抑制剂活性,瓠瓜籽为29.8TIU/g、瓠瓜肉为28.3TIU/g、瓠瓜瓤为19.1TIU/g。
[1]倪克梁.百菜治百病[M].武汉: 湖北人民出版社, 2008: 98.
[2]谭竹钧, 沈明才, 张峰, 等.胰蛋白酶抑制剂的研究进展[J].广东工业大学学报, 2007, 24(3): 6-10.
[3]KENNEDYA R.The evidence for soybean products as cancer preventive agents[J].The Journal of Nutrition, 1995, 125: 7335-7339.
[4]郭瑞华, 王和平, 刘正猛.永川豆胰蛋白酶抑制剂的分离纯化及其降糖活性研究[J].时珍国医国药, 2007, 18(2): 299-230.
[5]刘同祥, 牛建昭, 杜旭东, 等.具有蛋白酶抑制活性成分中药的筛选[J].中国中药杂志, 2007, 32(7): 643-646.
[6]吴田铲, 丁兰.瓠瓜新品种“越蒲1号”[J].园艺学报, 2010, 37(1):163-164.
[7]高辉, 张绪聪.大棚无公害瓠瓜延秋高效栽培技术[J].农技服务,2009, 26 (12): 26-37.
[8]刘璇, 时祥柱.苦瓜籽中一种胰蛋白肽的分离及抗真菌作用观察[J].中国生化药物杂志, 2008, 36(1): 151.
[9]王希东, 石庆华, 古丽扎尔, 等.无种皮南瓜籽胰蛋白酶抑制剂的分离纯化与部分性质研究[J].新疆农业大学学报, 2007, 30(3): 36-39.
[10]周嘉裕, 廖海, 唐琳, 等.山合欢种子胰蛋白酶抑制剂纯化及部分性质研究[J].安徽农业大学学报, 2009, 36(1): 54-58.
[11]田军, 苏昌茂, 周先碗.甘薯和花生胰蛋白酶抑制剂的初步研究[J].广西植物, 2009, 29(1): 70-73.
[12]万善霞, 王婉琬, 滑静, 等.胰蛋白酶抑制剂在不同领域的研究概况[J].北京农学院学报, 2003, 18(2): 152-155.
[13]GODBOLE S A, KRISHNA T G, BHATIA C R.Purification and characterization of protease inhibitors from piheon pea (Cajanus cajan(L.) Millsp) seeds[J].J Sci Food Agric, 1994, 64(1): 87-93.
[14]AACC method 22-40.Measurement of trypisin inhibitor activity of soy products: spectrophotometric method[S].St.Paul: The American Association of Cereal Chemists, 1935.
[15]郭乾初, 梁汉华.商品大豆饮料胰蛋白酶抑制剂活性的研究[J].中国乳品工业, 1997, 25(6): 8-10.
[16]燕方龙, 华蕾.大豆制品中胰蛋白酶抑制剂的抑制活性测定[J].理化检验: 化学分册, 2007, 43(3): 226-228.
[17]黄凯, 郑田要, 朱建华, 等.大豆胰蛋白酶抑制剂的研究进展[J].江西农业学报, 2008, 20(8): 95-98.
[18]汤晓智, 敖宗华, 孙志浩, 等.太湖蓝藻水华胰蛋白酶抑制剂的含量测定[J].无锡轻工大学学报, 2001, 20(4): 418-420.
[19]傅中平, 周吉燕.苦瓜中胰蛋白酶抑制剂活性的测定方法研究[J].食品与药品, 2007, 9(4): 14-17.
[20]杜旭东, 刘同祥, 张宗申, 等.超声波法提取大黄胰蛋白酶抑制剂[J].时珍国医国药, 2008, 19(3): 525-527.
