香鱼补体成分C9基因的克隆、序列分析及表达
2012-12-25孔铖将黄左安史雨红陆新江
孔铖将, 黄左安, 陈 炯, 史雨红, 陆新江
(宁波大学 应用海洋生物技术教育部重点实验室, 浙江 宁波 315211)
香鱼补体成分C9基因的克隆、序列分析及表达
孔铖将, 黄左安, 陈 炯*, 史雨红, 陆新江
(宁波大学 应用海洋生物技术教育部重点实验室,浙江 宁波315211)
补体成分C9是构成膜攻击复合体引起靶细胞溶解破坏的重要组成成分。该文测定了香鱼C9(aC9)基因的cDNA全序列, 序列全长2 125个核苷酸, 编码一个由592个氨基酸组成、相对分子质量为6.56×104的前体蛋白, N端22个氨基酸为信号肽序列。序列分析表明, aC9与虹鳟C9的氨基酸同源性最高, 达56.8%, 与其它鱼类C9的同源性介于40.9%~53.8%之间。aC9在健康香鱼肝、脾、肠、鳃和肌肉有表达, 其中在肝内的表达量最高。实时荧光定量PCR的结果显示, 鳗利斯顿氏菌侵染4 h后, 肝中aC9mRNA表达量显著上调, 并随着时间的推移在16 h时达到峰值。Western blotting分析的结果显示, 鳗利斯顿氏菌侵染后香鱼血清中的aC9蛋白随着时间的推移呈显著上调。以上结果表明, 香鱼肝组织C9基因表达变化与鳗利斯顿氏菌的侵染密切相关, 揭示了C9在鱼类抗细菌免疫反应中具有重要的作用。
补体成分C9; 香鱼; 鳗利斯顿氏菌; 实时荧光定量PCR; Western blotting
补体系统参与机体防御与炎症反应, 通过溶解病原体或募集吞噬细胞的方式, 清除大部分病原体。补体系统通过多种途径调控免疫功能, 如炎症细胞的趋化作用、增强巨噬细胞和嗜中性粒细胞的吞噬作用、肥大细胞脱粒、调节B、T细胞的免疫应答和增强抗原免疫原性等(Dunkelberger & Song, 2010; Toapanta & Ross, 2006)。补体系统除了作为先天免疫与获得性免疫的补充之外, 还调节组织再生(Rutkowski et al, 2010)、肿瘤生长(Qu et al, 2009)以及某些病理状况, 如非典型性溶血尿毒症和老年性黄斑退化症等(Wagner & Frank, 2010)。与哺乳动物类似, 鱼类的补体激活主要包括三条途径:经典途径(Classical pathway)、旁路途径(Alternative pathway)和凝集素途径(Lectin pathway)(Endo et al, 2011; Sarmar & Ward, 2011)。补体激活的后期成分C5b~C9形成膜攻击复合物(Membrane attack complex, MAC), 可通过破坏病原体细胞膜的完整性致使细胞溶解(Muller-Eberhard, 1986; Fosbrink et al, 2005)。哺乳动物的补体成分C9是一类单链糖蛋白, 糖链含量占总相对分子质量的7.8 % (Biesecker et al, 1982), 参与靶细胞表面MAC的形成, 是补体系统激活并攻击破坏靶细胞的重要补体固有成分。近年来, 多种鱼的C9研究已被报道, 如河豚(Fugu rubripes)(Yeo et al, 1997)、牙鲆(Paralichthys olivaceus)(Katagiri et al, 1999)、虹鳟(Oncorhynchus mykiss)(Stanley & Herz, 1987; Tomlinson et al, 1993; Chondrou et al, 2006)、草鱼(Ctenopharyngodon idella)(Li et al, 2007)和斑马鱼(Danio rerio)(Encinas et al, 2010)等。
香鱼(Plecoglossus altivelis)属胡瓜鱼目香鱼科,是东亚地区一种小型经济名贵鱼类, 在中国沿海各地均有分布。由于高密度养殖, 种质退化等原因导致病害发生频繁, 其中以鳗利斯顿氏菌(Listonella anguillarum)最为严重(Li et al, 2009)。由于香鱼对养殖环境要求较高, 且绿色养殖已经成为一种趋势,传统的抗生素等药物防治已经越来越不适应最新的养殖要求, 因此, 迫切需要深入研究香鱼免疫相关基因, 来指导香鱼病害防治(Uenobe et al, 2007; Chen et al, 2008)。本研究通过文库测序结合RACE的方法成功获得了香鱼C9(aC9)基因的cDNA全序列, 并分析了其序列特征及mRNA的组织表达特征,同时通过原核表达制备了小鼠抗aC9血清, 并以此研究了鳗利斯顿氏菌侵染后香鱼血清中aC9的表达变化, 为进一步深入研究C9在鱼类抗细菌免疫中的作用奠定了基础。
1 材料与方法
1.1 实验材料与试剂
实验材料:健康香鱼50尾, 个体重20~25 g, 购自宁波水产大世界; ICR小鼠购自宁波大学医学院实验动物中心; 鳗利斯顿氏菌香鱼分离株ayu-H080701、大肠杆菌TG1、BL21 pLys E和原核表达载体pET-28a由本实验室保存。
试剂:Gel Extraction Kit购自Omega公司; 辣根酶标记山羊抗小鼠IgG购自北京中山金桥生物技术有限公司; 肽N-糖苷酶F (PNGase F)购自New England Biolabs公司; RNAiso、Oligotex-dT30<super>mRNA Purification Kit、AMV逆转录酶、MMuLV逆转录酶、Ex TaqDNA聚合酶、100 bp DNA Ladder Marker、DNA Ligation Kit Ver.2.0、cDNA Library Construction Kit和SYBRPremix Ex Taq等试剂盒购自Takara公司; ECL化学发光试剂盒、显影定影试剂盒、柯达X-OMAT BT胶片和压片暗盒购自碧云天生物技术研究所; 引物合成及序列测定由上海英骏生物工程公司完成; 其他常规化学药剂均为国产分析纯。
1.2 样品制备
选取4尾健康香鱼, 采集肝、脾、肾、脑、心、鳃、肌肉、肠等组织, 液氮保存, 用于aC9基因mRNA的组织表达特征分析。剩余的香鱼分为实验组和对照组, 各23尾, 实验组每尾香鱼腹腔注射100 µL鳗利斯顿氏菌悬液(1.0×105CFU/mL PBS),对照组每尾香鱼注射100 µL无菌PBS。注射后24 h,随机挑选实验组香鱼3尾进行病原菌分离, 确认接种效果(Li et al, 2009)。实验组和对照组香鱼分别于腹腔注射后4、8、16、24 和36 h取样, 每次3尾/组, 其中尾静脉抽取的血液于4 ℃静置4 h, 析出血清离心后-70 ℃保存, 其余样品,如肝组织等于液氮保存。
1.3 香鱼aC9基因cDNA全序列获得及序列分析
采用文库测序的方法获得aC9基因cDNA的部分序列(Huang et al, 2011), 结合RACE方法扩增获得aC9基因cDNA 5'-和3'-末端序列, 序列拼接后得到aC9基因cDNA全序列。信号肽序列预测采用SignalP 3.0在线软件(http://www.cbs.dtu.dk/services/ SignalP/), 结构特征分析采用Scanprosite (http:// www.expasy.org/tools/scanprosite/)和Motifscan在线程序 (http://myhits.isb-sib.ch/cgi-bin/motif_scan),多重序列比对、进化分析和系统进化树构建采用MEGA 4.0 (Tamura et al, 2007)。
1.4 香鱼aC9基因mRNA的组织表达特征分析
组织表达特征分析相关的RNA提取、DNase I处理和第一链cDNA合成等方法详见文献(Huang et al, 2011)。根据aC9基因cDNA序列跨内含子设计一对扩增引物C9ex10F (5'-CCTGAATTCGAAGGA CTGGC-3')和C9ex11R (5'-CAGAGAGTTGGCCTG TCTTG-3'), 预期扩增片段长160 bp。内标采用看家基因β-actin, 扩增引物为pActin2(+)/pActin2(-), 预期扩增片段长234 bp (Huang et al, 2011)。PCR扩增以合成的各组织cDNA为模板, 25 µL的反应体系如下:cDNA 模板25 ng, 10×ExPCR 缓冲液2.5 µL, dNTP混合物(各2.5 mmol/L) 2 µL, 正向和反向引物(10 µmol/L)各1 µL,Ex TaqDNA聚合酶1.25 U,双蒸水补足25 µL。94 ℃变性2 min后, 按以下程序进行28个循环:94 ℃变性30 s, 58 ℃退火30 s, 72 ℃延伸30 s, 循环结束后72 ℃继续延伸反应7 min。PCR产物用2 %琼脂糖凝胶电泳分离, 溴化乙锭染色检测。
1.5 与鳗利斯顿氏菌侵染相关的香鱼肝组织aC9基因mRNA的表达变化
取腹腔注射后不同时间的香鱼肝组织, 检测aC9基因mRNA表达量的变化。每一取样时间点的实验组和对照组鱼各3尾, 分别抽提肝组织总RNA。RNA抽提、DNase I处理和第一链cDNA合成等方法同文献(Huang et al, 2011)。实时荧光定量PCR (RT-qPCR)采用25 μL反应体系, 含SYBRPremix Ex Taq(2×)缓冲液12.5 μL, 正向和反向引物(10 µmol/L)各1 μL, 模板0.5 μL, 灭菌水10 μL。扩增反应在Stratagene Mx3000P荧光定量PCR仪上进行, 94 ℃变性180 s后, 按以下程序进行40个循环:94 ℃ 30 s, 58 ℃ 30 s, 72 ℃ 30 s。为确保特异性扩增, PCR结束后对扩增产物进行熔解曲线分析,流程为94 ℃ 30 s, 72 ℃ 60 s, 95 ℃ 30 s。每一个样品技术重复3次。荧光定量结果由程序MxPro 3.2读取, 采用相对标准曲线法2-∆∆Ct(Livak & Schmittgen, 2001)分析相对定量结果。
1.6 香鱼aC9的原核表达和抗血清制备
设计原核表达引物pET-28a-C9(+)(5'-CCATATGAGGACCTTCTCTACTGT-3') 和pET-28a-C9(-)(5'-GGGATCCTTAACAGTAATCGTCGCTGC-3'), 以香鱼肝组织cDNA为模板, PCR扩增aC9基因全长开放阅读框架, 预期大小产物(1 790 bp)经1 % (w/v)琼脂糖凝胶电泳分离后, 切胶纯化。纯化产物经NdeI和BamH I双酶切, 插入pET-28a载体, 获得重组质粒pET-28a-aC9。转化有pET-28a-aC9的大肠杆菌BL21 pLys E经IPTG诱导后, SDS-PAGE检测。预期大小的诱导表达蛋白条带切胶纯化后免疫小鼠, 制备抗血清 (Huang et al, 2011)。
1.7 血清蛋白的去糖基化
根据糖苷酶试剂盒说明, 取目标蛋白9 µL(约20 µg), 加入10×糖蛋白变性缓冲液1 µL, 100 ℃变性10 min, 冷却到室温后, 加入1 µL的10×G7缓冲液, 1 µL的10% NP-40, 1 µL的PNGase F (500 U/µL), 37 ℃反应1 h。加入上样缓冲液处理样品后, Western blotting鉴定目标蛋白电泳迁移情况。
1.8 蛋白质印迹
蛋白样经SDS-PAGE电泳分离后, 转NC膜后用ECL化学发光法检测(Huang et al, 2011)。一抗为前所制备的小鼠抗aC9抗血清, 二抗为辣根过氧化物酶标记山羊抗小鼠IgG。
1.9 数据分析
实验结果表示为平均值±标准误, 采用SPSS软件(13.0)中的单因素方差分析(One-way ANOVA)进行统计,P<0.05为显著差异。
2 结 果
2.1 香鱼aC9基因cDNA序列分析
aC9基因cDNA序列全长2 125个核苷酸(GenBank登录号:FR714486), 编码一个由592个氨基酸组成、相对分子质量为6.56×104的前体蛋白。前体蛋白N端22个氨基酸为信号肽序列, 成熟肽aC9预测相对分子质量为6.34×104。结构域分析显示, 该蛋白具有已知的C9特征性的结构(Li et al, 2007; Katagiri et al, 1999; Tomlinson et al, 1993; Yeo et al, 1997), 包括TSP1 (thrombospondin type-1)结构域(Asp41~ Asn94)、LDLa (low-density lipoprotein receptor class A)结构域(Leu100~Asp135)、MACPF (MAC/perforin)结构域(Val138~Lys503) 和EGF-like (epidermal growth factor like)结构域(Cys522~Cys533)。多重序列比对发现, 鱼类和哺乳类C9在蛋白的C端有较大差异, 鱼类C9在此区域还具有另一个TSP1结构域(Lys549~Pro586), 但哺乳动物中没有(图1)。糖基化位点预测揭示, aC9序列存在1个潜在的N-糖基化位点(Asn254)。
氨基酸序列比较表明, aC9与虹鳟C9同一性最高, 达56.8%, 与其它鱼类C9的同一性介于40.9%~53.8%之间, 与哺乳动物C9的同一性低于32.8%。系统进化树分析揭示, 鱼类C9和哺乳动物C9分别成簇, 在鱼类C9中, 斑马鱼和草鱼C9紧密成簇, 区别于其他鱼类C9, aC9与虹鳟C9的进化关系最近(图2)。
2.2 香鱼aC9基因mRNA组织表达特征

图1 一些鱼类和哺乳动物C9的C末端区序列的比对Fig.1 Multiple alignment of the C-terminal amino acid sequences of fish and mammalian C9
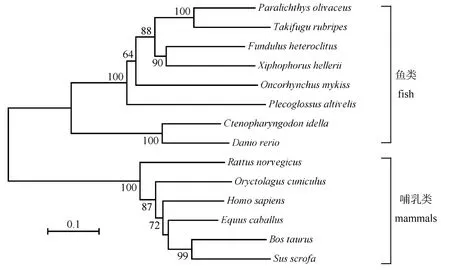
图2 基于NJ法构建的动物C9蛋白氨基酸序列系统进化树Fig.2 Phylogenetic tree of the amino acid sequences of animals C9 using neighbor-joining method
基因组DNA经DNase I处理后, PCR扩增aC9和β-actin, 没有发现明显的条带, 说明处理后的基因组DNA并不对RT-PCR结果产生干扰(图3)。各组织样品cDNA的PCR扩增结果表明, 健康香鱼aC9基因mRNA主要在肝组织中表达, 在脾和肠组织中也有一定量表达, 鳃和肌肉中有微量表达,而其他组织未扩增到可见条带(图3)。
2.3 鳗利斯顿氏菌侵染后肝组织aC9基因mRNA的表达变化
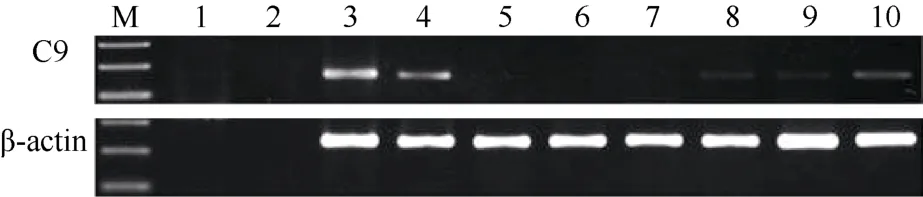
图3 香鱼aC9基因mRNA的组织表达特征Fig.3 The mRNA expression pattern of ayu aC9
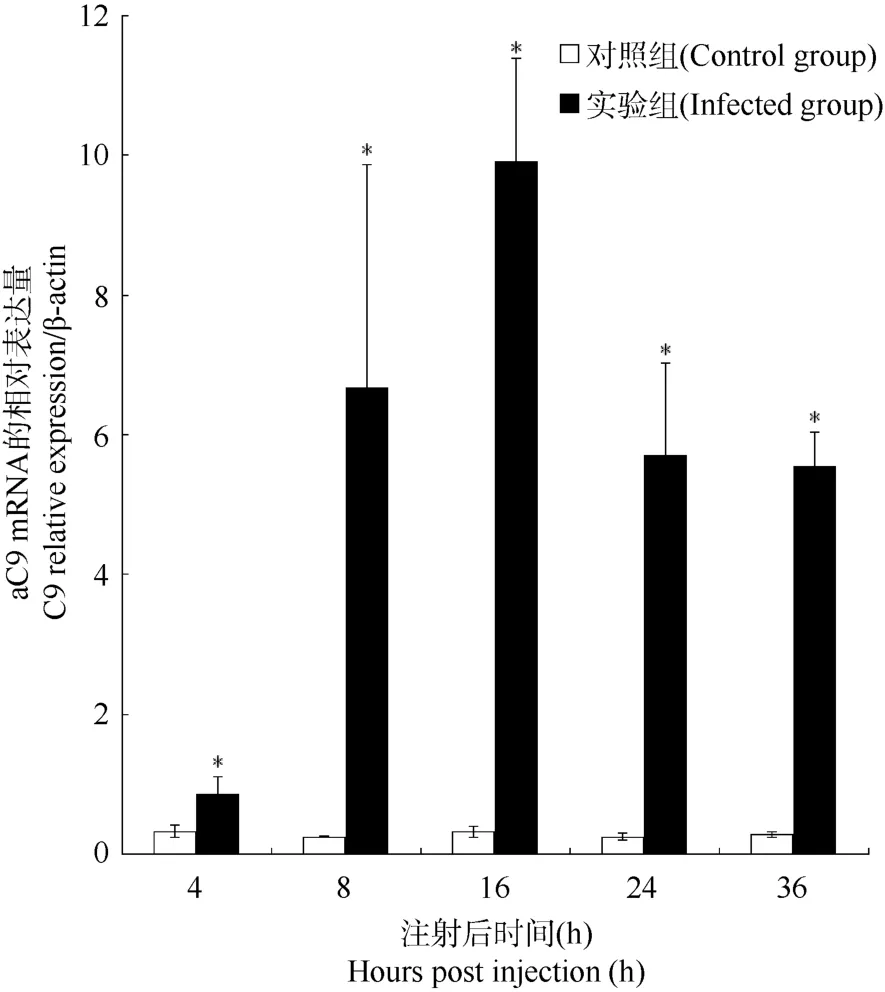
图4 鳗利斯顿氏菌侵染后香鱼肝组织aC9基因mRNA的表达变化Fig.4 Dynamic expression of ayu aC9 mRNA in ayu liver during Listonella anguillarum infection
在所检测的各组织中,aC9基因的mRNA主要在肝中表达, 我们随后用RT-qPCR方法进一步研究与细菌感染相关的肝组织aC9基因mRNA表达量的变化。结果表明, 细菌感染4 h,aC9基因mRNA表达量显著上调, 达到对照组的2.65倍, 16 h时表达量达到峰值, 为对照组的31.97倍, 此后表达量下降, 但直到36 h, 仍显著高于对照组(19.79倍)(图4)。
2.4 香鱼aC9的原核表达及血清中成熟肽的糖基化验证
重组菌体经IPTG诱导表达、超声波裂解后, 在SDS-PAGE分离胶中观察到一条相对分子质量约为6.8×104的诱导表达蛋白条带(图5a), 与计算的aC9融合蛋白相对分子质量吻合(6.78×104)。该蛋白条带切胶纯化后免疫小鼠, 制备抗血清。
据软件预测, aC9序列中存在一个潜在的N-糖基化位点Asn254。Western blotting结果表明, 血清中的aC9成熟肽相对分子质量约为6.76×104, 比计算值大4.2×103左右, 而经PNGase F处理后, 相对分子质量转变为6.35×104, 与计算值基本吻合。揭示aC9存在翻译后N-糖基化修饰(图5b)。糖链含量,占总分子量的6.07%。
2.5 鳗利斯顿氏菌侵染后香鱼血清aC9的含量变化
用前所制备的香鱼aC9多抗, Western blotting分析鳗利斯顿氏菌侵染0、4、8、16、24和36 h时的香鱼血清蛋白样品(图6)。结果表明, 细菌侵染后,香鱼血清中的aC9含量持续增加, 4 h时增加到正常表达量的3.0倍, 至36 h时, 达到正常表达量的5.8倍。
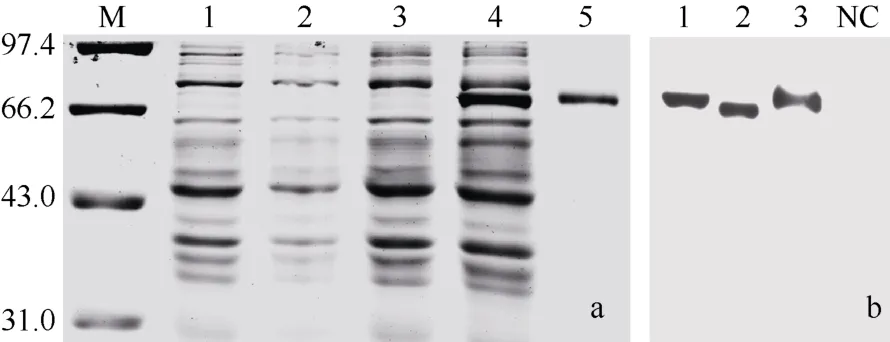
图5 香鱼aC9基因的原核表达和血清中成熟肽的糖基化验证Fig.5 Prokaryotic expression of ayu aC9 and the confirmation of its posttranslational N-glycosylation
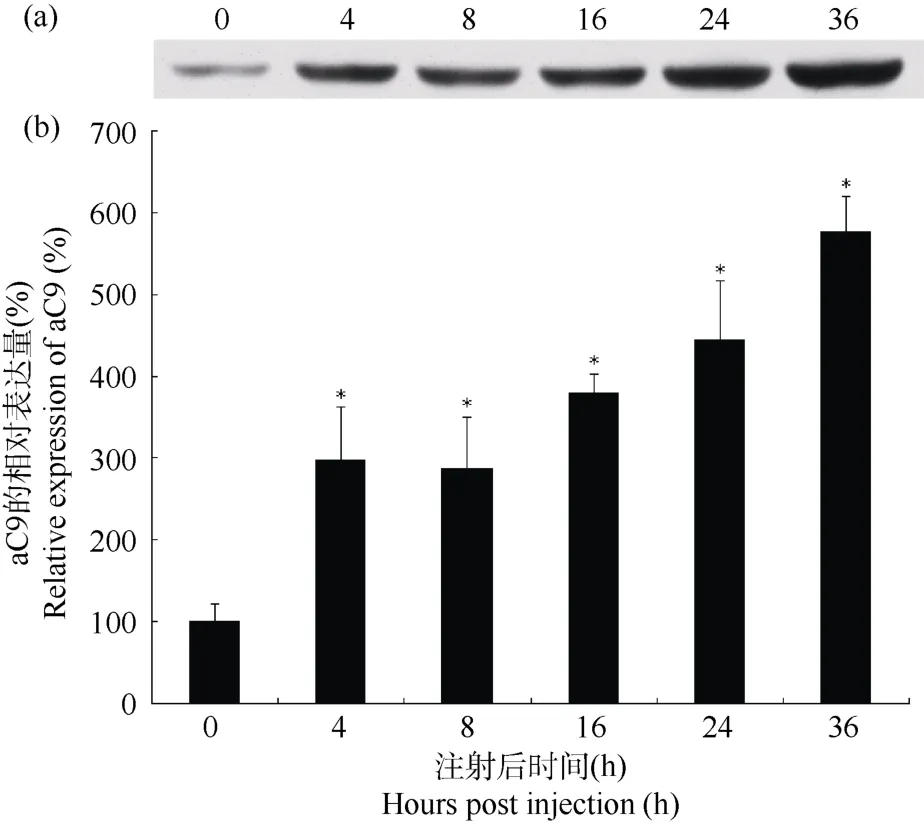
图6 Western blotting检测鳗利斯顿氏菌侵染后香鱼血清aC9含量变化Fig.6 Western blotting analysis of ayu serum aC9 content during Listonella anguillarum infection
3 讨 论
本文采用文库随机测序结合RACE的方法, 获得了香鱼补体成分aC9的全长cDNA序列。序列分析表明, 香鱼aC9具有已知的C9特征性结构, 并且鱼类C9的C端比哺乳动物C9多一个TSP1结构域(Tomlinson et al, 1993; Li et al, 2007), 但动物C9序列的差异是否引起功能上的差异, 尚有待进一步研究。香鱼aC9存在翻译后的N-糖基化修饰, 这与已报道的哺乳动物C9结果一致(Bunkenborg et al, 2004)。系统进化树分析表明, 鱼类C9和哺乳类C9分别成簇, 香鱼aC9与虹鳟C9最相似。
组织表达特征研究揭示, 健康香鱼aC9基因mRNA主要在肝中表达, 脾中有一定量表达, 肠、肌肉和鳃中也有少量表达, 其他组织中未检测到。已知鱼类C9基因mRNA的组织表达特征有一定差异, 如草鱼在血液、肌肉、表皮、肠、胸腺、鳃、脾、肾、肝、脑、心和头肾等12个组织中均有表达(Li et al, 2007), 而虹鳟则在脑、肠、肾、肝和脾组织中表达(Chondrou et al, 2006)。
香鱼由于其经济价值, 近年来在中国的养殖面积日益增加, 但病害问题严重, 其中鳗利斯顿氏菌是养殖香鱼弧菌病的主要病原之一。因此, 有必要对鳗利斯顿氏菌侵染后香鱼的免疫反应进行研究。补体是鱼类免疫防御系统的重要组成成分, C9参与形成靶细胞表面攻膜复合物(MAC), 导致靶细胞溶解。本文研究表明, 鳗利斯顿氏菌侵染后, 肝组织中aC9基因mRNA显著增加, 16 h时达到峰值, 到36 h仍显著高于对照组, 揭示肝组织大量合成aC9。近期研究表明, 草鱼注射接种柱状黄杆菌(F. columnare) 1 d后, 肝组织C9基因mRNA表达量显著上调(Li et al, 2007); 患病毒性出血性败血症的斑马鱼鳍中C9基因mRNA表达量上调15.33倍(Encinas et al, 2010), 与我们的结果吻合。香鱼aC9基因mRNA的表达模式与大部分肝内表达的急性期反应蛋白(acute phase protein, APP)相似(Witzel-Schlomp et al, 2001; Shi et al, 2010; Huang et al, 2011)。免疫印迹研究表明, 细菌侵染后短期内,香鱼血清aC9的含量即显著增加, 揭示它是一种APP。动物APPs的种类繁多, 结构和功能多种多样, 它们相互协调以去除炎症刺激物、弱化局部炎症和促进组织修复和再生, 从而使机体回复到内稳态(Gerwick et al, 2002)。
综上所述, 本文报道了香鱼补体成分aC9基因的cDNA全序列, 并对其在肝中的表达量变化与鳗利斯顿氏菌侵染过程进行了相关研究, 为鱼类抗细菌免疫的深入研究奠定了基础。
Biesecker G, Gerard C, Hugli TE. 1982. An amphiphilic structure of the ninth component of human complement. Evidence from analysis of fragments produced by alpha-thrombin[J]. J Biol Chem,257(5): 2584-2590.
Bunkenborg J, Pilch BJ, Podtelejnikov AV, Wiśniewski JR. 2004. Screening for N-glycosylated proteins by liquid chromatography mass spectrometry[J]. Proteomics,4(2): 454-465.
Chen J, Shi YH, Li MY, Ding WC, Niu H. 2008. Molecular cloning of liver angiotensinogen gene in ayu (Plecoglossus altivelis) and mRNA expression changes upon Aeromonas hydrophila infection[J]. Fish Shellfish Immunol,24(5): 659-662.
Chondrou MP, Londou AV, Zarkadis IK. 2006. Expression and phylogenetic analysis of the ninth complement component (C9) in rainbow trout[J]. Fish Shellfish Immunol,21(5): 572-576.
Dunkelberger JR, Song WC. 2010. Complement and its role in innate and adaptive immune responses[J]. Cell Res,20(1): 34-50.
Encinas P, Rodriguez-Milla MA, Novoa B, Estepa A, Figueras A, Coll J. 2010. Zebrafish fin immune responses during high mortality infections with viral haemorrhagic septicemia rhabdovirus. A proteomic and transcriptomic approach[J]. BMC Genomics,11: 518.
Endo Y, Matsushita M, Fujita T. 2011. The role of ficolins in the lectinpathway of innate immunity[J]. Int J Biochem Cell Biol,43(5): 705-712.
Fosbrink M, Niculescu F, Rus H. 2005. The role of c5b-9 terminal complement complex in activation of the cell cycle and transcription[J]. Immunol Res,31(1): 37-46.
Gerwick L, Steinhauer R, Lapatra S, Sandell T, Ortuno J, Hajiseyedjavadi N, Bayne CJ. 2002. The acute phase response of rainbow trout (Oncorhynchus mykiss) plasma proteins to viral, bacterial and fungal inflammatory agents[J]. Fish Shellfish Immunol,12(3): 229-242.
Huang ZA, Chen J, Lu XJ, Shi YH, Li MY. 2011. Alteration on the expression of ayu coagulation factor X gene upon Listonella anguillarum infection[J]. Zool Res,32(5): 492-498. [黄左安,陈炯,陆新江,史雨红,李明云. 2011.香鱼凝血因子X基因表达与鳗利斯顿氏菌感染的相关性[J].动物学研究,32(5): 492-498.]
Katagiri T, Hirono I, Aoki T. 1999. Molecular analysis of complement component C8beta and C9 cDNAs of Japanese flounder, Paralichthys olivaceus[J]. Immunogenetics,50(1-2): 43-48.
Li CH, Chen J, Shi YH, Li MY. 2009. Characterization of Listonella anguillarum as the aetiological agent of vibriosis occurred in cultured ayu (Plecoglossus altivelis) in Ninghai country, China[J]. Acta Micriobiol Sin, 2009,49(7): 931-937. [李长红,陈炯,史雨红,李明云. 2009.宁海地区香鱼弧菌病病原菌鉴定[J].微生物学报,49(7): 931-937.]
Li L, Chang MX, Nie P. 2007. Molecular cloning, promoter analysis and induced expression of the complement component C9 gene in the grass carp Ctenopharyngodon idella[J]. Vet Immunol Immunopathol,118(3-4): 270-282.
Livak KJ, Schmittgen TD. 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J]. Methods,25(4): 402-408.
Muller-Eberhard HJ. 1986. The membrane attack complex of complement[J]. Annu Rev Immunol, 4(1): 503-528.
Qu HC, Ricklin D, Lambris JD. 2009. Recent developments in low molecular weight complement inhibitors[J]. Mol Immunol,47(2-3): 185-195.
Rutkowski MJ, Sughrue ME, Kane AJ, Ahn BJ, Fang SN, Parsa AT. 2010. The complement cascade as a mediator of tissue growth and regeneration[J]. Inflamm Res,59(11): 897-905.
Sarmar JV, Ward PA. 2011. The complement system[J]. Cell Tissue Res,343(1): 227-235.
Shi YH, Chen J, Li CH, Li MY. 2010. Molecular cloning of liver Wap65 cDNA in ayu (Plecoglossus altivelis) and mRNA expression changes following Listonella anguillarum infection[J]. Mol Biol Rep,37(3): 1523-1529.
Stanley KK, Herz J. 1987. Topological mapping of complementcomponent C9 by recombinant DNA techniques suggests a novel mechanism for its insertion into target membranes[J]. EMBO J,6(7): 1951-1957.
Tamura K, Dudley J, Nei M, Kumar S. 2007. MEGA4: Molecular evolutionary genetics analysis (MEGA) software version 4.0[J]. Mol Biol Evol,24(8): 1596-1599.
Toapanta FR, Ross TM. 2006. Complement-mediated activation of the adaptive immune responses: role of C3d in linking the innate and adaptive immunity[J]. Immunol Res,36(1-3): 197-210.
Tomlinson S, Stanley KK, Esser AF. 1993. Domain structure, functional activity, and polymerization of trout complement protein C9[J]. Dev Comp Immunol,17(1): 67-76.
Uenobe M, Kohchi C, Yoshioka N, Yuasa A, Inagawa H, Morii K, Nishizawa T, Takahashi Y, Soma GI. 2007. Cloning and characterization of a TNF-like protein of Plecoglossus altivelis (ayu fish)[J]. Mol Immunol,44(6): 1115-1122.
Wagner E, Frank MM. 2010. Therapeutic potential of complement modulation[J]. Nat Rev Drug Discov,9(1): 43-56.
Witzel-Schlomp K, Rittner C, Schneider PM. 2001. The human complement C9 gene: structural analysis of the 5' gene region and genetic polymorphism studies[J]. Eur J Immunogenet,28(5): 515-522.
Yeo GSH, Elgar G, Sandford R, Breneer S. 1997. Cloning and sequencing of complement component C9 and its linkage to DOC-2 in the pufferfish Fugu rubripes[J]. Gene,200(1-2): 203-211.
Molecular cloning, sequence analysis and expression of ayu complement componentC9gene
KONG Cheng-Jiang, HUANG Zuo-An, CHEN Jiong*, SHI Yu-Hong, LU Xin-Jiang
(Key laboratory of Applied marine Biotechnology, Ministry of Education, Ningbo University, Ningbo 315211, China)
C9, a component of the membrane attack complex, participates in the final stage of the complement cascade which lyses foreign organisms by disrupting the integrity of their cell membranes. In the present study, a full-length ayu C9 (aC9) cDNA was cloned which contains 2,125 nucleotides and encodes a protein of 592 amino acids. A signal peptide was deposited in the N-terminal 22 residues. The deduced amino acid sequence of aC9 showed 56.8% identity to the C9 of rainbow trout, and 40.9% to 53.8% identity to the C9 of other teleosts. RT-PCR analysis demonstrated that the mRNA ofaC9was expressed in the liver, spleen, intestine, gill and muscle of healthy ayu fish with the highest level in the liver. Quantitative RT-PCR analysis showed thataC9transcripts were significantly up-regulated in the liver at 4 h postListonella anguillaruminfection, peaked at 16 h post injection. Western blotting analysis revealed that serum aC9 significantly increased inListonella anguillaruminfected ayu fish. Our results suggested that aC9 may play an important role in fish immune response of anti-bacteria.
Complement component C9; Ayu;Listonella anguillarum; RT-qPCR; Western blotting
Q785; Q959.499; Q516
A
0254-5853-(2012)02-0151-07
10.3724/SP.J.1141.2012.02151
2011-11-21;接受日期:2011-12-26
教育部新世纪优秀人才支持计划项目(NCET-08-0928);宁波市自然科学基金项目(2010A610001)
∗通信作者(Corresponding author),Tel: 0574-87609571, E-mail: jchen1975@163.com
孔铖将(1986—),男,浙江绍兴人,硕士研究生,研究方向:分子生物学; Tel: 13586883124; E-mail: kongchengjiang@163.com
猜你喜欢
杂志排行
Zoological Research的其它文章
- Bacterial expression and purification of biologically active human TFF2
- 酸性环境下铝对斑马鱼运动行为和学习记忆能力的影响暨与阿尔海默茨症的相互关系
- Smallest bitter taste receptor (T2Rs) gene repertoire in carnivores
- A new spider species of the genus Sudharmia from Sumatra, Indonesia (Araneae, Liocranidae)
- Complete mitogenome of the Lesser Purple Emperor Apatura ilia (Lepidoptera: Nymphalidae: Apaturinae) and comparison with other nymphalid butterflies
- Acute lesions of primary visual cortical areas in adult cats inactivate responses of neurons in higher visual cortices
