发酵液中多拉菌素的提取和萃取条件研究
2012-11-23邹泽先张晓琳
邹泽先,陈 新,张晓琳
1武汉工业学院,武汉430023;2国家粮食局科学研究院,北京100037
发酵液中多拉菌素的提取和萃取条件研究
邹泽先1,2,陈 新1,张晓琳2*
1武汉工业学院,武汉430023;2国家粮食局科学研究院,北京100037
采用单因素实验,分别研究提取试剂、发酵液放置时间、pH值和温度对发酵液中多拉菌素提取效果的影响;然后以乙酸乙酯为萃取试剂,研究萃取次数及萃取体积对多拉菌素萃取效果的影响。结果显示,甲醇为最佳提取试剂;发酵液在pH为3~11、温度为20~80℃的条件下放置144 h,多拉菌素均能稳定存在,提取得到的多拉菌素的质量浓度没有显著变化;浓缩提取液液经2倍体积乙酸乙酯萃取2次即可。该条件下多拉菌素的质量浓度和萃取率分别为151.78 μg/mL和98.00%。
多拉菌素;发酵液;萃取条件
多拉菌素(doramectin)为20世纪90年代研制开发的新一代大环内酯类抗寄生虫药,是以环已烷羧酸(cyclohexanecarboxylic acid)为前体,通过基因重组的阿维链霉菌(Streptomyces avermitilis)新菌株发酵而成的一种阿维菌素类抗生素[1,2]。经近20年的研究,它被认为是目前阿维菌素族中最优秀的抗寄生虫药物之一,为内外兼杀剂,对线虫、节肢动物均有良好的驱杀效果[3],其在动物体内的代谢具有血药浓度高、半衰期长、消除缓慢的特点[2],是目前具有开发潜力的兽用抗寄生虫药物之一[4]。
多拉菌素的优良性能使得其在养殖业及宠物业上应用较为广泛,但我国国内对于多拉菌素的研发则还只是处于初级阶段[5],目前多拉菌素的国内外文献报道多集中在其药代动力学研究和残留检测等方面[6],包括以SPE固相萃取柱建立高通量的检测方法[7],以及以LC-MS快速分离并定量检测微量残留药物的方法[8],但有关多拉菌素提取及分离、纯化方面则未见系统研究报道。本文旨在对多拉菌素发酵液的分离纯化方面进行探索研究,为后续研究提供理论依据。
1 材料、仪器与方法
1.1 材料与常用仪器
1.1.1 菌种
菌种Streptomyces avermitilis XJ-8-115,由国家粮食局科学研究院筛选保藏。
1.1.2 材料
多拉菌素发酵液(国家粮食局科学研究院提供);多拉菌素标准品购自Sigma,纯度97.8%;甲醇、乙醇、丙酮、乙腈、异丙醇盐酸及氢氧化钠均为分析纯,由北京化工厂生产;甲醇、乙腈为色谱纯,Merck公司生产。
1.1.3 培养基
种子培养基:可溶性淀粉30 g/L,酵母提取物2 g/L,大豆蛋白2 g/L,CoCl2·6H2O 5 mg/L,pH 7.0~7.2,250 mL三角瓶装样量为50 mL。
发酵培养基:可溶性淀粉70 g/L,酵母膏16 g/ L,MgSO4·7H2O 0.5 g/L,K2HPO4·3H2O 0.5 g/L,KCl4g/L,CoCl2·6H2O 5 mg/L,pH 7.0~7.2,250 mL三角瓶装样量为50 mL。
培养基的灭菌条件是121℃灭菌30 min。
1.1.4 仪器
高效液相色谱仪(2487检测器,515泵,717进样器,美国waters公司);UV-2102 PC型紫外可见分光光度计(美国Unico公司);Eppendorf 5810R型离心机(德国Eppendorf公司);Delta型pH计(瑞士Mettler Toledo公司);SPY50双层培养摇床(上海市离心机械研究所);SHB-III型水循环多用真空泵。
1.2 多拉菌素发酵提取液的浓缩提取液的制备
取1L多拉菌素发酵液,加入3倍的甲醇(V/ V),震荡摇匀,室温下提取12 h,减压抽滤得到上清液,减压浓缩至原体积的1/3~1/4,即得到多拉菌素发酵液的浓缩提取液。
1.3 多拉菌素的标准曲线的绘制
准确称取多拉菌素标准品0.0250 g,置于50 mL容量瓶中,用甲醇溶解并定容至刻度线,配制成质量浓度为500 μg/mL的多拉菌素标准母液,然后再依次稀释成质量浓度分别为300、200、100、50、20、10、5 μg/mL的多拉菌素标准溶液,将多拉菌素标准溶液在以下色谱条件下进样检测。色谱柱:Agilent Nucleosil 100—5 C18,3.5 μm,250 mm×4.0 mm;流动相:甲醇—乙腈水溶液(V甲醇∶V乙腈∶V水)= 45∶45∶10;流速:1.0 mL/min;进样量10 μL;检测波长:245 nm;柱温:25℃。以多拉菌素标准溶液的质量浓度为横坐标,峰面积为纵坐标,绘制标准曲线。
1.4 不同因素对多拉菌素发酵液提取效果的影响
1.4.1 不同的提取试剂
取5组50 mL的多拉菌素发酵液,加入3倍体积的不同有机溶剂:甲醇、乙醇、乙腈、丙酮及异丙醇,震荡摇匀并于室温提取12 h后,减压抽滤得到上清液,再取上清液经0.22 μm的微孔滤膜过滤,HPLC分别测定各组溶液中多拉菌素的质量浓度,考察不同的提取试剂对多拉菌素提取效果的影响。各组设置3个重复。
1.4.2 发酵液pH
取7份50 mL的多拉菌素发酵液,分别用6 mol/L的NaOH或HCl调节pH至3、5、原始对照(pH为6.36)、7、9、11、13,避光4℃放置8 h,再调各组溶液的pH至中性,加入3倍体积的甲醇,震荡摇匀并于室温提取12 h后,减压抽滤得到上清液,再取上清液经0.22 μm的微孔滤膜过滤,HPLC分别测定各组溶液中多拉菌素的质量浓度。各组均设3个重复,考察pH对多拉菌发酵液提取效果的影响。
1.4.3 发酵液的放置时间
取15组50 mL的多拉菌素发酵液,分别避光4℃放置2、4、8、12、24、36、48、60、72、84、96、108、120、132、144 h,加入3倍体积的甲醇,震荡摇匀并于室温提取12 h后,减压抽滤得到上清液,再取上清液经0.22 μm的微孔滤膜过滤,HPLC分别测定各组溶液中多拉菌素的质量浓度。各组均设3个重复,考察不同放置时间对多拉菌发酵液提取效果的影响。
1.4.4 不同温度
以具塞三角瓶分别取7组50 mL多拉菌素发酵液,分别置于不同温度的水浴锅:20、30、40、50、60、70、80℃,放置水浴锅中8 h后,加入3倍体积的甲醇,震荡摇匀并于室温提取12 h后,减压抽滤得到上清液,再取上清液经0.22 μm的微孔滤膜过滤,HPLC分别测定各组溶液中多拉菌素的质量浓度。各组设定3个重复,考察温度对多拉菌素发酵液提取效果的影响。
1.5 不同因素对多拉菌素浓缩提取液的萃取效果的影响
1.5.1 萃取次数
取50 mL的多拉菌素发酵液的浓缩提取液,加入等体积的乙酸乙酯,分别萃取1、2、3次,合并每次的有机相,有机相经减压浓缩干燥后加入50 mL的甲醇至完全溶解,取样经0.22 μm的微孔滤膜过滤,HPLC分别测定其中多拉菌素的质量浓度,每组重复3次。考察不同萃取次数对多拉菌素的萃取效果的影响。
1.5.2 萃取试剂的体积
取6组50 mL的多拉菌素发酵液的浓缩提取液,加入不同体积的乙酸乙酯萃取,使V浓缩提取液∶
V乙酸乙酯分别为1∶0.5、1∶1、1∶2、1∶3、1∶4、1∶5,取有机相减压浓缩干燥后加入50 mL的甲醇至完全溶解,取样经0.22 μm的微孔滤膜过滤,HPLC分别测定其中多拉菌素的质量浓度。每组设定3个重复,考察不同萃取体积对多拉菌素的萃取效果的影响。
1.6 发酵液中多拉菌素质量浓度的测定
“1.4”及“1.5”项下各实验中多拉菌素的质量浓度的测定,均以“1.3”中多拉菌素的标准曲线求得,即以HPLC测定得到多拉菌素的峰面积,再由标准曲线得出其质量浓度。
1.7 多拉菌素的萃取率的计算
萃取率=(萃取溶剂中多拉菌素的总量/提取液中多拉菌素的总量)×100%
1.8 数据处理
数据均采用Originlab 8.0软件进行分析和统计,每一个系数的显著性通过Student t检验和P值来衡量。
2 结果与分析
2.1 多拉菌素标准曲线的绘制
以多拉菌素标准液的质量浓度与峰面积为横纵坐标绘制标准曲线,得到其回归方程:Y×10-4= 1.7623X-0.4938,线性相关系数为0.9998。该标准曲线显示多拉菌素在线性范围5~500 μg/mL范围内具有良好的线性关系。根据此标准曲线能准确地得到多拉菌素的实际质量浓度。
2.2 不同因素对发酵液中多拉菌素提取效果的影响
2.2.1 不同的提取试剂
实验表明不同的提取试剂效果差异显著,以乙腈及甲醇的提取效果较好,它们提取得到多拉菌素的质量浓度分别为147.37 μg/mL和142.90 μg/ mL,但两者差异不显著(P>0.05);同时,甲醇的成本及毒性均较乙腈低。故提取试剂选择甲醇。
2.2.2 发酵液pH
图1所示即为发酵液pH对多拉菌素提取效果的影响。由图可以看出,在pH为3~11范围内,多拉菌素比较稳定;但当发酵液pH为13时,多拉菌素已经无法被检测出。这可能是由于在强碱性条件下,多拉菌素的结构发生改变,使得多拉菌素发生降解或变为其它未知物质,而不能被检测出。多拉菌素在pH为3~11范围内均较稳定,提取效果良好,故提取发酵液时不需要调节pH值。
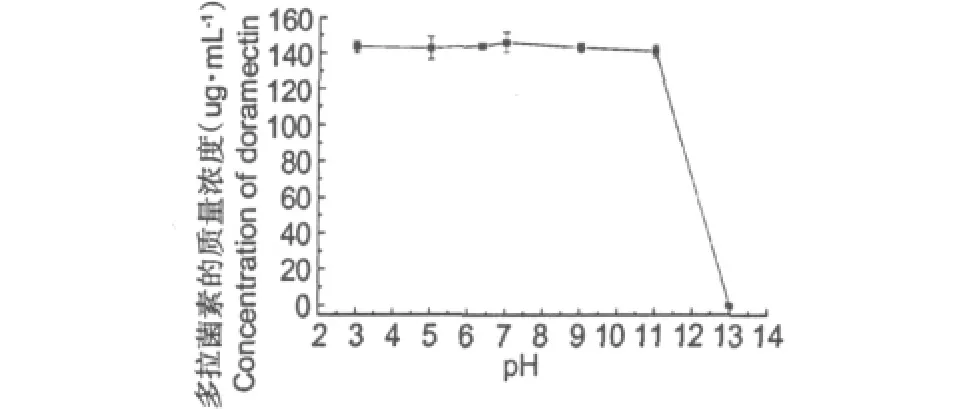
图1 发酵液pH对多拉菌素提取效果的影响Fig.1 Effects of pH on the extraction results of doramectin
2.2.3 发酵液的放置时间
发酵液放置时间对多拉菌素提取效果的影响见图2。从图2可以看出,在2~144 h内,发酵提取液中测得的多拉菌素的含量是趋于稳定的。所以,多拉菌素发酵液在避光条件下,放置一周是可行的。

图2 发酵液放置时间对多拉菌素提取效果的影响Fig.2 Effects of storage time on the extraction results of doramectin
2.2.4 不同温度
图3所示即为温度对多拉菌素提取效果的影响。如图所示,在20~80℃条件下,均能提取得到多拉菌素,且提取液中多拉菌素的质量无显著性差异(P>0.05);且温度的升高,有利于蛋白等杂质沉淀。故在20~80℃均能提取出多拉菌素,其在20~80℃条件下稳定,选定多拉菌素的提取温度为40℃。
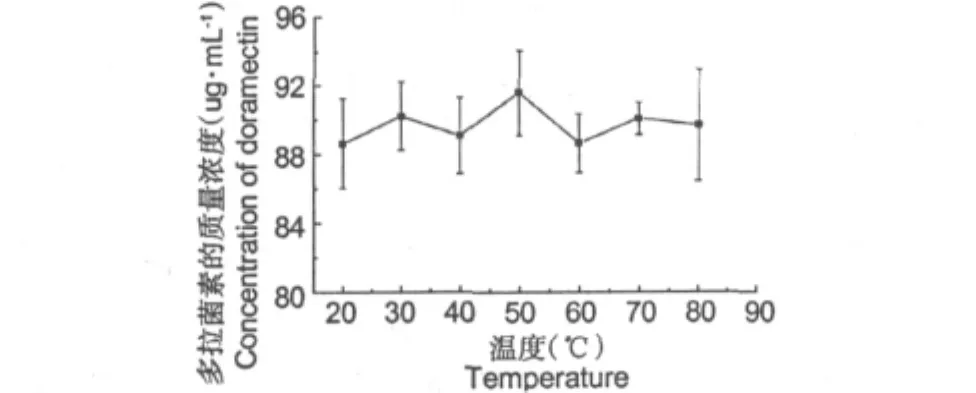
图3 温度对多拉菌素提取效果的影响Fig.3 Effects of temperature on textraction results of doramectin
2.3 不同因素对多拉菌素萃取效果的影响
2.3.1 萃取次数
随着萃取次数的增加,萃取率也增大。萃取1次仅能达到89.41%,萃取2次可达98%,萃取2次和萃取3次的效果则没有明显的差异(P>0.05)。故从成本及试剂回收的角度,选择乙酸乙酯对多拉菌素的浓缩提取液萃取2次即可。
2.3.2 萃取试剂的体积
随着设定比例中乙酸乙酯与浓缩提取液体积比的增大,萃取率也随之增大。在实验过程中,当萃取剂体积小于发酵液体积时,有明显的乳化现象,待静置较长时间分层后,测得萃取率为65.57%;当比例增大至2∶1时,萃取率增大至96.71%,与更大萃取体积得到的萃取率差异不显著(P>0.05),所以综合考虑选择V乙酸乙酯∶V多拉菌素浓缩提取液为2∶1。
3 讨论
本实验考察了多因素对多拉菌素提取及萃取效果的影响。结果显示,在对提取试剂优化实验中,得到更为廉价和低毒的甲醇作为提取试剂。多拉菌素在设定的温度、放置时间及pH为3~11的范围内均较稳定。萃取实验中以乙酸乙酯为萃取剂,优化得出其与多拉菌素浓缩提取液的体积比例为2∶1,萃取2次即可。
本实验中发现,发酵液中多拉菌素在pH为3~11时稳定存在。在pH值为13时,检测不到多拉菌素,故推测多拉菌素发生变化,降解至其它物质而不能被检测到。提取试剂实验中,乙腈极性较甲醇大,提取效果优于甲醇;但是乙腈成本及毒性也都较甲醇高,且两者提取所得多拉菌素的质量浓度差异不显著(P>0.05);故选择甲醇做完提取试剂。本文选择3倍浸提试剂提取菌体,是由预实验完成并在本文验证,菌丝体经3倍甲醇浸提2次即可浸提完全。
1 Mckellar QA,Benchaoui HA.Avermecins and milbermycins.J Vet Pharmacol Ther,1996,19:331-351.
2 Mckellar QA.Developments in pharmacokinetics and pharmacodynamics of anthelmintic drugs.J Vet Pharmacol Ther,1997,20(suppl.1):10-19.
3Hu HB(扈洪波),Zhu BL(朱蓓蕾),Li JS(李俊锁).Progress in research of avermectins.Chin J Anim Vet Sci(畜牧兽医学报),1999,(6):520-529.
4 Fang CL(房春林),Yang GY(杨光友),Gu XB(古小彬).Progress in research of doramectin.China Anim Husb Vet Med(中国畜牧兽医),2006,33:55-57.
5 Zhou XZ(周绪正),Zhang JY(张继瑜),Li JS(李金善),et al.Effects and application methods of doramectin.China Rual Sci Technol(中国农村科技),2005,11:37-38.
6 Gao YH(高玉红),Gu ZC(郭照成),Liu FY(刘方悦),et al.Research advancement and application of doramectin.J Northeast Agric Univ(东北农业大学学报),2009,40:141-144.
7 Harrison AC,Walker DK.Automated 96-well solid phase extraction for the determination of doramectin in cattle plasma.J Pharm Biomed Anal,1998,(16):777-783.
8 Hernando MD,Su'arez-Barcena JM,Bueno MJM,et al.Fast separation liquid chromatography–tandem mass spectrometry for the confirmation and quantitative analysis of avermectin residues in food.J Chromatogr A,2007,(1155):62-73.
Extraction Conditions of Doramectin in Fermentation Broth of Streptomyces avermitilis
ZOU Ze-xian1,2,CHEN Xin1,ZHANG Xiao-lin2*1Wuhan Polytechnic University,Wuhan 430023,China;2Academy of State Administration of Grain,Beijing 100037,China
The optimal extraction conditions of doramectin in fermentation broth of Streptomyces avermitilis were investigated by parallel experiments.Factors including distribution ratio of doramectin in fermentation broth(hyphae or supernatant),extractants,extraction times,storage time,pH and temperature on extraction results were investigated with onefactor experiments.Meanwhile,the optimal extraction times and extracting volume were optimized based on using ethyl acetate.The optimal extraction conditions of doramectin in fermentation broth of Streptomyces avermitilis were obtained as follows:the optimal extraction solvent was methanol,and doramectin in fermentation broth could be stored for at least 144 h within the conditions of pH from 3 to 11 and temperature from 20 to 80℃.Using ethyl acetate to extract doramectin,twice was the optimal extracting time,and the twice volume of ethyl acetate and concentrated extract was the best extraction proportion.Under the optimal extraction conditions,the concentration of doramectin and its extraction rate were 151.78 μg/mL and 98.00%,respectively.
doramectin;fermentation broth;extraction condition
1001-6880(2012)01-0110-04
2011-02-17 接受日期:2011-08-31
国家“863”计划高技术研究发展计划资助项目“生物兽药新产品研究和创制”(2006AA10A208-1)
*通讯作者 Tel:86-10-81763841;E-mail:zxl@chinagrain.org
R284.2
A
