卡拉胶/大豆11S蛋白共混体系相容性及凝胶性质研究
2012-11-23朱建华杨晓泉
朱建华 杨晓泉
卡拉胶/大豆11S蛋白共混体系相容性及凝胶性质研究
朱建华1杨晓泉2
(韶关学院英东食品科学与工程学院1,韶关 512005)
(华南理工大学轻工与食品学院2,广州 510640)
研究了大豆11S蛋白分别与3种不同荷电量卡拉胶组成共混体系的相容性、热性质、凝胶流变性质及微结构,并探讨了共混凝胶的成胶动力学及机理。结果表明:ι-卡拉胶对大豆11S蛋白的相容性比κ-卡拉胶弱,添加λ-卡拉胶样共混体系更易发生相分离;添加3种卡拉胶均提高了大豆11S蛋白的热变性温度,但降低了热焓值,影响效果依次是λ-卡拉胶﹥ι-卡拉胶﹥κ-卡拉胶;共混凝胶随卡拉胶所带负电荷的增加其弹性模量值呈降低趋势,且凝胶网络结构由蛋白-多糖双连续结构转变为蛋白凝胶网络单连续结构;增加卡拉胶所带负电荷可降低共混凝胶形成过程表观活化能,同时降低了温控程序终点的弹性模量值。
卡拉胶 大豆11S蛋白 相容性 凝胶 流变 微结构
食品结构与功能特性的关系是食品材料学的应用研究基础,目前如何控制和设计食品结构引起越来越多食品相关领域学者的关注[1-3]。食品体系大多是多组分的混合体系,食品大分子物质(蛋白质、多糖等)普遍存在于食品体系中,是构建各种食品体系的最主要基材。蛋白质与多糖的相互作用形式和程度决定了食品材料体系的最终结构,并进而主导各种食品功能的体现。因此研究蛋白-多糖的相互作用成为目前食品科学相关领域科技工作者关注焦点之一,利用它们之间的相容或排斥性质以获得尺度不同的微结构[4-6]。食品大分子的不相容性是食品体系中常见的现象,相分离通常是由两种大分子物质混合溶液的热力学不相容引起且受混合体系中一种或多种成分凝胶的影响[7]。胶凝固化是有效控制蛋白质和多糖体系相分离现象并获得相应食品微结构的有效途径之一,其给食品产品带来附加值的同时也给具体理论探索和实际应用提出挑战。
大豆蛋白主要组分为大豆7S蛋白(β-conglycinin)及11S蛋白(glycinin),分子质量分别为150~200 ku及300~380 ku,目前已有大量文献报道关于大豆分离蛋白、7S和11S热致凝胶性质[8-9]。另李向红等[10]曾研究多糖分子质量对大豆蛋白聚集体/葡聚糖混合体系微结构的影响,但关于阴离子多糖/球蛋白共混体系相容及凝胶性质的研究鲜见报道。阴离子多糖卡拉胶主要以κ、ι、λ型3种形式存在,每摩尔单糖分子结构中平均携带的负电荷数依次为0.5,1及1.5 mol,分子质量大小依次为390,370,410 ku[11]。相对大豆7S蛋白而言,卡拉胶分子质量与大豆11S蛋白分子质量更加接近,为屏蔽分子质量大小干扰考察多糖电荷量对蛋白凝胶性质的影响,本研究选择卡拉胶/大豆11S蛋白模型体系以研究阴离子多糖荷电量对球蛋白相容性、热性质、凝胶流变性质及微结构的影响,另对凝胶动力学及成胶机理进行了探讨,研究结果以期对开发和制备新型多糖-蛋白微结构食品材料提供指导作用。
1 材料与方法
1.1 材料与试剂
低温脱溶大豆粕片:山东禹王蛋白厂,蛋白(干基)质量分数55%,含水量7.3%;卡拉胶(κ-,ι-及λ-型)及Rhodamine B isothiocyanate(罗丹明B)染料:Sigma公司。
1.2 主要仪器和设备
Alpha-4冷冻干燥机:德国Matrin Christ公司;TAQ100-DSC差热分析仪:美国TA.Instruments公司;RHS600哈克流变仪:德国Hakke公司;Lcica TCS-SP2激光共聚焦仪:德国莱卡公司。
1.3 试验方法
1.3.1 大豆11S蛋白的制备
采用Nagano法来提取大豆豆粕中的蛋白质[12],制备的大豆11S蛋白经冷冻干燥备用。
1.3.2 蛋白、多糖储备液及共混溶液的制备
将大豆11S蛋白分散于磷酸缓冲液(pH 7.6,0.5 mol/L)中,充分搅拌3 h并在4℃条件下过夜,制备的大豆11S蛋白储备液质量浓度为150 mg/mL。配制质量浓度为1~15 mg/mL的卡拉胶储备溶液并于65℃条件下加热30 min以充分溶解。按不同比例将蛋白和多糖储备液混合于试管中并在室温下混合均匀。混合溶液于真空条件下脱气直至可见的气泡去除为止,然后用锡箔纸密封试管口并置于恒温水浴锅中于95℃恒温10 min。恒温阶段结束后,迅速取出试管并用冰浴快速冷却至室温并进行大豆11S蛋白/卡拉胶相图的测定。
1.3.3 蛋白及多糖-蛋白共混溶液的DSC热性质分析
使用TAQ100-DSC热分析仪对蛋白质进行热性质分析。取2.0 mg大豆11S蛋白或卡拉胶/大豆11S蛋白溶液样品放入铝盘,并加入10μL标准缓冲液,密封。温度扫描范围是20~120℃,升温速率是5℃/min。采用空的密封铝盘作为参照。测定蛋白质变性过程的基本参数为,初始变性温度(Ti)、变性温度峰值(Tp)及热焓值(ΔH)。每个试验重复3次。
1.3.4 相图的测定
在离心、化学分析和观察的基础上建立卡拉胶/大豆11S蛋白的相图。热处理后,将溶液移至离心管中,然后于2 000 g×15 min下离心以确保混合溶液完全相分离。取出上层液并测定其中蛋白和多糖浓度,进而用差示法测得离心后所得下层相中的蛋白和多糖浓度。节点的蛋白浓度用杜马斯定氮法测定,卡拉胶浓度通过苯酚硫酸法测定,相图双节线最后通过Origin 7.5软件拟合优化所得。
1.3.5 凝胶流变性质的测定
采用的仪器是带平行板的哈克流变仪(dD 27.83 mm),其间隙设置为1 mm,整个小变形振荡测试过程除特别说明外,均采用控制应变值为0.5%、频率为1 Hz及变温速率为1℃/min的条件下进行。测定程序依次为:由45℃升温至95℃并于95℃恒温30 min;由95℃降温至20℃并于20℃恒温30 min。记录弹性模量(G')和黏性模量值(G″)的变化。
1.3.6 激光扫描共聚焦显微镜(CLSM)观察凝胶微观性质
微结构采用Lcica TCS-SP2激光共聚焦仪进行观察。大豆11S蛋白水化2 h后,加入0.2 mg/mL罗丹明B荧光标记试剂,然后继续搅拌混匀0.5 h以使荧光标记试剂将蛋白染色充分,加入相应类型及浓度的卡拉胶储备液混合均匀。然后将混合液在95℃恒温水浴锅中加热15 min,取出并冷至室温。激光共聚焦观察前,用薄刀片将凝胶切成1~3 mm厚的小薄片。用20倍,40倍镜头选取所需观察对象,选择平面扫面xyz扫描模式,扫描像素为1 024×1 024。Ar/Kr激光器激发波长488 nm,激发值为100%。
1.3.7 数据处理
应用origin7.5软件进行试验数据统计处理,样品组和对照组之间的差异显著性采用one way Anova方法分析,P<0.05表示差异显著。
2 结果与讨论
2.1 拉胶/大豆11S蛋白相图的测定与分析
卡拉胶/大豆11S蛋白的相图见图1。由图1可知κ-,ι-,及λ-卡拉胶/大豆11S蛋白共混体系的相图形状差别较大。双节线将κ-卡拉胶/大豆11S蛋白相图划分为两个区域,双节线以上的为不稳定区,而双节线以下的为稳定区域。由图1可知宏观相分离只是在大豆11S蛋白质量浓度低于其凝胶所需质量浓度时才发生,当蛋白质量浓度进一步增加时,混合体系出现凝胶现象。试验结果表明体系中凝胶和相分离同时发生,蛋白浓度越高,形成凝胶所需κ-卡拉胶浓度越低,表明随κ-卡拉胶浓度的增加凝胶形成速度越快(图1a)。ι-卡拉胶对大豆11S蛋白的相容性比κ-卡拉胶弱(图1b),可由前者相图中相容区域面积小于后者对应值所证实。λ-卡拉胶因自身不具备胶凝性质,所以兼具中性多糖的空间位阻效应,另带负电荷比较多,在大豆11S蛋白浓度低于其凝胶浓度时增加λ-卡拉胶更易导致相分离发生(图1c)。
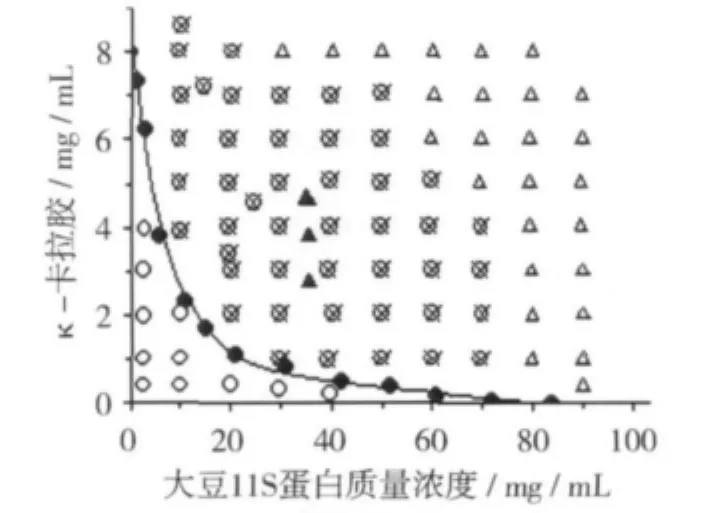
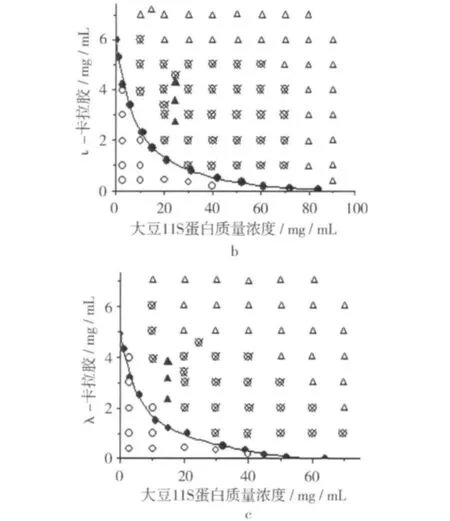
图1 卡拉胶/大豆11S蛋白体系相图
2.2 卡拉胶对大豆11S蛋白热性质的影响
热性质测定结果(表1)显示3种带不同荷电量卡拉胶对大豆11S蛋白热性质的影响能力具明显差异,卡拉胶的存在普遍提高了大豆11S蛋白的热变性温度,但降低了热焓值,影响效果依次是λ-卡拉胶﹥ι-卡拉胶﹥κ-卡拉胶。其中影响效果最明显,与对照相比添加λ-卡拉胶后大豆11S蛋白的变性温度值从94.76℃升高到97.01℃,而热焓值从17.12 J/g降低到14.70 J/g。κ - 卡拉胶对大豆11S蛋白热性质的影响作用最小,与对照相比加入κ-卡拉胶后大豆11S蛋白的变性温度值升高到95.14℃,而热焓值则降低为16.13 J/g。ι-卡拉胶对大豆11S蛋白热变性温度及热焓值的降低幅度介于κ-卡拉胶和λ-卡拉胶之间。
从试验结果可以看出卡拉胶的存在对大豆11S蛋白的热性质有明显提高作用。此现象是由于相分离导致的蛋白富集所致,当给予多糖-蛋白体系的能量越过能垒后,离散相分离效应可显著加速变性大豆11S蛋白组分的聚集作用,并释放出部分能量,进而导致卡拉胶加入后大豆11S蛋白热焓值降低。但关于多糖对各种蛋白热性质的影响尚存争议,Zhang等[13]通过动力学及蛋白结构发现了λ-卡拉胶存在可降低-乳球蛋白聚集行为的机理,Galazka等[14]通过圆二色谱分析及浊度测定表明λ-卡拉胶抑制了-乳球蛋白三级结构变化并可减少聚集发生。
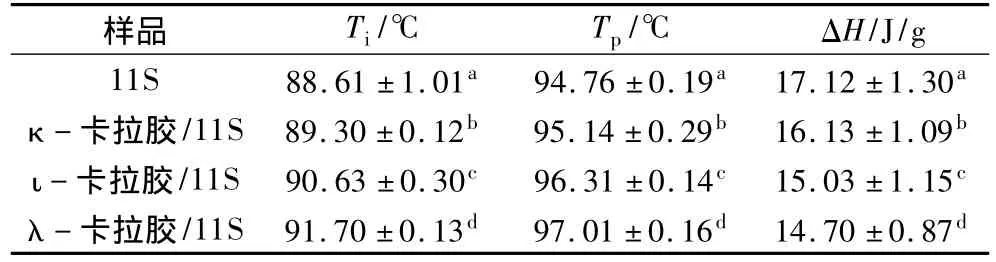
表1 阴离子多糖卡拉胶对大豆11S 蛋白热性质的影响
2.3 卡拉胶对大豆11S蛋白凝胶流变性质的影响
图2a表明κ-卡拉胶加入到大豆11S蛋白体系后,形成的共混凝胶粘弹模量值随卡拉胶浓度的增加而增加,且曲线尾端斜率明显增加。由图2b可知随ι-卡拉胶浓度的增加大豆11S蛋白凝胶粘弹性质呈增加趋势,但与添加κ-卡拉胶样相比较存在显著差异,同浓度卡拉胶时,添加κ-卡拉胶的共混凝胶在形成凝胶网络的温控程序过程的G'显著大于添加ι-卡拉胶样。另在降温至31℃时,ι-卡拉胶未能改变凝胶弹性模量增加的趋势,说明ι-卡拉胶在此过程的凝胶程度显著弱于大豆11S蛋白,凝胶形成过程由大豆11S蛋白主导。Chronakis[15]发现了类似现象,与κ-卡拉胶相比ι-卡拉胶可形成黏弹模量对频率依赖性更小的刚性凝胶。此结果主因ι-卡拉胶比κ-卡拉胶更能稳定大豆11S蛋白结构,导致大豆11S蛋白在恒温阶段未能完全展开形成网络引起。

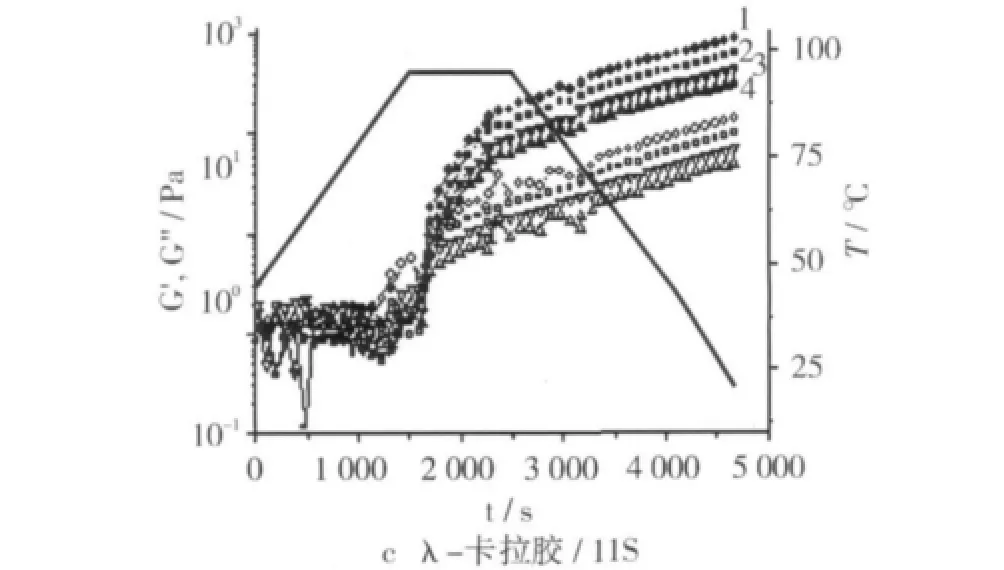
图2 卡拉胶/大豆11S蛋白凝胶G',G″模量随时间变化曲线
图2c表明添加λ-卡拉胶后大豆11S蛋白凝胶黏弹模量值明显降低,此趋势与添加ι-卡拉胶及κ-卡拉胶样完全不同,说明添加λ-卡拉胶胶后明显削弱了大豆11S蛋白凝胶网络结构,且随λ-卡拉胶浓度的增加大豆11S蛋白凝胶弹性模量值继续降低。此结果主要由以下两方面因素引起:1)热性质分析结果表明添加λ-卡拉胶显著提高了大豆11S蛋白的热稳定性,表明λ-卡拉胶抑制大豆11S蛋白网络形成的强度大于ι-卡拉胶和及κ-卡拉胶;2)且λ-卡拉胶每个糖单元结构上带有三个硫酸酯基,同等浓度下具更高的负电荷量,因静电排斥效应加速共混体系的相分离程度明显大于ι-卡拉胶和κ-卡拉胶。
2.4 卡拉胶对大豆11S蛋白热致凝胶微结构的影响
图3为卡拉胶电荷量及浓度对大豆11S蛋白凝胶微结构影响的观察结果。由图3可知,大豆11S蛋白对照样形成凝胶的外观结构比较均匀。加入κ-卡拉胶后,出现明显的相分离结构,蛋白凝胶的结构中出现非连续的卡拉胶相,且相分离程度随κ-卡拉胶浓度增加呈加剧趋势。
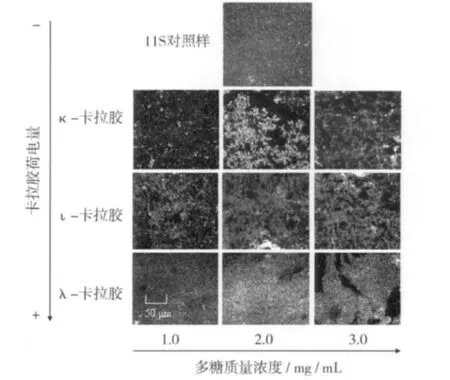
图3 卡拉胶/大豆11S蛋白共混凝胶CLSM扫描微结构图
加入1.0 mg/mLι-卡拉胶后,凝胶网络结构的平滑度低于对照样,主要是由于ι-卡拉胶加入后导致蛋白-多糖体系发生相分离作用所致。因ι-卡拉胶比κ-卡拉胶荷电量高,因此体系发生的静电排斥作用高于κ-卡拉胶/大豆11S蛋白体系,具更强的相分离作用。微结构结果显示ι-卡拉胶/大豆11S蛋白体系中蛋白主要是以簇形状存在,而κ-卡拉胶/大豆11S蛋白共混中蛋白存在形式兼具颗粒状和细绳状。ι-卡拉胶/大豆11S蛋白共混凝胶微结构与κ-卡拉胶/大豆11S蛋白共混凝胶及对照样微结构的明显差异主要是两方面原因引起的,一方面ι-卡拉胶更高的荷电量加强了体系的相分离作用,另一方面则主要是ι-卡拉胶具更强热稳定大豆11S蛋白的作用,其蛋白质三级结构展开过程迟滞于κ-卡拉胶体系。加入λ-卡拉胶形成的共混凝胶结构与加入κ-和ι-卡拉胶样明显不同,因其具更高负电荷密度,最终形成的凝胶相分离程度大于κ-及ι-卡拉胶/大豆11S蛋白共混凝胶体系。
2.5 阴离子多糖/球蛋白共混体系凝胶动力学及机理探讨
热性质、流变性质及微结构分析表明阴离子多糖/球蛋白共混凝胶形成过程经历了3个步骤,从45℃以恒定速率升温到95℃并恒温30 min,到最后以恒定速率降温到20℃的过程。升温和恒温过程球蛋白发生三级结构展开,疏水区暴露及蛋白变性完成的阶段,而恒定速率降温阶段主要对应球蛋白凝胶网络结构形成并熟化阶段。即首先球蛋白在多糖的存在下展开变性,然后变性蛋白聚集,最后聚集的蛋白相互链接成网络结构并形成凝胶(图4)。其中恒定速率降温阶段过程的凝胶形成动力学可用非等温动力学方程来分析[16]:
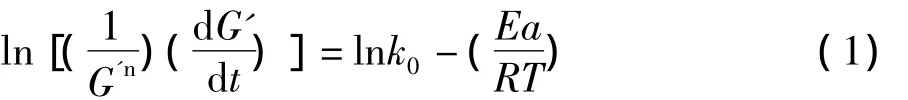
式中:n为反应级数;t为时间/s;k0为Arrhenius频率因子;Ea为凝胶形成过程的表观活化能/kJ/mol;R为通用气体常数[8.314 kJ/(mol·K)];T为绝对温度值/K。n值因混合体系中蛋白凝胶涉及蛋白聚集的形成可用二级反应级数来描述,即n=2。弹性模量G'及结构形成速率(SDR=d G'/d t)值可由凝胶过程流变曲线获得。然后根据方程1将计算出的 l n值对1/T值进行拟合,进而可由拟合获得曲线的斜率计算所得Ea/R并求得Ea值。
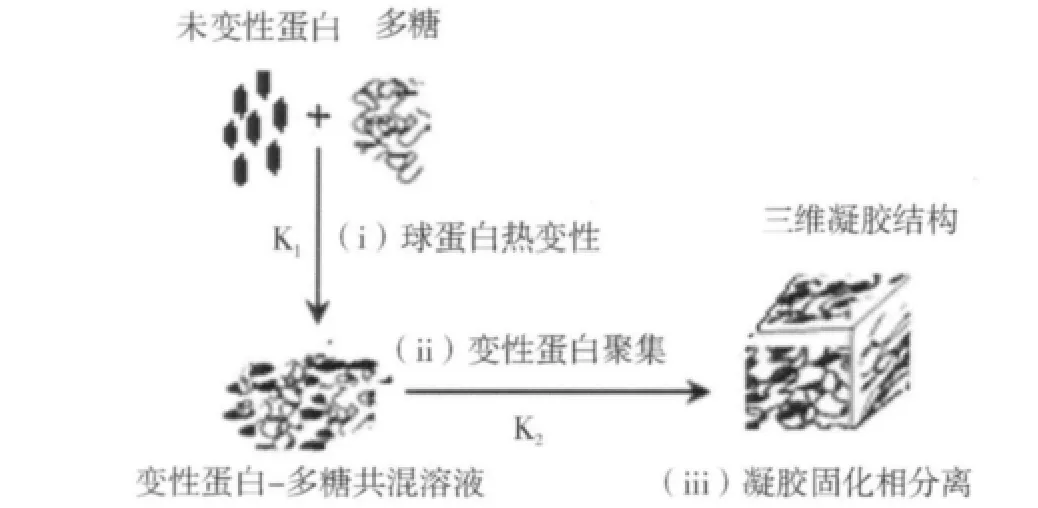
图4 阴离子多糖/球蛋白共混体系热致凝胶形成机理模型图

图5 多糖类型对大豆卡拉胶/11S蛋白共混凝胶形成过程Ea及降温终点弹性模量值G'f的影响
通过方程1对图2降温过程流变曲线计算并回归出凝胶形成过程Ea值(图5a)。由图5a可知随卡拉胶浓度的增加或电荷量的增加活化能呈降低趋势,表明多糖负电荷量增加有利于凝胶形成。添加阴离子多糖后最终凝胶形成的弹性模量值(图5b)与Ea变化趋势不一致,主要是共混凝胶的弹性模量值受到混合体系中连续相及分散相网络结构相对强弱的影响所致。由图2及图3可知不同类型卡拉胶对大豆11S蛋白凝胶网络的粘弹性质及网络结构作用有明显差异。从电荷量变化趋势分析,大豆11S蛋白随卡拉胶所带负电荷的增加导致弹性模量值降低,且凝胶网络结构由卡拉胶/大豆11S蛋白双连续结构转变为大豆11S蛋白凝胶网络单连续结构,双连续结构的G'值高于大豆11S蛋白凝胶单连续结构,而非连续结构的G'值最小。添加相对较低浓度卡拉胶时,大豆11S蛋白以连续相结构存在,其共混模量值可用公式Gc'=(Фx/G'x+Фy/G'y)-1表征,凝胶强度主要由球蛋白主导。而添加高荷电量卡拉胶时蛋白/卡拉胶共混体系转变为双连续相,根据大分子混合法则共混凝胶的复合模量值可用Gc'=(ФxG'x+ФyG'y)表征,凝胶强度主要受卡拉胶主导。
3 结论
阴离子多糖卡拉胶的存在提高了大豆11S蛋白的热变性温度,但降低了其热焓值。添加κ-卡拉胶和ι-卡拉胶后形成的共混凝胶黏弹模量值随卡拉胶浓度的增加而增加,添加λ-卡拉胶可明显削弱大豆11S蛋白凝胶网络结构并降低弹性模量值。阴离子/球蛋白多糖共混凝胶的形成过程首先是球蛋白在多糖的存在下变性展开,然后变性蛋白聚集相互链接成网络结构并形成凝胶。添加相对较低浓度卡拉胶时,大豆11S蛋白以连续相结构存在,其凝胶复合模量值可用公式Gc'=(Фx/G'x+Фy/G'y)-1表征,凝胶强度主要受球蛋白主导。而添加高荷电量卡拉胶时蛋白/卡拉胶共混体系转变为双连续相,凝胶强度主要受卡拉胶主导,共混凝胶复合模量值可用Gc'=(ФxG'x+ФyG'y)表征。
[1]van der Sman R G M,van der Goot A J.The science of food structuring[J].Soft Matter,2009,5:501-510
[2]Mezzenga R,Schurtenberger P,Burbidge A,et al.Understanding foods as soft materials[J].Nature Material,2005,4:729-740
[3]Ubbink J,Burbidge A,Mezzenga R.Food structure and functionality:a soft matter perspective[J].Soft Matter,2008,4:1569-1581
[4]Schmitt C,Sanchez C,Desobry-Banon S,et al.Structure and technofunctional properties of protein-polysaccharides complexes:A review[J].Critical Review in Food Science and Nutrition,1998,38:689-753
[5]Kasapis S.Phase Separation in Biopolymer Gels:A Low-to High-Solid Exploration of Structural Morphology and Functionality[J].Critical Reviews in Food Science and Nutrition,2008,4:341-359
[6]Morris V J,Wilde P J.Interaction of food biopolymers[J].Current Opinion in Colloid and Interface Science,1997,2:567-572
[7]Edelman M W,van der Linden E,de Hoog E H A,Tromp R H.Compatibility of gelatin and dextran in aqueous solution[J].Biomacromolecules,2001,2:1148-1154
[8]Renkema JM S,van Vliet T.Concentration dependence of dynamic moduli of heat-induced soy protein gels[J].Food Hydrocolloids,2004,18:483-487
[9]Hermansson A M.Structure of soya glycinin and conglycinin gels[J].Journal of the Science of Food and Agriculture,1985,36:822-832
[10]李向红,华欲飞,刘展,等.多糖分子质量对大豆蛋白聚集体/葡聚糖混合体系微观结构的影响[J].中国粮油学报,2010,3:16-21
[11]Hilliou L,Larotonda F D S,Goncalves M P.Thermal and viscoelastic properties of kappa/iota-hybrid carrageenan gels obtained from the Portuguese seaweed Mastocarpus stellatus[J].Journal of Agricultural and Food Chemistry,2006,54:7870-7878
[12]Nagano T,Hirotsuka M,Mori H,et al.Dynamic viscoelastic study on the gelation of 7Sglobulin from soybeans[J].Journal of Agricultural and Food Chemistry,1992,40:941-944
[13]Zhang G,Foegeding E A,Hardin CC.Effect of sulfated polysaccharides on heat induced structural changes in betalactoglobulin[J].Journal of Agricultural and Food Chemistry,2004,52:3975-3981
[14]Galazka V B,Smith D,Ledward D A,et al.Complexes of bovine serum albumin with sulfated polysaccharides:Effects of pH,ionic strength and high pressure treatment[J].Food Chemistry,1999,64:303-310
[15]Chronakis I S,Doublier J L,Piculell L.Viscoelastic properties for kappa-and iota-carrageenan in aqueous NaI from the liquid-like to the solid-like behaviour[J].International Journal of Biological Macromolecules,2000,28:1-14
[16]Rhim J W,Nunes R V,Jones V A.Determination of kinetic parameters using linearly increasing temperature[J].Journal of Food Science,1993,54:446-450.
Study on the Phase Behavior and Gel Properties of Mixed Soybean Carrageenan/Soybean 11SProtein System
Zhu Jianhua1Yang Xiaoquan2
(Yingdong Food Science and Technology College,Shaoguan College1,Shaoguan 512005)
(Department of Food Science and Technology,South China University of Technology2,Guangzhou 510640)
The effect of three carrageenan with different charge density on the compatibility,thermal properties,gel rheological properties and microstructure of soybean 11Sprotein has been studied.As results showed thatκ-carrageenan had more compatibility to soybean 11Sprotein than samples withι-carrageenan,and blends withλ -carrageenan system was easier to cause phase separation.Incorporation of carrageenan could increase the thermal denaturation temperature of soybean 11S protein,but reduced the enthalpy value,ranking asλ -carrageenan> ι-carrageenan> κ -carrageenan.With negative charge increase of the carrageenan/soybean 11Sprotein the elastic modulus of the mixed gel decreased,and the gel network structure was changed from carrageenan-soybean 11Sprotein bicontinuous into a single protein continuous.Gel kinetics showed that with negative charge increase the apparent activation energy of mixed gels were reduced,while the elastic modulus value in final temperature procedure also was reduced.
carrageenan,soybean 11Sprotein,compatibility,gel,rheology,microstructure
TS201.21
A
1003-0174(2012)07-0026-06
国家自然科学基金(21076087,31101215),广东省自然科学基金(10451200501004341),广东高校优秀青年创新人才培养计划(LYM10120)
2011-10-12
朱建华,男,1978年出生,博士,副教授,食品材料结构与功能性质
