梅片树叶挥发油的抗氧化活性研究
2012-11-15陈建平苏健裕李晓玺
陈建平,苏健裕,陈 玲,李 琳,李 冰,李晓玺
(华南理工大学轻工与食品学院,广东广州510640)
梅片树叶挥发油的抗氧化活性研究
陈建平,苏健裕*,陈 玲,李 琳,李 冰,李晓玺
(华南理工大学轻工与食品学院,广东广州510640)
目的:对梅片树叶挥发油的抗氧化活性进行了研究。 方法:采用水蒸气蒸馏法提取得到挥发油,用紫外分光光度法测定挥发油对羟基(OH)自由基、1,1-二苯基-2-三硝基苯肼(DPPH)自由基的清除能力以及挥发油的还原能力,并与2,6-二叔丁基-4-甲基苯酚(BHT)比较。同时,对影响其抗氧化活性的物质进行分析。 结果:挥发油对羟基自由基具有较好的清除能力,且清除效果要强于BHT;而挥发油对DPPH·的清除率和还原能力要明显弱于BHT,梅片树叶挥发油中高含量的总多酚和总黄酮可能是其抗氧化活性的主要物质来源。 结论:挥发油在某些抗氧化活性方面有较好的抗氧化效果,具有作为天然抗氧化剂的巨大潜力。
梅片树,挥发油,抗氧化,水蒸气蒸馏
梅片树(Mei Pian tree)是樟科常绿乔木[1],在外部形态方面与樟科樟属的阴香(Cinnamomun burmannii B1.)无异,特点在于其叶含有丰富的右旋龙脑,故梅片树应是阴香的一个含右旋龙脑的生理类型,或称化学类型。梅片树多数在南亚热带常绿阔叶林中或林缘混生[2]。在我国,梅片树主要分部在云南及广东东部地区。细胞内自由基产生的损伤可以导致癌症、心血管疾病和免疫系统衰退等多种退变性疾病[3],摄入外源性的抗氧化剂能有效地预防或抑制这些疾病的发生。因此,天然抗氧化剂受到越来越多的关注[4]。近年来,挥发油的抗氧化活性研究成为热点,如迭迷香精油[5]、鼠尾草精油[6]、香菜精油[7]、仙人掌精油[8]等。上世纪八十年代,中科院华南植物所在广东梅州地区的樟科阴香化学型——梅片树枝叶中提取得到了挥发油。然而,目前国内梅片树叶挥发油的研究主要集中在挥发油的提取工艺及其成分分析等方面,暂无对梅片树枝叶中挥发油抗氧化活性的相关研究报道。本文运用水蒸气蒸馏和抽滤得到梅片树叶挥发油,通过紫外分光光度法对其清除羟基自由基和DPPH自由基的性能以及挥发油还原能力进行测定,并对影响其抗氧化活性的主要物质进行分析,从而探讨梅片树叶挥发油的抗氧化性能,以期为产业化开发梅片树、阐明梅片树挥发油抗氧化物质基础和作用机理奠定基础。
1 材料与方法
1.1 材料与仪器
梅片树叶 广东省梅州市广东嘉应制药股份有限公司提供,中科院华南植物研究所鉴定为樟科阴香化学型(Cinnamomun burmannii B1.);2,6-二叔丁基-4-甲基苯酚 上海凌峰化学试剂有限公司,化学纯;铁氰化钾、三氯乙酸 江苏永华精细化学品有限公司,分析纯;三氯化铁 台山市奥侨试剂塑料有限公司,分析纯;30%过氧化氢 国药集团化学试剂有限公司,分析纯。
SHZ-D(Ⅲ)循环水式真空泵 巩义市英峪予华仪器厂;BS224S电子天平 德国Sartorius公司;50-conc紫外可见分光光度计 美国VARIAN公司;3K30冷冻高速离心机 美国SIGMR公司。
1.2 实验方法
1.2.1 挥发油的提取[9]将新鲜梅片树叶粉碎,按《中国药典》(2005版)附录XD的水蒸气蒸馏法提取挥发油。收集蒸馏的馏出物,向其中投入过量无水硫酸钠并充分振荡,使用循环水式真空泵抽滤此混合物得到挥发油。挥发油为黄色透明油状物,称量、计算挥发油的得率。
挥发油得率(%)=[挥发油质量(g)/梅片树叶质量(g)]×100%
1.2.2 挥发油成分分析[10]
1.2.2.1 GC条件 HP-5MS弹性石英毛细柱管(30m× 0.25mm,0.25μm);升温程序:80℃恒温1min后,以20℃/min的速度升温至250℃,保持5min。进样量0.5μL,采用不分流的方式进样,进样口温度为250℃;检测温度为300℃;载气为氮气,过柱载气恒流速为2mL/min。
1.2.2.2 MS条件 电子轰击(EI)离子源;电子能量70eV;传输线温度275℃;离子源温度230℃;发射电流34.6VA,电子倍增器电压1392V;扫描质量范围m/z 33~450。
1.2.3 挥发油的抗氧化活性实验
1.2.3.1 挥发油对羟基自由基清除能力的测定 取5支试管,依次加入1.5mmol/L的邻二氮菲溶液1mL,磷酸盐缓冲液PBS(pH7.4)2mL,挥发油各0.2、0.4、0.6、0.8、1.0mL,0.75mmol/L硫酸亚铁溶液1mL,充分混匀,加入0.01%H2O21mL,在37℃下恒温反应45min,在536nm处测其吸光度,其吸光值称为As。同前步,用1mL蒸馏水代替H2O2,测得的吸光度称为Ab。用蒸馏水1mL代替1mL溶液,测得的吸光度称为Ap,用2,6-二叔丁基-4-甲基苯酚(BHT)作比较。所有测定平行进行三次。OH自由基清除率计算公式如下:
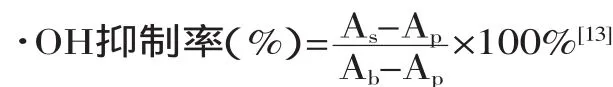
1.2.3.2 挥发油对DPPH自由基清除作用的测定 取不同浓度的挥发油(0.02、0.1、0.2、0.5mg/mL)各2mL,分别添加0.2mmol/L的DPPH乙醇溶液各2mL,混合物用力振荡并室温避光反应30min,在517nm处测吸光值Ai,同时测定DPPH乙醇溶液2mL+乙醇2mL的吸光度Ao和溶液2mL+乙醇2mL的吸光度Aj,用2,6-二叔丁基-4-甲基苯酚(BHT)作比较。所有测定平行进行三次。计算公式如下:
DPPH·抑制率(%)=[1-(Ai-Aj)/Ao]×100%[15]
1.2.3.3 挥发油的还原能力测定 取不同浓度的挥发油溶液(0.2、0.4、1.0mg/mL)各2.5mL,加入0.2mol/L磷酸钠缓冲溶液(pH=6.6)2.5mL和2.5mL的1%的铁氰化钾,混合物在50℃的水浴中保温20min,再加入2.5mL的10%的三氯乙酸,在200×g下离心10min。取上清液3.5mL与0.5mL去离子水和0.5mL 0.1%的三氯化铁混合,最后,在700nm处测其吸光度,用2,6-二叔丁基-4-甲基苯酚(BHT)做对照。所有测定平行进行三次。
1.2.3.4 挥发油中总黄酮含量的测定 采用Meda等[11]的方法,略有修改。取5mL挥发油,加入5mL 2%AlCl3溶液。另取挥发油5mL,加入5mL 2%乙醇溶液作为空白实验,反应10min后在415nm处测定其吸光值。以芦丁为标准品配成一定质量浓度的样液做标准曲线,所有测定平行进行三次。所得芦丁标准曲线方程如下:

式中:A:吸光度;C1:芦丁的质量浓度(μg/mL)。
1.2.3.5 挥发油中总多酚含量的测定 采用Slinkard等[12]的方法,略有修改。取0.5mL的挥发油,依次加入1mL 0.2mol/L福林试剂、3mL 2%Na2CO3溶液和45mL蒸馏水,室温振荡反应2h,在760nm处测定其吸光度。以没食子酸为标样,配成一定质量浓度的样液,绘制标准曲线,所有测定平行进行三次。根据测得的吸光度,计算样品中的多酚含量(以没食子酸计)。所得没食子酸标准曲线方程如下:
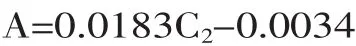
式中:A:吸光度;C2:没食子酸的质量浓度(μg/mL)。
2 结果与分析
2.1 挥发油的成分分析
采用水蒸气蒸馏法提取梅片树叶中挥发油,并且利用GC-MS分析挥发油的组成,其主要成分见表1。

表1 梅片树叶挥发油的主要成分[10]Table 1 The main composition of volatile oil from Mei Pian tree
2.2 挥发油的抗氧化实验结果
2.2.1 挥发油对羟基自由基的清除能力 邻二氮菲-Fe2+是常用的氧化还原指示剂,其颜色变化可敏锐地反映溶液氧化还原状态的改变。H2O2/Fe2+体系通过Fenton反应产生羟基自由基[13],邻二氮菲-Fe2+水溶液可被羟自由基氧化为邻二氮菲-Fe3+,从而使邻二氮菲-Fe2+在536nm处的最大吸收峰消失。当反应体系中存在羟基自由基清除剂时,就可以抑制羟基自由基的形成,从而使得邻二氮菲-Fe2+在536nm处的最大吸收峰不会完全消失,根据536nm处吸光度的变化,可以推知样品对羟基自由基的抑制率。
梅片树叶挥发油和BHT对羟基自由基清除率的结果如表2所示,可知挥发油和BHT对羟基自由基都有一定的清除作用。在实验测定的体积范围内,挥发油和BHT对羟基自由基的清除率均随着其体积的增加而增大,基本呈线性关系。从表2可知,在一定的体积范围内(0.6~1.0mL),挥发油对羟基自由基的清除能力要强于BHT。当挥发油的体积为1mL时,对羟基自由基的清除能力达到最大(95.37%),远大于1mL BHT对羟基自由基的清除能力(52.24%)。这可能是因为体积的增大,挥发油中抗氧化物质增多,对羟基自由基的清除能力增强。
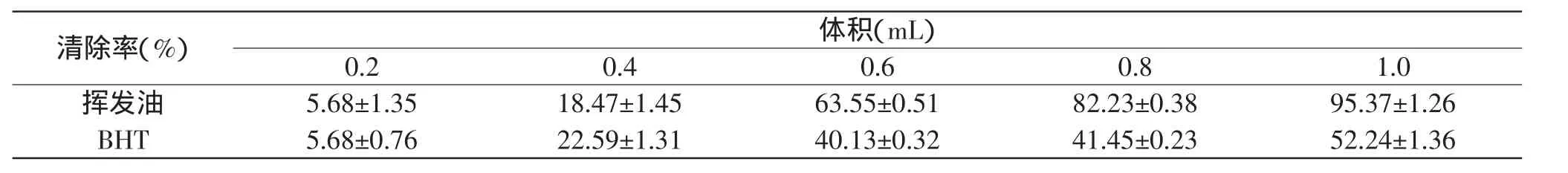
表2 相同浓度不同体积的挥发油和BHT对羟基自由基的清除率Table 2 The different volume of the same concentration of volatile oil and BHT on activity of scavenging OH radicals
2.2.2 挥发油对DPPH·的清除能力 DPPH·在有机溶剂中由于苯环的共轭和位阻及硝基的吸电子作用而形成,是一种比较稳定的自由基[14],其N上有一个游离电子,其乙醇溶液呈紫色,在517nm处有最大吸收峰。当有自由基清除剂存在时,由于与其单电子配对而使其吸收逐渐消失,其褪色程度与其接受的电子数成定量关系[15]。依此原理用分光光度计检测DPPH自由基与试样液反应后吸光值的变化,可检定样品提供氢原子、清除自由基抗氧化的能力。
根据表3可知,挥发油和BHT对DPPH·的清除能力在不同浓度下强弱不同。在实验测定的浓度范围(0.02~0.5mg·mL-1)内,挥发油对DPPH·的清除能力要明显弱于阳性对照BHT。随着挥发油浓度的提高,其对DPPH·的抑制率总体呈上升趋势。可能是由于挥发油浓度的提高,挥发油中抗氧化活性物质含量增多,从而使得挥发油对DPPH·的抑制率也有所上升。
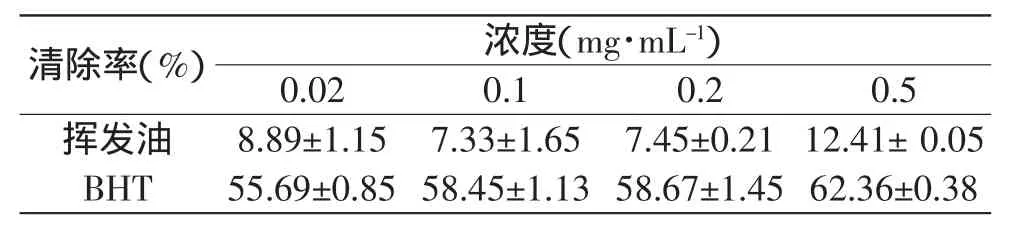
表3 梅片树叶挥发油对DPPH·的清除率Table 3 Scavenging effect on 1,1-diphenyl-2-picrylhydrazyl of essential oil from Mei Pian tree at different concentrations
2.2.3 挥发油的还原能力测定 三价铁离子被样品还原为二价铁离子,二价铁离子与铁氰化钾反应生成对可见光有较强吸收的普鲁士蓝[16],通过测定普鲁士蓝的吸光度来间接判定样品的还原能力。
不同浓度挥发油和阳性对照BHT的还原能力如表4所示,可知挥发油随其浓度的上升,其还原能力也随之增强。这也许是挥发油中具有还原能力的物质增加,使得更多的铁离子还原成为亚铁离子,因此吸光度值上升。当挥发油浓度为1.0mg·mL-1时,吸光度值为0.4492。从表4可知,相同浓度的挥发油的还原能力要明显弱于BHT。
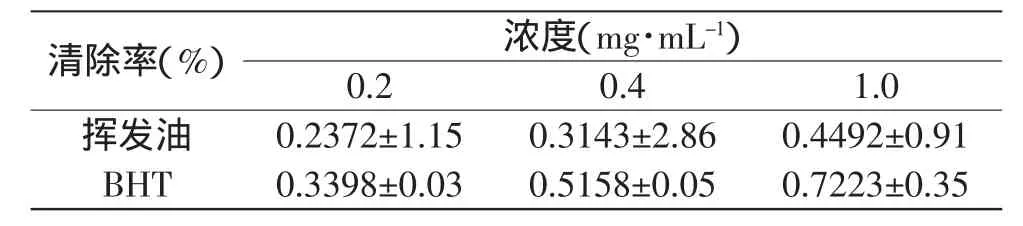
表4 不同浓度的挥发油和BHT的还原能力Table 4 The reductive ability of different concentration of volatile oil and BHT
2.2.4 挥发油中总黄酮和总多酚含量的测定 为了进一步探讨梅片树叶挥发油抗氧化活性的物质基础,对挥发油中总黄酮和总多酚的含量进行了测定,其测定结果如表5所示。从表5可知,挥发油中总多酚和总黄酮的含量分别达到了(124.95±2.70)μg/mg和(2.7384±0.01)μg/mg,从而说明影响挥发油抗氧化活性的物质可能主要来自高含量的总多酚和总黄酮。江慎华[17]等人对丁香的抗氧化活性进行研究时,也发现其主要的抗氧化活性物质基础由总多酚和总黄酮所贡献。由此可见,梅片树叶挥发油的抗氧化活性可能主要来自总多酚和总黄酮的假设得到了进一步的验证。
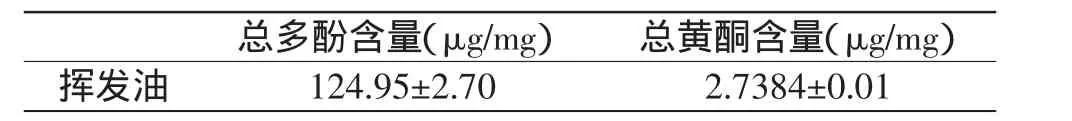
表5 梅片树叶挥发油中总黄酮和总多酚含量Table 5 Total phenolics and flavonoids content of essential oil from leaves of Mei Pian tree
3 结论
本实验通过对羟基自由基的清除能力、DPPH·清除能力和挥发油还原能力三方面来评价梅片树叶挥发油的抗氧化活性,并与阳性对照品BHT作比较。通过GC-MS分析影响挥发油的主要成分,并且测定了挥发油中总黄酮和总多酚的含量。实验结果表明:在一定的体积范围内,挥发油对羟基自由基清除能力要强于BHT,说明挥发油对羟基自由基具有较好的清除能力,能有效清除羟基自由基。尽管挥发油对DPPH·的清除率和还原能力均不如BHT,但考虑到挥发油是混合物,其中所含的杂质比较多,而阳性对照为高浓度的分析纯,如果进一步提高挥发油中活性物质的浓度,其抗氧化效果将会有明显的提高。经过GC-MS分析测定,挥发油的抗氧化活性由其主要成分决定,且挥发油中高含量的总多酚和总黄酮可能是其抗氧化活性的主要物质来源。
虽然上述实验结果表明人工合成抗氧化剂BHT也具有良好的抗氧化效果,但作为化学合成抗氧化剂,其使用剂量有严格限制[18]。然而,相比化学合成抗氧化剂而言,天然的梅片树叶挥发油具有毒副作用小、可使用剂量无严格限制等优点,且在某些抗氧化活性上也明显优于人工合成的抗氧化剂,因此,梅片树叶挥发油具有作为天然抗氧化剂的巨大潜力,这为开发新的天然无害抗氧化剂提供了新的思路和资源。同时,在食品保鲜、药物研发等方面,梅片树叶挥发油也具有相当广阔的应用前景。
[1]郑文澄.观赏和经济树种-梅片树[J].生命世界,1992(3):24.
[2]李毓敬,朱亮锋,陆碧瑶,等.天然右旋龙脑新资源-梅片树的研究[J].植物学报,1987,29(5):527-531.
[3]Jiang SH,Wang C L,Chen ZQ,et al.Antioxidant properties of the extract and subfractions from old leaves of toona sinensis roem(meliaceae)[J].Journal of Food Biochemistry,2009,33(3):425-441.
[4]Gioti EM,Fiamegos Y C,Skalkos D C,et al.Antioxidant activity and bioactive components of the aerial parts of Hypericum perforatum L from Epirus,Greece[J].Food Chemistry,2009,117(3):398-404.
[5]Vassiliki P,Chryssaygi G,Athanasios M,et al.Variation of the chemical profile and antioxidant behavior of rosmarinus officinalis L.and salvia fruticosa miller grown in greece[J]. Journal of Agriculture and Food Chemistry,2008,56:7254-7264.
[6]Mustafa K,Bektas T C.Composition,antioxidant and antimicrobial properties of the essential oils of three Salvia species from Turkish flora[J].Bioresource Technology,2008,99:4096-4104.
[7]Isidora S,Neda L,Neda M,et al.Antioxidant and hepatoprotective potential of essential oils of coriander(Coriandrum sativum L.)and caraway(Carum carvi L.)(Apiaceae)[J].Journal of Agriculture and Food Chemistry,2010,58:8848-8853.
[8]Liu W,Fu L J,Zu Y G,et al.Supercritical carbon dioxide extraction of seed oil from Opuntia dillenii Haw and its antioxidant activity[J].Food Chemistry,2009,114:334-339.
[9]国家药典委员会.中华人民共和国药典(2005年版1部)[M].北京:化学工业出版社,2005.
[10]苏健裕,陈玲,李冰,等.梅片树叶挥发油提取及成分分析[J].食品科学,2010,31(20):399-401.
[11]Meda A,LamienCE,Romito,et al.Determination of the total phenolic,flavonoid and proline contents in Burkina Fasan honey,as well as their radical scavenging activity[J].Food Chemistry,2005,91:571-577.
[12]Slinkard K,SingletonVL.Total phenol analyses:automation andcomparison with manual methods[J].American Journal of Enology and Viticulture,1977,28:49-55.
[13]洪雪,姜子涛,李荣.调味香料草果挥发油的抗氧化性能及清除自由基能力[J].中国调味品,2010,35(3):48-54.
[14]陈平,樊瑞胜,聂芊,等.橙皮苷磺酸钠对自由基清除能力的研究[J].食品工业科技,2007,28(9):64-66,69.
[15]许申鸿,杭瑚.用DPPH分析法研究野生植物的抗氧化活性[J].青岛大学学报,1999,12(3):75-77.
[16]郑立庆,李晶,范顺利,等.铁氰化钾-三氯化铁显色体系分光光度法测定特步他林[J].化学研究与应用,2010,22(7):691-694.
[17]江慎华,王书源,马海乐,等.丁香活性物质的提取工艺及其抗氧化活性研究[J].农业机械学报,2010,41(1):132-138.
[18]薛丁萍,魏玉西,刘淇,等.浒苔多糖对羟自由基的清除作用研究[J].海洋科学,2010,34(1):44-46.
Study on antioxidant activity of volatile oil from Mei Pian tree
CHEN Jian-ping,SU Jian-yu*,CHEN Ling,LI Lin,LI Bing,LI Xiao-xi
(College of Light Industry and Food Sciences,South China University of Technology,Guangzhou 510640,China)
The antioxidant activity of volatile oil from Mei Pian tree(Cinnamomun burmannii physilogical type)was studied.The volatile oil was extracted by the methods of steam distillation.The antioxidant activity of volatile oil was evaluated by the methods of spectrophotometry,and the antioxidant activities were compared with BHT.The results showed that the activity of scavenging·OH radicals of volatile oil was stronger than BHT. The activity of scavenging DPPH·radicals and reduce power of volatile oil were weaker than BHT.And the antioxidant activity of volatile oil from Mei Pian tree mainly resulted from the high contents of total phenols and total flavonoids of volatile oil.Therefore,the volatile oil obtained from Mei Pian tree was proved to have strong antioxidant activity.
Mei Pian tree(Cinnamomun burmannii physilogical type);volatile oil;antioxidant activity;steam distillation
TS201.2
A
1002-0306(2012)05-0149-04
2011-03-22 *通讯联系人
陈建平(1986-),男,硕士研究生,研究方向:糖类物质及其药物制备与生物利用。
广东省自然科学基金博士启动项目(10451064101005160);广东省教育部科技部企业科技特派员行动计划专项项目(2009B090600055);省部产学研结合项目(2009A090100041,2010B090500033)。
