研磨法和组织分离器制备乳腺癌腋窝淋巴结单细胞悬液的比较
2012-11-14陈相彪杨伟明王春林贺新媛骆礼波
陈相彪,杨伟明,陆 婧,王春林,唐 聃,贺新媛,骆礼波,石 磊
(遵义医学院附属医院 甲状腺乳腺外科,贵州 遵义 563099)
·技术与方法·
研磨法和组织分离器制备乳腺癌腋窝淋巴结单细胞悬液的比较
陈相彪,杨伟明,陆 婧,王春林,唐 聃,贺新媛,骆礼波,石 磊
(遵义医学院附属医院 甲状腺乳腺外科,贵州 遵义 563099)
目的比较研磨法和Gentle MACS组织分离器制备乳腺癌患者腋窝淋巴结单细胞悬液在活细胞率、丝状物及细胞团块方面的优缺点,为淋巴组织细胞培养和流式分析找到一种更为可靠的方法。方法分别用研磨法和Gentle MACS组织分离器制备单细胞悬液,台盼兰染色后计数活细胞、死细胞、细胞团块和丝状物,并比较两种方法的优缺。结果两种方法制备的腋窝淋巴组织单细胞悬液在细胞存活率方面有显著性差异(P<0.05)。在丝状物和细胞团块方面,组织分离器法丝状物和细胞团块数量更少(P<0.05)。结论制备淋巴组织单细胞悬液,组织分离器法较研磨法更为优异。
乳腺癌;淋巴组织 ;单细胞悬液
乳腺疾病是妇女的常见病和多发病,研究表明:乳腺疾病的患病率高达38.94%【1】。乳腺癌是妇女常见恶性肿瘤。我国乳腺癌发病率一直高居不下。乳腺癌研究一直是医学界研究热点。乳腺癌淋巴转移一直是乳腺癌转移途径重要组成部分。研究乳腺癌淋巴转移常需要制备乳腺癌淋巴组织单细胞悬液。近年来,FCM越来越多应用于临床检测和科研实验【2】。乳腺癌腋窝淋巴组织单细胞悬液制备是研究乳腺癌先决条件。有关乳腺癌腋窝淋巴组织流式细胞术单细胞悬液的制备的研究显得尤为重要。
流式细胞术标本制备是FCM检测能否成功的关键环节。单细胞悬液制备有机械法、机械-化学法、机械-酶消化法、单细胞悬液制备仪【2】。机械法主要是利用研磨法、网搓法和剪碎法。由于乳腺癌腋窝淋巴组织自身的特点以及各种制备方法自身优缺点,研磨法对于较脆的组织(如脾脏)和淋巴结常会获得较满意的效果。近年来,组织分离器越来越多的应用于各种组织单细胞悬液的制备。本文就这一问题展开讨论,将研磨法和组织分离器制备单细胞悬液的方法做一比较,客观的研究两种方法的优缺点,探寻一种较为可靠的淋巴结单细胞悬液的制备方法。
1 材料与方法
1.1 主要实验材料 离心机、 OLMPUS显微、镜细胞滤网(70um筛孔) 、移液器(10μl)、24孔细胞培养板、离心管、载玻片、研磨器、Gentle MACS组织分离器及C管电子天平。
1.2 主要实验试剂 RPMI1640培养基、台盼兰染液、双蒸水、PBS。
1.3 实验方法
1.3.1 制备台盼兰染液 4%台盼蓝母液的配制:取4g台盼蓝,加少量蒸馏水进行研磨,加双蒸水至100 mL,用滤纸过滤,4℃保存,使用时用PBS稀释至0.4% 。
1.3.2 每份标本分为相同重量两份,随机分配到A组和B组。
1.3.3 A组,标本剪碎至2~4mm大小碎片,置入gentle MACS C管中,按比例加RPMI1640培养基。Gentle MACS组织分离器上按操作说明制备单细胞悬液。B组,眼科剪将组织剪成碎片,放入研磨器内,加入适量的PBS,缓慢转动研磨棒,研磨至匀浆,PBS冲洗研磨器,收集所得悬液。
1.3.4 滤网过滤,离心(1000rpm)10 min,弃上清,吹打混匀并配成10 mL液体。再次吹打混匀。
1.3.5 移液器取同量细胞放在24孔细胞培养板上台盼兰染色3~5 min。
1.3.6 OLMPUS显微镜观察细胞并拍照。镜下观察,死细胞被染成明显的蓝色,而活细胞拒染呈无色透明状。
1.3.7 计数细胞并统计细胞活力、细胞团块、丝状物数:活细胞率(%)= 活细胞总数/(活细胞总数+死细胞总数)×100%。
1.3.8 统计学方法 所有数据处理均采用(表1、表2、表3)SPSS17.0统计软件包进行。半定量资料两组间比较采用秩和检验,检验水准为α=0.05。
2 结果
2.1 1例乳腺癌腋窝淋巴节单细胞悬液计数结果(见图1,2)
①Gentle MACS组织分离器法制备结果:

注:活细胞数:60个,死细胞数:52个,丝状物:1个,细胞团块:0个,活细胞率:0.536(Trypan Blue ×200)。图1 Gentle MAcs组织分离法制备单细胞悬液镜下观察结果
② 研磨法制备结果:
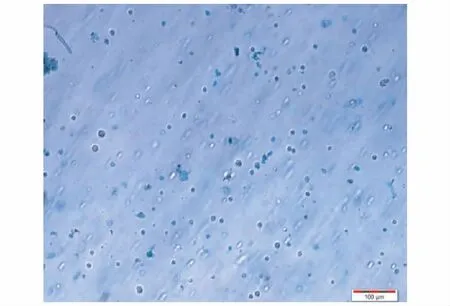
注:活细胞数:31个,死细胞数:123个,丝状物:3个,细胞团块:2个,活细胞率:0.201(Trypan Blue ×200)。图2 研磨法制备单细胞悬液镜下观察结果
2.2 两种方法制备单细胞悬液活细胞率、丝状物、细胞团块结果(见表1,2,3)
注:与研磨组相比P<0.05。

表2 两种方法制备单细胞悬液丝状物情况
注:与研磨组相比P<0.05。

表3 两种方法制备单细胞悬液细胞团块情况
注:与研磨组相比P<0.05。
3 讨论
单细胞悬液在许多方面具有广泛用途:如肿瘤病理、肿瘤分子生物学行为等【3】。肿瘤细胞原代培养、肿瘤药敏实验、肿瘤浸润性淋巴细胞分离也需要制备肿瘤组织的单细胞悬液【4】。实体组织单细胞悬液制备方法主要有机械法和酶消化法【6】。机械法主要是利用研磨法、网搓法和剪碎法。酶消化法常用的酶有:胰蛋白酶和胶原酶。胰蛋白酶对软组织消化效果较好,胶原酶适合消化含纤维成分较多的组织【4】。酶消化法受酶的种类、浓度、消化时间的影响对细胞的活性和细胞表面受体影响较大【5】。近年来,组织分离器越来越多的应用于各种组织单细胞悬液的制备。有研究表明:Medimachine系统可以在短时间内完成实体组织单细胞悬液的制备,样本可以完全达到流式检测的要求【7】。
流式细胞术越来越多应用于临床和科研。它作为一种可在单细胞水平上对大量细胞进行快速、准确、多参数定量分析和分选的高技术,在细胞生物学、免疫学、肿瘤学等方面的应用日趋广泛和深入【7】。对于实体组织而言,获得数量高、活性好、碎片少的单细胞悬液是进行流式分析的关键环节和前提。实体组织单细胞悬液制备,目前无通用方法【8】。需要针对不同组织或不同的实验目的选择合适的制备方法。对于淋巴组织而言,由于淋巴组织含胶原蛋白较少,无论用研磨法还是用组织分离器法,都可以获得足够数量单细胞。研磨法制备腋窝淋巴组织单细胞悬液,丝状物和细胞团块较多。利用离心、抽提、过滤等实验方法都难以将丝状物分离出去。比较而言,利用Gentle MACS组织分离器制备单细胞悬液有以下优点:①操作简单:只需将取到的新鲜组织标本剪碎后放置到C管里面,并按操作说明安放到组织分离器上面即可。②使标本的制备过程标准化,减少人为因素对实验过程影响。③制备单细胞悬液质量较高,活细胞率较高,丝状物和细胞团块的数量较少,便于后续细胞培养和流式分析。④单细胞悬液的制备过程在密闭的系统中进行,便于无菌操作,可以大大降低细胞的污染,为后续的细胞培养提供无菌保障。
然而,利用Gentle MACS组织分离器制备单细胞悬液也有其不足之处:该设备造价较高,普遍应用和推广会受到一定限制。
【1】 谭红辉,杨伟明,王超宇,等.汇川区5000例妇女乳腺疾病普查报告【J】.中国妇幼保健,2012,27(14):1310-1311.
【2】 张金梅,余小平,朱小爽,等.流式细胞术实体瘤组织标本制备的研究【J】.中国优生与遗传杂志,2000,8(6):31.
【3】 董敬朋,陈艺华,张素娟.新鲜肿瘤组织单细胞悬液的制备方法【J】.临床与实验病理学杂志,1995,11(4):280.
【4】 文小岗,金岩,张云汉,等.食管癌单细胞悬液制备方法比较【J】.河南医科大学学报,1997,32(3):70-71.
【5】 韩亚萍,刘源,李军,等.肝病患者的肝组织单细胞悬液与外周血淋巴细胞亚群的分析比较【J】.检验医学,2005,20(5):448-450.
【6】 张召辉,李玺,夏安周,等.移植胰腺组织单细胞悬液制备方法的比较【J】.2004,3(9):42-43.
【7】 李宾,周春喜.用Medimachine 系统制备实体组织的单细胞悬液【J】.临床与实验病理学杂志,1999,15(4):352-353.
【8】 夏安周,邢淑华,朱学文,等.肾组织单细胞悬液制备方法的比较【J】.徐州医学院学报,2004,24(1):49-50.
Comparisonofgrindingmethodandtissueseparatorinthepreparationforthesinglecellsuspensionsofbreastcanceraxillarylymphnodes
Chenxiangbiao,Yangweiming,Lujing,Wangchunlin,Tangdan,Hexinyuan,Luolibo,Shilei
(Department of Thyroid-breast surgery,the Affiliated Hospital of Zunyi Medical College,Guizhou Zunyi 563099,China)
ObjectiveTo compare the grinding method and Gentle MACS tissue separator in the preparation for the single cell suspensions of axillary lymph nodes in breast cancer and further find a more reliable method for cell culture and flow cytometric analysis of lymphoid tissues.MethodsThe single cell suspensions were prepared using the grinding method and Gentle MACS tissue separator.The numbers of living cells,dead cells,cell clumps and filaments were counted through trypan blue staining to further investigate the advantages and disadvantages of these two methods.ResultsNo significant difference of cell viability between grinding method and Gentle MACS tissue separator was shown.However,compared with the grinding method,fewer filaments and cell clumps were discerned via Gentle MACS tissue separator.ConclusionTissue separator might be better than grinding method in the preparation for lymph node single cell suspensions.
breast cancer;lymph node;single cell suspension
贵州省教育厅重点项目(NO:黔教科(2009)0110)。
杨伟明,男,教授,研究方向:甲状腺、乳腺和大肠肿瘤,E-mail:yangweiming2004@126.com。
R737.9
B
1000-2715(2012)05-0435-03
【收稿2012-06-12;修回2012-08-28】
(编辑:王福军)
