反相高效液相色谱法测定巴沙鱼中的黄体素和玉米黄质
2012-10-28杨发树张凤枰刘耀敏
赵 艳,杨发树,张凤枰,刘耀敏
(通威股份有限公司,四川 成都 610041)
反相高效液相色谱法测定巴沙鱼中的黄体素和玉米黄质
赵 艳,杨发树,张凤枰,刘耀敏
(通威股份有限公司,四川 成都 610041)
建立测定巴沙鱼(Pangasius bocouti)中黄体素和玉米黄质含量的反相高效液相色谱法,应用C30柱,以乙腈-甲醇-三乙胺(75:25:0.05,V/V)和甲基叔丁基醚-三乙胺(100:0.05,V/V)为流动相进行梯度洗脱,紫外检测器在450nm处进行检测,外标法定量。结果表明:黄体素和玉米黄质线性关系良好,相关系数均为0.9999,加标回收率分别为85.43%~96.60%和83.18%~96.18%,相对标准偏差分别为5.01%~7.15%和4.60%~8.43%,检出限分别为0.008mg/kg和0.003mg/kg。该方法灵敏度高、重现性好,适用于水产品中黄体素和玉米黄质含量的检测。关键词:反相高效液相色谱法;黄体素;玉米黄质;巴沙鱼
类胡萝卜素是胡萝卜素和叶黄素两大类色素的总称,为一类脂溶性化合物,水产动物呈色主要是由叶黄素类色素决定,包括黄体素、玉米黄质、角黄素、虾青素等[1]。类胡萝卜素在水产动物中的主要生理功能包括:着色、抗紫外辐射的光保护作用、作为VA的前体物质、增强对高氨和低氧的耐受性、抗氧化剂和脂质过氧化的抑制剂等。研究表明,黄体素和玉米黄质具有区别于其他类胡萝卜素的特殊作用,在保护视力[3-4]、预防心血管疾病[5]和癌症[6]以及增强免疫力[2,5]方面具有独特的生理功能。因此,二者被认为是重要的营养物质。目前对水产动物中叶黄素类色素含量多采用分光光度法[7-9]、薄层色谱法[10]进行分析,存在着操作过程复杂、灵敏度和准确性差等问题,而高效液相色谱法则以其快速、简便、灵敏、准确等优点,逐步被广泛应用于类胡萝卜素的分析中[11-13]。本实验采用高效液相色谱法对巴沙鱼中的黄体素和玉米黄质进行了分离检测,旨在建立水产品中叶黄素类色素的测定方法,为水产动物呈色原因提供数据支持。
1 材料与方法
1.1 材料、试剂与仪器
不同饲料喂养的巴沙鱼,取巴沙鱼背部肌肉测定,送检样品。
Alliance 2695高效液相色谱仪(2487紫外检测器,ENPOWER色谱管理系统) 美国Waters公司;MTN-2800氮吹仪 天津奥特赛恩斯公司;T10 均质器 德国IKA 公司; R-210旋转蒸发仪 瑞士B..chi公司;KQ5200B型超声波清洗器 昆山市超声仪器有限公司;CP224S 电子分析天平 德国Sartorius公司。
黄体素(95.8%)、玉米黄质(99.8%) 美国Sigma公司;乙腈、甲醇、甲基叔丁基醚(色谱纯) 美国Fisher公司;三乙胺、石油醚(沸程30~60℃)、无水乙醇、无水硫酸钠、氢氧化钾、2,6-二叔丁基对甲酚(BHT)、抗坏血酸(均为分析纯) 国药集团化学试剂公司;水为Milli-Q Gradient超纯水。
1.2 标准溶液和提取溶液的配制
黄体素和玉米黄质标准储备液:用少量丙酮溶解,再用甲醇为溶剂配成质量浓度分别为100μg/mL和40μg/mL标准品储备液。可根据需要稀释成系列标准溶液。
抗坏血酸乙醇溶液5g/L:取0.5g抗坏血酸结晶纯品溶解于少量蒸馏水中,用乙醇稀释至100mL,临用前配制。
1.3 HPLC分析条件
色谱柱:Ultimate XB-C30色谱柱(250mm×4.6mm,5μm);流速:1.0mL/min;柱温:25℃;检测器:紫外检测器,波长为450nm;进样体积:20μL。流动相A:乙腈-甲醇-三乙胺(75:25:0.05,V/V),流动相B:甲基叔丁基醚-三乙胺(100:0.05,V/V);梯度洗脱条件见表1。

表1 梯度洗脱条件Table 1 Gradient elution conditions
1.4 供试样品溶液的制备
1.4.1 皂化
样品用绞肉机绞碎后称取5g,准确至0.0001g,置于250mL圆底烧瓶中,加50mL抗坏血酸乙醇溶液,用均质器均质使试样完全分散,通入氮气,加10mL 500g/L氢氧化钾溶液,混合均匀,置于60℃水浴回流40min,不时振荡防止试样粘附在瓶壁上,皂化结束,分别用5mL乙醇,5mL水自冷凝管顶端冲洗其内部,取出烧瓶冷却至约40℃。
1.4.2 提取
定量转移全部皂化液于盛有60mL石油醚的500mL分液漏斗中,用30~50mL蒸馏水分2~3次冲洗圆底烧瓶并入分液漏斗,激烈振荡2min、放气,随后混合、静置分层。转移水相于第2个分液漏斗中,分次用40mL石油醚重复提取两次,弃去水相,合并3次石油醚相。每次用60mL蒸馏水洗涤石油醚提取液2~3次至中性,初次水洗时轻轻旋摇,防止乳化。石油醚提取液通过无水硫酸钠脱水,后转移到250mL鸡心瓶中,加100mg BHT使之溶解。以上操作均在避光通风柜内进行。
1.4.3 浓缩
将石油醚提取液置于旋转蒸发仪上,在部分真空、水浴温度40℃条件蒸发干。残渣用2mL甲醇溶解,0.22μm滤膜过滤,待高效液相色谱仪测定。
2 结果与分析
2.1 样品前处理条件的选择
本研究采用皂化提取方法,固定皂化时间30min,考察不同皂化温度(30、50、60、80℃和100℃)对黄体素和玉米黄质含量测定结果的影响(图1);固定皂化温度为60℃,考察不同皂化时间(10、20、30、40min和60min)对其测定结果的影响(图2)。
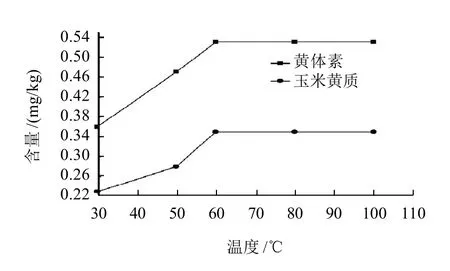
图1 不同皂化温度黄体素和玉米黄质的含量变化曲线Fig.1 Change curves of measured lutein and zeaxanthin contents with saponification temperature
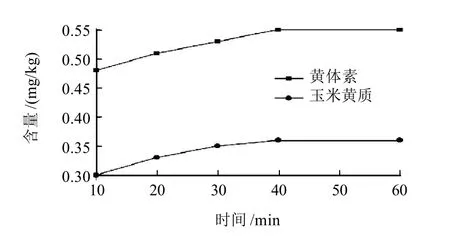
图2 不同皂化时间黄体素和玉米黄质的含量变化曲线Fig.2 Change curves of measured lutein and zeaxanthin with saponification time
由图1可知,随着温度升高,叶黄素和玉米黄质的含量逐渐升高,但当温度高于60℃时,黄体素和玉米黄质含量变化不大,而温度较高时乙醇容易挥发并且测定结果的重复性较差,可确定最佳反应温度为60℃。由图2可知,随着皂化时间的延长,黄体素和玉米黄质含量逐渐升高,但在40min后黄体素和玉米黄质含量变化不是非常明显,可确定最佳皂化时间为40min。
2.2 高效液相色谱分析条件的选择
2.2.1 色谱柱的选择
黄体素和玉米黄质互为同分异构体,化学结构极为相似,仅有1个末端基团中的共轭烯炔键的位置不同,黄体素为β,ε-胡萝卜素-3,3-二醇,而玉米黄质为β, β-胡萝卜素-3,3-二醇。由于二者在分子质量、化学结构和功能上的相似性,通常很难将二者分离开。本实验采用Waters 2695高效液相色谱仪,比较C18柱、串联两根C18柱和C30柱对黄体素和玉米黄质的分离效果,发现C18柱、串联两根C18柱都不能很好的分离两者,而用使用分离类胡萝卜素专一性的C30柱取得了良好的分离效果。
2.2.2 流动相的选择
用乙腈或甲醇作为流动相,不能有效分离黄体素和玉米黄质,而用乙腈-甲醇-甲基叔丁基醚作为流动相则峰拖尾,加入0.05%的三乙胺峰形得到改善,本实验在所选择的条件下,标准品和样品的分离效果分别见图3~5。
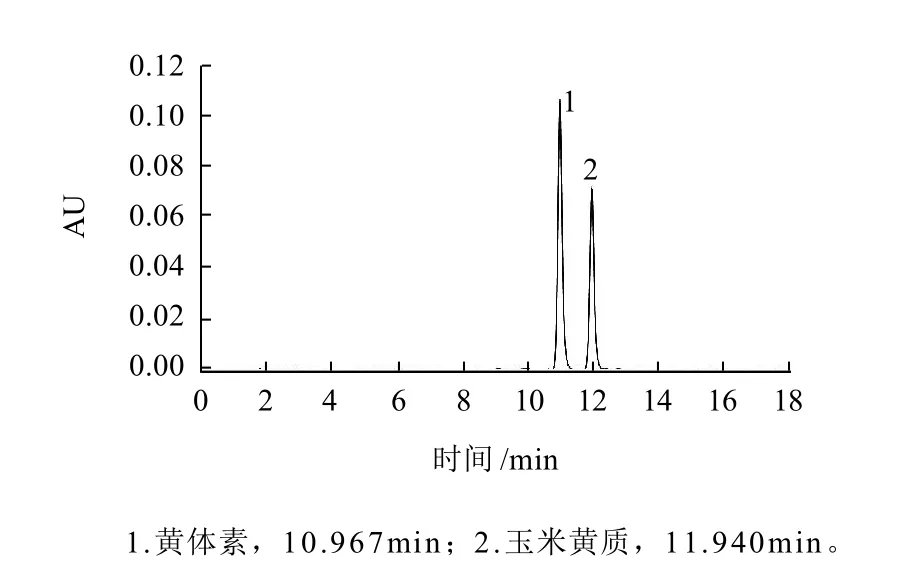
图3 黄体素和玉米黄质标准品的色谱图Fig.3 HPLC chromatogram of mixed lutein and zeaxanthin standards
图4 空白样品的色谱图Fig.4 HPLC chromatogram of blank sample

图5 巴沙鱼样中黄体素和玉米黄质色谱图Fig.5 HPLC chromatogram of lutein and zeaxanthin in Pangasius bocouti
2.3 线性关系及检出限的考察
取黄体素标准品配制成0.04、0.2、1、4、10、20μg/mL的系列标准溶液;玉米黄质系列标准溶液为0.02、0.1、0.5、2、5、10μg/mL。按照上述色谱条件进样,以峰面积对质量浓度绘制标准曲线。以3倍信噪比计算检出限,以10倍信噪比计算定量限。线性方程、检出限和定量限见表2。

表2 黄体素和玉米黄质的回归方程、检出限和定量限Table 2 Linear regression equations, LODs and LOQs of lutein and zeaxanthin
2.4 方法的精密度、稳定性和回收率实验
取6份同样的实际样品按照1.4节供试品溶液制备方法进行处理,按照1.3节仪器条件进行测定,黄体素和玉米黄质的色谱峰的保留时间RSD分别为0.04%和0.06%,峰面积RSD分别为2.88%和2.71%,说明本方法精密度良好。
取黄体素(4g/mL)和玉米黄质(2g/mL)标准工作溶液,在室温下避光放置1、6、24、48、72h后进样,黄体素和玉米黄质的峰面积的日间RSD分别为4.17%和3.43%。表明72h内黄体素和玉米黄质的稳定性较好,但为保证测定结果的准确性,样品制备后应立即上机测定。
为了研究方法的可靠性,分别添加3个浓度水平的标准溶液,每水平6个平行样,按照1.4节供试品溶液制备方法进行处理,按照1.3节条件进行测定,平均回收率结果见表3。结果显示,黄体素和玉米黄质的加标回收率分别为85.43%~96.60%和83.18%~96.18%,RSD分别为5.01%~7.15%和4.60%~8.43%,符合实验要求。
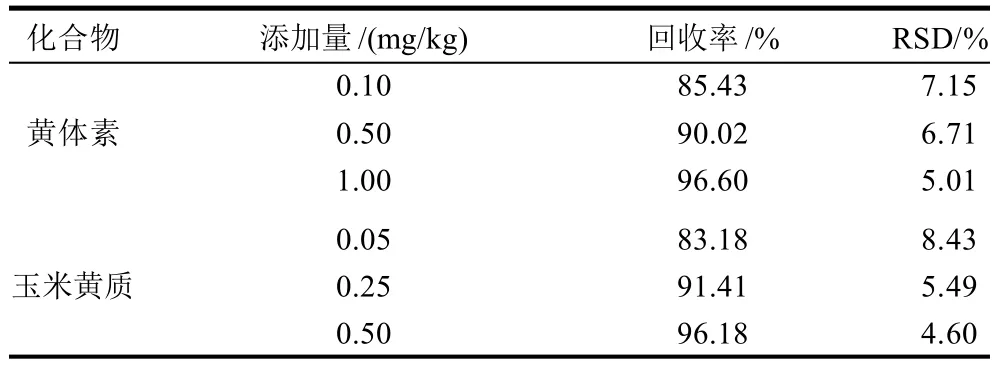
表3 黄体素和玉米黄质的回收率和测定的相对标准偏差(n=6)Table 3 Spike recovery rates of lutein and zeaxanthin and relative standard deviations of six replicate determinations (n=6)
2.5 巴沙鱼样品的测定
按照上述方法对巴沙鱼实际样品进行定性与定量测定,测定结果见表4。
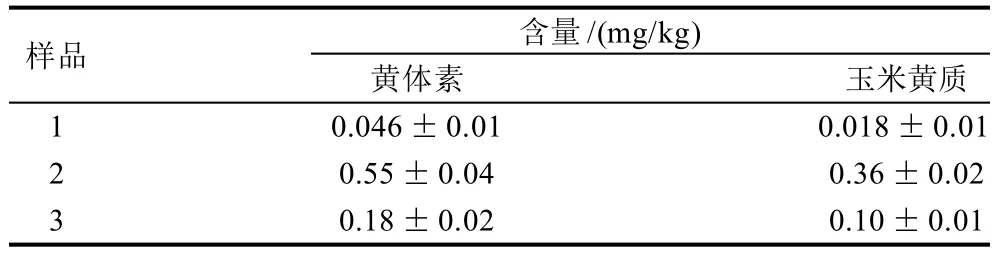
表4 样品的定量分析结果(n=3)Table 4 Lutein and zeaxanthin contents in Pangasius bocouti determined by this method (n=3)
3 结 论
本实验通过对皂化时间、皂化温度等前处理条件和色谱条件的优化,采用高效液相色谱法测定巴沙鱼中黄体素和玉米黄质的含量。结果表明,方法灵敏度高、分离效果良好,为水产品中黄体素和玉米黄质的测定提供了一种可靠的参考方法。
[1] 冷向军, 李小勤. 水产动物着色的研究进展[J]. 水产学报, 2006, 30 (1): 138-143.
[2] CHEW B P, PARK J S. Carotenoid action on the immune response[J]. J Nutr, 2004, 134(1): 257-261.
[3] KRINSKY N I, LANDRUM J T, BONE R A. Biologic mechanisms of the protective role of lutein and zeaxanthin in the eye[J]. Annu Rev Nutr, 2003, 23: 171-201.
[4] KRINSKY N I. Possible biologic mechanisms for a protective role of xanthophylls[J]. J Nutr, 2002, 132(3): 540-542.
[5] MARES-PERLMAN J A, MILLEN A E, FICEK T L, et a1. The body of evidence to support a protective role for lutein and zeaxanthin in delaying chronic diseases[J]. J Nutr, 2002, 132(3): 518S-524S.
[6] TABUNOKI H, SUGIYAMA H, TANAKA Y, et a1. Isolation, characterization, and cDNA sequence of a carotenoid binding protein from the silk gland of Bombyx mori larvae[J]. J Biol Chem, 2002, 277 (35): 32133-32140.
[7] CHEN H M, MEYERS S P, HARDY R W, et a1. Color stability of astaxanthin pigmented rainbow trout under various packaging conditions [J]. J Food Sci, 1984, 49(5): 1337-1340.
[8] FOSS P, STOREBAKKEN T, SCHIEDT K, et a1. Carotenoids in diets for salmonids. Ⅰ. Pigmentation of rainbow trout with the individual optical isomers of astaxanthin in comparison with canthaxanthin [J]. Aquac, 1984, 41(3): 213-226.
[9] TORRISSEN O J, NAEVDAL G. Pigmentation of salmonids-genetical variation in carotentoid deposition in rainbow trout[J]. Aquac, 1984, 38 (1): 59-66.
[10] CHRISTOPHERSEN A G, KNUTHSEN P, SKIBSTED L H. Determination of carotentoids in Salmonids[J]. Z Lebensm Unters Forsch, 1989, 188(5): 413-418.
[11] TORRISSEN O J. Pigmentation of salmonids- a comparison of astaxanthin and canthaxanthin as pigment sources for rainbow trout[J]. Aquac, 1986, 53(3/4): 271-278.
[12] SIGURGISLADOTTIR S, PARRISH C C, LALL S P, et a1. Effects of feeding natural tocopherols and astaxanthin on Atlantic salmon (Salmo salar) fillet quality[J]. Food Res Int, 1994, 27(1): 23-32.
[13] ANDERSEN H J, BERTELSEN G, CHRISTOPHERSEN A G, et a1. Development of rancidity in salmonoid steaks during retail display. A comparison ofpractical storage life of wild salmon and farmed rainbow trout[J]. Z Lebensm Unters Forsch, 1990, 191(2): 119-122.
Determination of Lutein and Zeaxanthin in Pangasius bocouti by Reversed-Phase High Performance Liquid Chromatography
ZHAO Yan,YANG Fa-shu,ZHANG Feng-ping,LIU Yao-min
(Tongwei Co. Ltd., Chengdu 610041, China)
A high performance liquid chromatography method was established for the determination of 1utein and zeaxanthin in Pangasius bocouti. The chromatographic separation was achieved on a C30 column using a mobile phase made up of acetonitrile, methanol and spasmolytol (75:25:0.05, V/V) by gradient elution. The detection wavelength was set at 450 nm, and an external standard method was used to quantify 1utein and zeaxanthin. An excellent linear relationship of this method for 1utein and zeaxanthin was observed (R2>0.999). The average spike recovery rates of 1utein and zeaxanthin were 85.43%-96.60% and 83.18%-96.18% with relative standard deviations of 5.01%-7.15% and 4.60%-8.43%. The limit of detection was 0.008 mg/kg for 1utein and 0.003 mg/kg for zeaxanthin. This method was sensitive, repeatable, and suitable for the determination of 1utein and zeaxanthin aquatic products.
reversed-phase high performance liquid chromatography;lutein;zeaxanthin;Pangasius bocouti
TS207.3
A
1002-6630(2012)16-0225-04
2011-07-14
赵艳(1983—),女,工程师,硕士,研究方向为水产品营养评价和食品及饲料产品质量安全检测。E-mail:zhao518yan@126.com
