日本七鳃鳗pcna基因克隆、生物信息学分析及真核表达
2012-09-18龚兴旺黄金莎李庆伟
逄 越,龚兴旺,黄金莎,李庆伟,*
(1. 大连大学 生命科学与技术学院,辽宁 大连 116622;2. 辽宁师范大学 生命科学学院, 辽宁 大连 116029)
日本七鳃鳗(Lampetra japonica)是现存最古老的脊椎动物代表。由于七鳃鳗是联系无脊椎动物与脊椎动物之间的重要阶元,因此在遗传信息方面,它必定印记了无脊椎动物的进化历史,同时作为脊椎动物最直接的祖先,又为脊椎动物的起源与进化提供丰富的遗传信息[1-3]。增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)是一种相对分子质量为36KD的酸性蛋白,已经证实它的表达是同细胞周期中S期的细胞增殖状态相关联,直接参与 DNA的合成和复制,是反映细胞增殖状态的特异性核抗原[4.5]。1987年 Bravo等[6]指出PCNA是DNA多聚酶δ的辅助蛋白,DNA合成必不可少的因子,PCNA在细胞核内合成,并存在于细胞核内。PCNA在细胞周期的不同阶段表达有所不同,在G0~G1期细胞中无明显表达,G1晚期,其表达大幅度增加,S期达到高峰,G2~M期明显下降,其量的变化与DNA合成一致。因而检测其在细胞中的表达,可作为评价细胞增殖状态的一个指标[7-9]。本研究首次获得七鳃鳗pcna基因并对其进行生物信息学分析。除此之外,建立七鳃鳗PCNA与绿色荧光蛋白融合基因表达载体并成功表达融合蛋白。七鳃鳗pcna基因真核表达载体的成功构建及表达为pcna基因在七鳃鳗中生物学功能研究奠定基础,也为七鳃鳗细胞株建立提供材料。
1 材料和方法
1.1 材料
实验材料:日本七鳃鳗2011年12月末采自黑龙江省松花江流域同江地区。选取健康、体表完整的个体,经过 7d培养观察,证实无病后用于实验。
菌株与质粒:质粒PGFP-N2、大肠杆菌DH5α菌株、Hela细胞系为本实验室保存。
主要试剂:限制性核酸内切酶HindⅢ和BamHⅠ、T4DNA连接酶、pMD19-T Simple Vector、PrimeScript RT-PCR Kit、PrimeSTAR HS DNA聚合酶、琼脂糖凝胶DNA纯化试剂盒(Agarose GeI DNA Purification Kit)、质粒小量提取试剂盒和DL2000、DL5000DNA 和 λ-HindⅢdigest DNA Marker均购自大连TaKaRa公司;Trizol试剂购自Invitrogen公司;Xfect Transfection Reagent购自Clontech公司;DMEM高糖、FBS、DPBS、卡那霉素、Typan blue购自于 Hyclone公司;Sodium Pyruvate购自 Invitrogen公司;Trypsin-EDTA Solution购自Sigma公司。
1.2 方法
1.2.1 功能基因的EST比对及序列进化分析
从本实验前期构建的七鳃鳗肝脏cDNA文库(2.1×106pfu/mL)中随机挑选cDNA单克隆进行表达序列标签(EST)测序,建立EST数据库(约10077条EST序列)[10]。将EST序列在NCBI蛋白质数据库(SwissProt, GenBank, PDB)中进行BLAST比对发现一条与高等脊椎动物 pcna基因同源的序列。利用CLUSTAL X软件(version 1.81)将七鳃鳗PCNA氨基酸序列同其它不同物种的氨基酸序列进行比对,并用MEGA(version 4.0)软件做进化树分析。
1.2.2 总RNA的提取和cDNA的合成
取 50~100 mg七鳃鳗肝脏组织按照 Trizol试剂盒说明书提取总RNA,置于-80℃冰箱保存。逆转录反应按照PrimeScript RT-PCR Kit(Code No:DRR014S)说明书操作进行,以适量总RNA为模板,以Oligo(dT)为引物,逆转录反应体系于30℃温育10 min;42℃温预30 min;95℃温育5 min。最终获得cDNA第一链。
1.2.3 Lj-pcna基因片段扩增
参考七鳃鳗肝脏cDNA文库中的EST序列,利用Primer Premier 5.0软件设计如下引物,P1F:5'-ACACACGACAAACGCACTCGCCAA-3',P1R:5'-TTATGCAGCCTCTTCATCCTC-3'。以含有pcna全长基因的日本七鳃鳗第一链cDNA为模板,使用 PrimeSTAR HS DNA聚合酶(Code No:DR010S)扩增Lj-pcna基因。反应条件:94℃变性30 s,55℃退火30 s,72℃延伸1 min,循环35次;最后72℃延伸10 min。取出PCR产物10 mg/L琼脂糖凝胶电泳检测,凝胶成像分析系统记录检测结果。
1.2.4 Lj-pcna基因克隆
使用TaKaRa Agarose Gel DNA Purification Kit Ver.2.0(Code No:DV805A)切胶回收PCR产物。将目的片段 Lj-pcna与 pMD19-T Simple Vector(Code No:D104A)连接,并导入大肠埃希菌 DH5α感受态菌中,提取重组质粒 T-Lj-pcna送到大连宝生物工程有限公司进行测序及序列分析。
1.2.5 真核表达载体的构建
以T-Lj-pcna重组质粒为模板,根据1.2.4所测序列设计如下引物,P2F:5'-CCCAAGCTT ATGTTCGAGGCACGCATCCT G-3',P2R:5'-CGCGGATCCTGCAGCCTCTTCATC CTCAAT-3'。在上下游引物序列中分别添加了HindⅢ和BamHⅠ酶切位点(下划线部分)。PCR扩增步骤如1.2.3所示。回收的PCR产物和真核表达载体分别用HindⅢ和BamHⅠ进行双酶切,酶切的Lj-pcna基因片段和质粒PGFP-N2片段通过T4DNA连接酶16℃连接过夜,转化到大肠埃希菌 DH5a感受态中,在含有 kanar抗生素(20 ug/mL)的LB固体培养基上筛选确认阳性克隆菌。挑取阳性克隆菌落进行扩大培养,进而提取PGFP-N2-Lj-pcna重组质粒,送至宝生物工程有限公司进行测序及序列分析。
1.2.6 重组质粒pGFP-N2-Lj-pcna转染Hela细胞
用高糖 DMEM(含10% FBS)培养基培养HeLa 细胞,转染前24 h,选择生长状态良好、细胞密度约70%的细胞接种12-well plate,去掉细胞培养皿中的培养液,使用5 mL DPBS清洗,去掉培养基后添加 1 mL Trypsin-EDTA Solution,37℃放置,待细胞完全消化;再添加 9mL新鲜培养基混匀细胞,添加Typan blue计数,调整细胞浓度为2×105cells/mL,0.5 mL/well 在12-well plate中接种细胞;37 5% CO2℃ 条件下培养24 h;24 h后,观察细胞生长状态良好,细胞密度约70%,按照转染试剂说明书进行转染实验:使用Xfect Transfection Reagent (Clontech cat#631317),准备2个1.5 mL tube,分别命名为Polymer和DNA,按如下方法添加试剂:DNA tube: 5uL PGFP-N2-Lj-pcna Plasmid (500 ng/uL) + 45 uL Xfect Reaction Buffer Polymer tube: 0.75 uL Xfect Polymer + 49.25 uL Xfect Reaction Buffer 分别震荡混匀,之后将 Polymer tube的混合液添加到DNA tube中,中速震荡混匀10 s,混合液室温下放置15 min,之后将100 uL的混合液全量添加到细胞孔中,100 uL/well,前后左右摇荡 12-well plate混匀,37℃放置培养4 h后,细胞孔中使用1mL 新鲜培养基换液,继续 37℃培养24 h后在荧光显微镜下观察荧光表达情况。
2 结果
2.1 Lj-pcna片段扩增结果
从日本七鳃鳗肝脏组织中获得 pcna基因,PCR产物经 10 mg/L琼脂糖凝胶电泳,在大约800bp处可见特异性扩增条带,见图1。
2.2 七鳃鳗PCNA生物信息学分析
通过NCBI网站ORF搜索软件分析Lj-pcna cDNA序列786bp,编码261个氨基酸,蛋白分子量为28713Da,见图2所示。在NCBI数据库中获得多个物种的PCNA氨基酸序列,构建进化树(如图3),结果显示,日本七鳃鳗PCNA基因位于脊椎动物PCNA基因的外群,且处于节肢动物门、尾索动物亚门及脊椎动物亚门之间,符合物种进化规律。
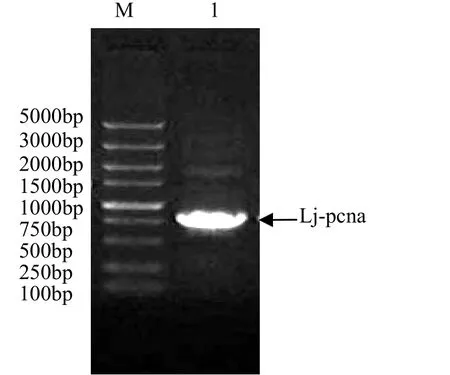
图1 Lj-pcna目的基因

图2 日本七鳃鳗 pcna的 ORF区及其编码的氨基酸序列

图3 PCNA系统发育树
2.3 构建pGFP-N2-Lj-pcna真核表达载体
将带酶切位点的 Lj-pcna目的片段和pGFP-N2质粒均用HindⅢ和BamHⅠ双酶切,切胶回收后分别用10 mg/L的琼脂糖凝胶鉴定,见图 4。用 T4连接酶将切胶回收后的目的片段Lj-pcna与 pGFP-N2载体连接,转化,提取pGFP-N2-Lj-pcna重组质粒。
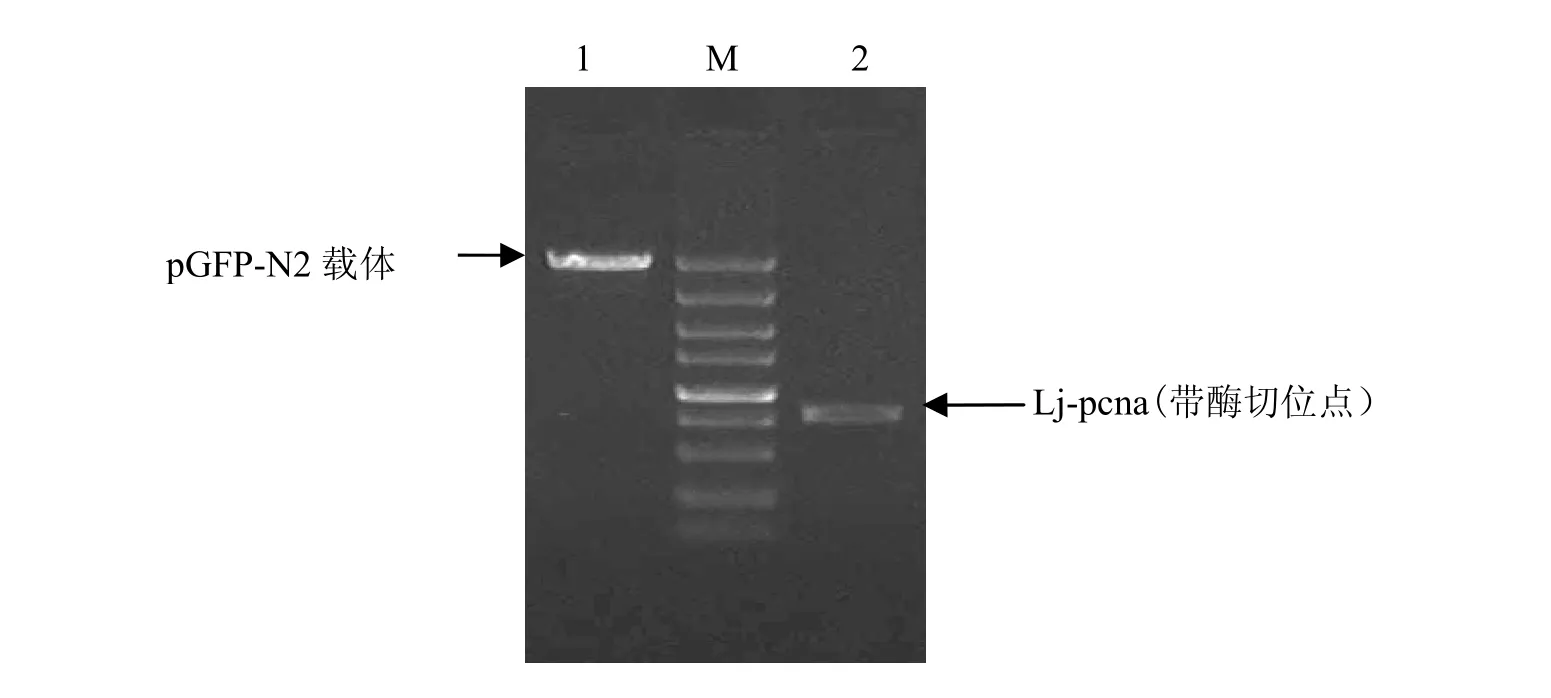
图4 pGFP-N2载体及Lj-pcna酶切片段回收
2.4 真核表达载体鉴定
pGFP-N2-Lj-pcna重组质粒经HindⅢ和BamHⅠ双酶切及PCR扩增均得到约780bp的目的片段,见图5,测序结果显示插入载体中的pcna核苷酸序列没有发生突变,与cDNA文库中EST序列完全一致,说明成功将 pcna基因构建到pGFP-N2真核表达载体中。

图5 真核表达载体pGFP-N2-Lj-pcna鉴定
2.5 pGFP-N2-Lj-pcna在Hela细胞中表达
在12-well plate 中接种 Hela 细胞,细胞接种后 24 h,使用 Xfect Transfection Reagent将pGFP-N2-Lj-pcna质粒转染到Hela细胞中,细胞转染24 h后,荧光显微镜下观察有绿色荧光蛋白表达,见图6。

图6 融合蛋白(七鳃鳗PCNA和绿色荧光蛋白)在Hela细胞中表达(×100)
3 讨论
pcna又称为周期蛋白(Cyclin),是DNA多聚酶 δ 的一种辅助因子。静止细胞含量很少,G1晚期开始增多,S期达到高峰,G2期、M期下降,其量的变化与DNA合成一致,肿瘤细胞增殖越活跃,pcna表达越高,是评价细胞增殖状态的重要指标[11-14]。七鳃鳗是现存最原始的无颌类脊椎动物,它印记了无脊椎动物的进化历史,同时作为脊椎动物最直接的祖先,又为脊椎动物的起源与进化提供了丰富的遗传信息。七鳃鳗作为脊椎动物发育早期和原始特征的模型,是研究哺乳动物基因起源和进化十分难得的实验材料。前期研究发现,体外培养的七鳃鳗细胞分裂缓慢,细胞生长周期长,不利于体外七鳃鳗组织细胞的原代培养,更难以建立七鳃鳗细胞系[15]。因此促使我们从cDNA文库的EST序列中寻找促进细胞生长的一些周期蛋白,其中pcna基因就是一个重要的细胞周期蛋白。目前,还没有关于七鳃鳗pcna基因序列与功能的相关报道。本课题组首次从日本七鳃鳗肝脏组织中克隆了与高等脊椎动物 pcna同源的cDNA序列。NCBI数据库的BLAST搜索分析表明,七鳃鳗 pcna的核苷酸及推导的氨基酸序列和其他物种的 pcna有很高的同源性。从进化树结果分析,Lj-pcna位于高等脊椎动物pcna基因的外群。因此可通过对日本七鳃鳗(现存最古老的脊椎动物)pcna基因的研究,从而确定七鳃鳗与其它物种的进化地位及联系。
目前用于表达外源性基因的真核表达载体主要分为病毒载体和非病毒载体两大类。一般而言,病毒载体相对表达稳定,转染效率高,不过易随机整合到靶细胞的染色体上,故难以控制且安全性差。非病毒载体主要是质粒载体,质粒载体被转染试剂转染入靶细胞后,独立存在于靶细胞中,对靶细胞自身伤害小,安全性较好,因此本实验采用质粒载体作为目的基因的携带者,将目的基因转入靶细胞中。近几年来,报告基因已普遍应用在细胞生物学和分子生物学等研究领域[16],现有报告基因种类很多,如半乳糖苷酶(LacZ)、葡萄糖苷酸酶(GUS)、萤火虫荧光素酶(LUC)等,此外,绿色荧光蛋白(Green Fluorescent Protein,GFP)是一类较理想的报告基因,其在基础研究领域及临床检测中都发挥着重要作用,将带有GFP报告基因的载体转入靶细胞后,可以很方便地观察目的蛋白的定位及确定目的蛋白在细胞或体内的表达情况,并且在动物实验中通过荧光显微镜可以对表达 GFP的细胞进行定位观察。目前科研领域应用最广泛的是将GFP同目的蛋白形成融合蛋白,通过GFP荧光显示位置从而监测目的蛋白的定位[17],由于GFP作为报告基因具有方便、及时、直观、应用广泛等特点,因而在基因表达、基因整合、细胞分选及转基因动物研究领域的应用是其它报告基因所无法取代的[18.19]。因此本实验采用分子克隆技术,将七鳃鳗pcna基因构建到pGFP-N2真核表达载体上,经限制性酶切,PCR扩增及DNA测序等证明载体构建成功。另外应用一种新型的转染试剂——Xfect,一种用于胚胎干细胞的转染试剂对重组质粒进行转染。Xfect转染试剂兼容性很好,无论质粒质量好坏,也无论质粒是环状还是线性,均能获得较高的转染效率。本实验结果表明pcna蛋白与绿色荧光蛋白以融合蛋白形式表达在Hela细胞内,且表达效率较高。
本研究成功将七鳃鳗 pcna基因构建到真核表达载体 pGFP-N2上,并在 Hela细胞中成功地表达了PCNA和GFP融合蛋白,说明我们构建的针对 pcna的真核表达载体是正确有效的,为后续研究 pcna基因在七鳃鳗中功能研究以及同其它基因之间的相互关系提供实验工具,并为今后能够建立稳定的七鳃鳗细胞株奠定实验基础。
[1]HERRIN B R, COOPER M D. Alternative adaptive immunity in jawless vertebrates [J]. J Immunol, 2010,185(3): 1367-1374.
[2]GUO P, HIRANO M, HERRIN B R, et al. Dual nature of the adaptive immune system in lampreys[J]. Nature,2009, 459(7248): 796-801.
[3]YUE Pang, RONG Xiao, XIN Liu, et al. Identification and characterization of the lamprey high-mobility group box 1 gene[J]. Plos one, 2012, 7(4): e35755.
[4]MAGA G, HUBSCHER U. Proliferating cell nuclear antigen (PCNA): a dancer with many partners[J]. J Cell Sci, 2003, 116(15): 3051-3060.
[5]OSADA S, SAJI S, KUNO T. Clinical significance of combination study of apoptotic factors and proliferating cell nuclear antigen in estimating the prognosis of hepatocellular carcinoma [J]. J Surg Oncol, 2004, 85(1):48-54.
[6]BRAVO R, FRANK R, BLUNDELL P A,Macdonald-Bravo H. Cyclin/PCNA is the auxiliary protein of DNA polymerase delta[J]. Nature, 1987,326(6112):515-517.
[7]STENNER M, DEMGENSKY A, MOLLS C, et al.Prognostic value of proliferating cell nuclear antigen in parotid gland cancer [J]. Eur Arch Otorhinolaryngol,2012, 269(4): 1225-1232.
[8]ACHARYA N, KLASSEN R, JOHNSON R E, et al.PCNA binding domains in all three subunits of yeast DNA polymerase δ modulate its function in DNA replication[J]. Proc Natl Acad Sci USA, 2011,8(44):17927-17932.
[9]STRZALKA W, ZIEMIENOWICZ A. Proliferating cell nuclear antigen(PCNA):a key factor in DNA replication and cell cycle regulation[J]. Ann Bot, 2011, 107(7):1127-1140.
[10]朱丽娜, 戴雅丽, 马飞, 等. 日本七鳃鳗(Lampetra japonica)肝脏 ESTs分析与比较转录组研究[J]. 中国科学C辑:生命科学, 2007(6): 609-619.
[11]ZHAO H, LO YH, MA L, et al. Targeting tyrosine phosphorylation of PCNA inhibits prostate cancer growth[J]. Mol Cancer Ther, 2011, 10(1):29-36.
[12]CHEN J, AI Y, WANG J, et al. Chemically ubiquitylated PCNA as a probe for eukaryotic translesion DNA synthesis[J]. Nature Chemical Biology,2010, 6(4): 270-272.
[13]MAYANAGIA K,KIYONARIC S, SAITOD M, et al.Mechanism of replication machinery as sembly as revealed by the DNA ligase-PCNA-DNA complex architecture[J]. PNAS, 2009, 106(12): 4647-4652.
[14]ROSENTAL B, HADAD U, BRUSILOVSKY M, et al.A novel mechanism for cancer cells to evade immune attack by NK cells: The interaction between NKp44 and proliferating cell nuclear antigen [J]. Oncoimmunology,2012, 1(4): 572-574.
[15]逄越, 李庆伟. 日本七鳃鳗外周血细胞显微结构及类淋巴细胞体外培养[J]. 海洋科学, 2012, 36(1):23-29.
[16]张峰, 任燕, 陆长得. 绿色荧光蛋白及其应用[J]. 生命科学, 1999, 11(2): 61-65.
[17]MARX J C, ALLAY J A, PERSONS D A, et al. High efficiency transduction and long-term gene ex pr ession with a murine stem cell retroviral vector encoding the green fluorescent protein in human marrow stromal cells [J]. Hum Gene Ther, 1999, 10(7): 1163-1173.
[18]OHMIYA N, EMI N, NIWA Y, et al. Insulin-enhanced liposome-mediated gene transfer into a gastric carcinoma cell line [J]. Clin Exp Pharmacol Physiol,2002, 29(7): 544- 548.
[19]PERSONS D A, ALLAY J A, ALLAY E R, et al.Retroviral mediated transfer of the green fluorescent protein gene into murine hematopoietic cells facilitates scoring and selection of transduced progenitors in vitro and identification of genetically modified cells in vivo[J]. Blood, 1997, 90(5): 1777-86.
