超临界逆向蒸发法制备葡萄糖脂质体实验及性能表征
2012-09-18陈淑花詹世平
陈淑花,詹世平,张 晶,陈 理
(大连大学 环境与化学工程学院, 辽宁 大连 116622)
脂质体是指将药物包封于类脂质双分子层内而形成的球状载体制剂,其结构多为一层或多层同心脂质双分子层,外层由磷脂双分子层包覆,内部为水相内核,具有类细胞膜结构与功能。其水相内核可以携带亲水性药物,双分子层结构可携带亲脂类药物,因而是一种非常有发展潜力的药物传递系统媒介[1-3]。脂质体制备方法主要有逆向蒸发法、冷冻干燥法、pH梯度法、Bangham法等[4-6]。这些制备方法对脂溶性药物包覆率效果较好,而对水溶性药物包覆效果还不理想。在临床药品中,水溶性药物占有很大的比例,因此提高脂质体对于水溶性药物的包覆效果成为目前亟待解决的问题。
超临界流体逆向蒸发是近年来提出的一种用超临界流体代替有机溶剂的脂质体制备方法,具有制备过程简单、对水溶性药物包覆率较高等特点[7-10]。本文利用葡萄糖作为模型药物,对其进行脂质体制备研究,详细考察该工艺条件对脂质体包覆率的影响。
1 实验部分
1.1 实验原料
L-α-Phosphatidylcholine(sigma):磷脂酰胆碱;乙醇:助溶剂,沈阳新兴试剂厂;D-葡萄糖:天津科密欧化学试剂开发中心提供;CO2气体,大连市气体中心,纯度99.9%。
1.2 实验装置与脂质体制备
实验装置如图1所示,设计压力40 MPa、设计温度室温~80 ºC,高压反应釜有效容积为200 cm3,压力表与温度表的精度分别为±0.01 MPa、±0.1 ºC。

图1 超临界逆向蒸发过程装置示意图
大豆卵磷脂与乙醇、葡萄糖制成溶液,经超声振荡后加入到反应釜中,加压至实验所设定的压力,保压一定时间,缓慢释压后得到脂质体样品。
1.3 葡萄糖脂质体包覆率测定

取实验制备的脂质体溶液1 mL放入透析袋中,封闭好透析袋后放置于干燥的烧杯中,精确加入50 mL二次去离子水,在Ph = 7的环境下透析24 h,之后取透析液25 μL放入生物传感分析仪(山东省科学院生物研究所)中检测葡萄含量。由下式确定脂质体对葡萄糖的包覆率[11]:
2 结果及讨论
2.1 压力对葡萄糖包覆率的影响
实验设定温度55 ℃,压力分别为10、12、15、18、20、23和25 MPa下制备脂质体,图2给出了脂质体包覆率随压力的变化曲线。
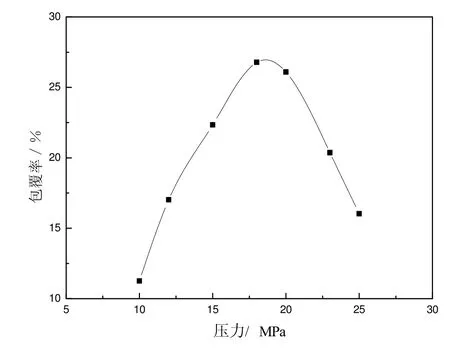
图2 葡萄糖包覆率随压力变化关系曲线
当压力从10 MPa增加到18 MPa时,脂质体内部压力随之增加,体积大的脂质体破裂形成体积小的,体积小的脂质体也会进一步收缩以增加内部压力维持体系平衡,这种变化等同于增加了体系内脂质体的水相内核比率,从而逐渐提高了葡萄糖包覆率;当压力升高到18~20 MPa时,葡萄糖的包覆率为25.7%~27.5%;继续增大压力,体系内胶束浓度增大,胶束之间碰撞、融合几率增加,水相内核比率减小,包覆率降低。
2.2 温度对葡萄糖包覆率的影响
实验压力20 MPa下,温度分别为30、35、45、55和65 ℃下制备脂质体,图3给出了脂质体包覆率随温度的变化曲线。随温度的增加,脂质体对物葡萄糖的包覆率显著增加,最高可到41.3 %。当温度升高时体系内分子热运动加剧,脂质体双分子层流动性增强,体积大的易破裂形成体积小的脂质体以维持体系的相对稳定性,这样体系内脂质体体积平均粒径不断减小,同时胶束浓度增加,这种变化相当于增加了脂质体水相内核的比率,因而有更多的药物进入到脂质体内部,从而表现为包覆率随温度的增加而逐渐增加。当然,考虑到温度过高,对脂质体的稳定性、有效性不利,一般实验都选择在 55~60 ℃进行研究。

图3 葡萄糖包覆率随温度变化曲线
2.3 平衡时间对葡萄糖包覆率的影响
实验压力20 MPa、温度55 ℃时,平衡时间分别为15、20、30、40、45、50和55 min下制备脂质体,图4给出了脂质体包覆率随平衡时间的变化曲线。
当反应平衡时间由15 min增加到45 min时,制得的葡萄糖脂质体包覆率逐渐增加,最高可到26.6%;但继续增加平衡时间,脂质体包覆率反而逐渐下降。原因在于实验制备的脂质体胶束溶液在热力学上是不稳定体系,存在较大自由能,脂质体双分子层分子间作用力较弱,随时间的延长,表面张力明显减弱,双分子层流动性增强,因此易于发生渗漏,导致包覆率大幅度下降。

图4 葡萄糖包覆率随平衡时间变化曲线
2.4 乙醇与类脂质量比对包覆率的影响
在压力为20 MPa,乙醇与类脂用量比分别为0.5:1、1.5:1、2:1、2.5:1 和 3:1 条件下制备脂质体,图5反映了脂质体包覆率随类脂与乙醇用量比变化关系。

图5 包覆率随乙醇与类脂质量比变化曲线
由图5可见,反应釜内压力保持20 MPa,乙醇与类脂质量比为0.5:1~2:1时,随着乙醇用量的增加,脂质体对葡萄糖包覆率会逐渐增加;当乙醇与类脂质量比为2:1~3:1时,包覆率逐渐减小。
大豆卵磷脂分散在水溶液中形成胶束,醇分子能穿入胶束形成混合胶束,减小胶束之间的排斥力,同时由于醇分子的加入使体系的熵值增大,所以有利于胶束的形成和增大,这样在宏观上表现为包覆率的增加。当加入的醇超过临界值时,体系内的胶束浓度也增加到一个临界值,继续增加醇的用量使胶束浓度增加,胶束间相互碰撞交联融合的几率增加,原有包覆在水相内核中的亲水性药物将会渗漏出来,从而使包覆率逐渐降低。
2.5 不同工艺制备的葡萄糖脂质体体积平均粒径
薄膜分散法制备的脂质体粒径分布如图6所示,体积平均粒径为308 nm。葡萄糖的包覆率仅有9.5%。

图6 薄膜分散法制备脂质体粒子粒径分布
超临界逆向蒸发法(温度55 ℃、压力20 MPa、平衡时间35 min、乙醇与类脂质量比2:1)制备的脂质体粒径分布如图7所示,体积平均粒径为320 nm。

图7 超临界工艺制备脂质体粒子粒径分布
评价脂质体质量的指标主要有外观、粒径分布和包覆率等。其中包覆率是衡量脂质体内在质量的一个重要指标。比较两种制备方法,采用超临界流体技术能够显著提高脂质体对葡萄糖的包覆率,脂质体粒径分布窄、体积平均粒径小。
3 结论
用超临界逆相蒸发法制备的葡萄糖脂质体平均粒径320 nm左右,包覆率最高可达41.3%。
实验操作参数压力、温度、平衡时间和乙醇与类脂用量比对脂质体药物包覆率影响很大:压力为10~20 MPa时,葡萄糖脂质体包覆率逐渐增加,达到25.7%~27.5%,随后包覆率逐渐减小;温度为 35~65 ℃时,包覆率显著增大,最高可达41.3%;平衡时间为15~45 min时,包覆率显著增加,但超过45 min后对脂质体包覆率是极其不利的;乙醇与类脂质量比为0.5:1~2:1时,脂质体对葡萄糖包覆率逐渐增加,当质量比在2:1~3:1时,包覆率是逐渐减小的。
[1]NAGAYASU A, UCHIYAMA K. The size of liposomes:a factor which affects their targeting efficiency to tumors and therapeutic activity of liposomal antitumor drugs [J].Advanced Drug Delivery Reviews, 1999, 40(1-2): 75-87.
[2]孙聚魁, 邓英杰, 曹金娜. 纳米脂质体研究进展[J].沈阳药科大学学报, 2010, 27(12): 993-997,1002.
[3]ZUZANNA D K, AGATA D J. Liposomes as delivery systems for antibiotics [J]. International Journal of Pharmaceutics, 2010, 387(1-2): 187-198.
[4]刘晓谦, 王锦玉, 仝燕, 等. 脂质体制备技术及其研究进展[J]. 中国药学杂志, 2011, 46(14): 1084-1088.
[5]张自强, 朱家壁, 姚静, 等. pH 梯度法制备伊立替康脂质体[J]. 中国医科大学学报, 2008, 39(4): 312-316.
[6]程晓丹, 李学明, 顾立. 脂质体对水溶性药物包封方法的研究进展[J]. 华西药学杂志, 2009, 24(2):194-197.
[7]KATSUTO O, TOMOHIRO I. Development of a new preparation method of liposomes using supercritical carbon dioxide [J]. Langmuir, 2001, 17: 3898-3901.
[8]TOMOHIRO I, KATSUTO O. Preparation and physicochemical properties of various soybean lecithin liposomes using supercritical reverse phase evaporation method [J]. Colloids and Surfaces B: Biointerfaces,2003, 27: 133-140.
[9]KATSUTO O, TAKESHI S. Preparation of liposomes using an improved supercritical reverse phase evaporation method [J]. Langmuir, 2006, 22: 2543-2550.
[10]谢芳. 超临界技术制备低水溶性药物脂质体实验研究[D]. 大连理工大学, 2009.
[11]陈召红, 刘皈阳, 魏亚超. 脂质体包封率测定方法研究进展[J]. 解放军药学学报, 2011, 27(1): 79-82.
