均匀设计在候选内参基因RT-qPCR实验条件优化中的应用
2012-07-05曹锡梅梁俊红万东方蒙晓平郭大玮
曹锡梅 梁俊红 张 潮 万东方 蒙晓平 郭大玮*
(1山西医科大学组织学与胚胎学教研室,2山西医科大学法医学院,太原 030001)
随着多个物种基因组全序列的揭晓,RT-qPCR(quantitative real-time reverse transcription PCR)技术在生物学研究领域变得日益重要。该项技术较普通PCR定量准确、重现性好、灵敏度高,是量化基因表达、分析基因转录水平的首选方法[1]。然而,多种变量因素影响其数据处理和结果分析,如提取RNA的质量、酶的效率(反转录效率,扩增效率)等[2]。为了去除这些变量可能存在的差别而获得准确可靠的定量结果,已经有很多方法用于校准这些变异,如实验中常用内参基因GAPDH和β-actin校准目标基因的表达。但是越来越多的研究表明,在不同的实验条件、不同类型的组织和细胞中,常用内参基因 GAPDH 和β-actin变得不再稳定[3-5]。为确保后期RT-qPCR实验结果的准确性和可靠性,有必要筛选稳定的内参基因用于THP-1细胞(人单核白血病细胞系)相关的一系列研究。首先要进行候选内参基因RT-qPCR实验条件优化,如果按照反应条件依次优化,试验次数多、劳动量大,并且由于反应体系中各条件间存在一个动态的最适浓度比例,按逐一优化试验得到的条件组合在一起不一定能得到最佳扩增效果。
为降低实验成本、减少试验次数和劳动量,本研究将均匀设计引入RT-qPCR实验条件优化中。均匀设计是中科院应用数学研究所研究员方开泰和中科院院士王元提出并创立的一种实验设计方法,该方法将数论与多元统计相结合,用于研究多种因素之间的配比关系,以期用最少的试验次数,达到找到最优的实验条件或配方的目的[6,7]。该方法考虑试验点在试验范围内“均匀分散”的特点,去掉“整齐可比”的要求,可以大大减少试验的次数,使试验数等于水平数,特别适合处理多因素多水平的实验设计。为进一步探讨均匀设计用于RT-qPCR条件优化的可行性,本文以THP-1细胞为实验对象,利用均匀设计优化RT-qPCR反应体系,对11个候选内参基因(ACTB、GAPDH、RPL37A、B2M、PPIB、PGK1、PPIA、SDHA、TBP、HPRT1、RPL13A)定量扩增,并为后期实验筛选不同状态下THP-1细胞的稳定内参基因奠定基础。
材料和方法
1.THP-1细胞的培养
THP-1细胞(人单核白血病细胞系,TCHu57)购于中国科学院上海生命科学研究院细胞资源中心,用含10%胎牛血清(Gibco 10099-141)、100U/ml青链霉素混合液(北京索莱宝科技有限公司,P1400-100)的 RPMI 1640 (Hyclone,SH30809.01B)培养液,37℃、5%CO2培养箱培养。稳定培养传2-3代后用于后续实验提取细胞总RNA。
2.总RNA提取纯化与反转录
提取 THP-1细胞总 RNA,具体步骤按照TransZolUp(北京全式金生物技术有限公司,ET111-01)说明书进行。DNase I(RNase Free)(大连宝生物工程有限公司,TaKaRa,D2215)去除总RNA中基因组DNA的污染。紫外分光光度计测定样本的浓度与纯度,OD260/OD280比值在1.9-2.1之间,RNA 浓度约为0.2μg/μl。参照反转录 PrimeScript®RT reagent Kit Perfect Real Time(大连宝生物工程有限公司,TaKaRa,DRR037S)说明书,反应液配制按照试剂盒要求,以400ng总RNA为模板合成cDNA,同时设阴性对照。反转录的反应条件为:37℃15min、85℃5sec,反转录完成后-20℃保存样品。
3.RT-qPCR扩增反应体系及程序
本实验中涉及的候选内参基因的基因序列均来自于GenBank。采用Allele ID6对序列进行分析,并设计适合于SYBR Green的特异性上、下游引物(见表1),委托上海英骏公司(Invitrogen)合成。PCR反应液购于TaKaRa公司SYBR®Premix Ex TaqTMll(大连宝生物工程有限公司,DDR820A),反应体系为20μl,其中SYBR®Premix Ex TaqTMll(2×)10μl、ROX 0.2μl、上、下游引物和cDNA 模板量按照表2、3、4设计加入,dH2O补足余体积。Stratagene实时荧光定量仪Mx3000p运行,反应条件:95℃预变性30s、95℃变性5s、对应实验设计退火温度30s、72℃延伸30s并收集荧光,40个循环,57-95℃生成熔解曲线。
4.均匀设计实验
本实验选用TaKaRa公司SYBR®Premix Ex TaqTMll反应液,该试剂盒已将Taq酶、buffer、dNTPs、MgCl2等配制成混合液,故实验中可变的关键因素共有cDNA模板量、引物浓度和退火温度3个因素,每个因素选定8个水平,见表2。按照3因素8水平的均匀设计表(见表3)设计8个水平的试验点,见表4。3个因素对号入座纵向排布完成后,每一横行组成一个最终的试验点。

表1 候选内参基因的引物序列Table1 Primer sequences of potential internal control genes

表2 实验中相关的3因素8水平Table2 Related factors in this experiment

表3 因素8水平均匀设计表Table3 Uniform design table
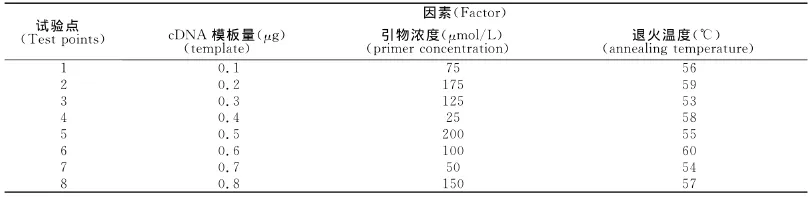
表4 RT-qPCR的均匀设计实验方案表Table4 Experimental scheme of uniform design
5.RT-qPCR实验结果评判标准
RT-qPCR实验结果包括两部分:①扩增曲线,对应Ct值;②熔解曲线,对应Tm值。这两条曲线不便于多次试验间的比较和统计分析,而且对结果的评判也没有统一标准。本实验借鉴同一学院杜秋香等[8]的评分体系,结合熔解曲线峰的数目、峰的形状判定实验结果(见表5)。

表5 RT-qPCR结果评分标准Table5 Rating criteria of RT-qPCR results
6.检测候选内参基因RT-qPCR的扩增效率
定量扩增结束后,分别对11个候选内参基因的8个试验点评分,求出每个试验点11个候选内参基因Ct值、峰数、Tm值和单峰形状分数的均值,再将各评分项目相加得出总分,最高分为最优扩增条件。在此条件下,对THP-1细胞cDNA进行梯度稀释,稀释度从10-1到10-5,用量为1μl。扩增结束后,取循环数值(Ct)为纵坐标,模板cDNA稀释度的对数值为横坐标,作图,得到拟合曲线的斜率(S值),代入方程E=10(-1/s)-1(E为扩增效率),计算得出11个候选内参基因的扩增效率。
结 果
1.根据实验结果及评分标准选出最优RT-qPCR扩增条件
根据表5的评分标准,分别对11个候选内参基因的8个试验点进行评分,求出每个试验点11个候选内参基因Ct值、峰数、Tm值和单峰形状分数的均值,再累计得出总分,评分结果详见表6。本实验的实验条件以第5个试验点最优,扩增曲线和熔解曲线分别见图1、图2。此时的实验条件为cDNA模板量0.5μg、引物浓度200μmol/L、退火温度55℃,该实验条件是11个候选内参基因共同的RT-qPCR反应最优条件。

表6 RT-qPCR实验评分结果Table6 Rating results of RT-qPCR
2.熔解曲线的比较
不同试验点对应的熔解曲线差异很大,第5个试验点的11个候选内参基因熔解曲线均为单峰且锋形高尖,Tm值大于80℃,荧光信号强,灵敏度高(图2),说明第5个试验点的实验条件最优。
3.最优条件下候选内参基因RT-qPCR扩增效率
以梯度稀释的THP-1细胞cDNA为模板,检测最优扩增条件下11个候选内参基因的扩增效率,并通过Ct值与模板稀释度的对数建立标准曲线。表7为11个候选内参基因标准曲线斜率、相关系数及PCR扩增效率。11个候选内参基因标准曲线相关系数均趋于1,表明其线性关系好。

表7 候选内参基因标准曲线斜率、相关系数及PCR扩增效率Table7 The slope,R2 and PCR efficiency of the standard curve of potential internal control genes
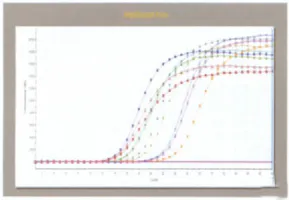
图1 第5个试验点候选内参基因RT-qPCR扩增曲线图。Fig.1 The amplification curves of potential internal control genes in the fifth test conditions.

图2 第5个试验点候选内参基因RT-qPCR熔解曲线图。Fig.2 The dissociation curves of potential internal control genes in the fifth test conditions.
讨 论
RT-qPCR(quantitative real-time reverse transcription PCR)作为一种非常有效的实验方法被广泛应用于分子生物学实验和医学研究中,该项技术是量化基因表达的金标准[1]。RT-qPCR在PCR指数扩增期间通过连续监测荧光信号出现的先后顺序及信号强弱的变化来即时分析特异性产物的量,并以此推断目的基因的初始量,但是RT-qPCR对反应条件的变化相当敏感,一旦条件不合适便得不到理想的结果,所以优化反应条件是RT-qPCR获得可靠结果的前提。
1.RT-qPCR实验条件中的可变因素
与普通PCR反应液的配制不同,多数RT-qPCR试剂盒已将Taq酶、buffer、dNTPs、MgCl2等配制成混合液,故RT-qPCR实验中可变的关键因素有cDNA模板量、引物浓度和退火温度。其中退火温度(annealing temperature)或称复性温度(renaturation temperature)决定着引物和模板的结合特异性,是PCR扩增成功与否的关键因素之一[9,10]。虽然本实验涉及的候选内参基因在细胞内组成性表达,其退火温度波动范围不大,但是为了说明退火温度对RT-qPCR实验成败的影响故将其作为一个可变因素。同样,其它目的基因RT-qPCR实验的可变因素也包括上述3个关键因素,相应合适的模板量、引物浓度和退火温度都需要在实验中优化确定。
2.正交设计与均匀设计的比较
通常探讨RT-qPCR最优反应条件时,常在固定几种影响因素的基础上变换单一因素来寻找最优反应条件,不仅工作量大,而且没有在动态中考虑各反应物之间的相互作用,很难找出反应的最优条件。目前比较流行的正交设计实验经常运用于优化RT-qPCR检测条件[8,11],正交设计实验是从全面试验中挑选出部分有代表性的试验点进行实验,如某项实验有5个影响因素,每个因素有10个水平,如果进行全面试验次数为105,即做十万次试验;正交设计是从这些组合中挑选出102个试验点,这些试验点具有“均匀分散、整齐可比”的特点,但是其实验次数和水平数紧密相关,故多用于因素和水平数不多的实验设计。本实验涉及3因素8水平,如按正交设计进行试验,次数太多,不宜实施,故探索性地引入均匀设计实验。与正交设计不同之处在于均匀设计利用数论中的一致分布理论选取试验点,仅考虑试验点在试验范围内“均匀分散”的特点,去掉“整齐可比”的要求,大大减少试验的次数,使试验数等于水平数,特别适合处理多因素多水平的实验设计。
3.最优条件下候选内参基因的RT-qPCR实验
RT-qPCR的输出结果包括扩增曲线和熔解曲线,其中扩增曲线所对应的Ct值表示每个反应管内荧光信号到达设定阈值时所经历的循环数,每个模板的Ct值与该模板起始拷贝数的对数存在线性关系,Ct值过大或过小都不利于对模板的分析[12]。此外,熔解曲线以基底窄而峰高的单峰为最佳,且Tm值(扩增产物解链温度)至少要大于75℃,同时75℃左右是引物二聚体的解链温度,大多数目的基因包括内参基因扩增产物的Tm值都应大于80℃。然而这两条曲线不便于多次试验间的比较和统计分析,本实验中引入评分标准来量化实验结果(表5)。同时结合以往的研究经验,将均匀设计引入到候选内参基因RT-qPCR实验条件优化中,设计了3因素8水平的试验方案,筛选出RT-qPCR最优扩增条件。在此条件下检测11个候选内参基因的标准曲线相关系数和扩增效率,结果显示11个候选内参基因的扩增效率均大于90%、标准曲线线性关系好(表7)。
本研究通过实验证实均匀设计在优化RT-qPCR实验条件中的可行性,为优化RT-qPCR条件提供了一条新的思路。同时也说明均匀设计适合于研究多因素多水平试验条件优化的配比,能大大节省实验费用。
[1]Wang Y,Barbacioru C,Hyland F,et al.Large scale real-time PCR validation on gene expression measurements from two commercial long-oligonucleotide microarrays.BMC Genomics,2006,7:59
[2]Huggett J,Dheda K,Bustin S,et al.Real-time RTPCR normalisation;strategies and considerations.Genes Immun,2005,6(4):279-284
[3]Ceelen L,De Spiegelaere W,David M,et al.Critical selection of reliable reference genes for gene expression study in the HepaRG cell line.Biochem Pharmacol,2011,81(10):1255-1261
[4]Sun JH,Nan LH,Gao CR,et al.Validation of reference genes for estimating wound age in contused rat skeletal muscle by quantitative real-time PCR.Int J Legal Med,2012 ,126(1):113-120
[5]Ling D,Salvaterra PM.Robust RT-qPCR data normalization:validation and selection of internal reference genes during post-experimental data analysis.Plos one,2011,6(3):e17762
[6]方开泰.均匀设计数论方法在实验设计的应用.应用数学学报,1980,3(4):363-372
[7]王元,方开泰.关于均匀分布与试验设计(数论方法).科学通报,1981,26(2):65-70
[8]杜秋香,孙俊红,王小伟等.正交设计在实时定量PCR检测条件优化中的应用.中国法医学杂志,2008,23(2):111-113
[9]Rychlik W,Spencer WJ,Rhoads RE.Optimization of the annealing temperature for DNA amplification in vitro.Nucleic Acids Res,1990,18(21):6409-6412
[10]Wu DY,Ugozzoli L,Pal BK,et al.The effect of temperature and oligonucleotide primer length on the specificity and efficiency of amplification by the polymerase chain reaction.DNA Cell Biol,1991,10(3):233-238
[11]Crijns AP,Gerbens F,Plantinga AE,et al.A biological question and a balanced(orthogonal)design:the ingredients to efficiently analyze two-color microarrays with Confirmatory Factor Analysis.BMC Genomics,2006,7:232
[12]Caraguel CG,Stryhn H,GagnéN,et al.Selection of a cutoff value for real-time polymerase chain reaction results to fit a diagnostic purpose:analytical and epidemiologic approaches.J Vet Diagn Invest.,2011,23(1):2-15
