Bmi-1在非小细胞肺癌组织中的表达和意义
2012-05-31刘春灵宋文刚李惠翔
刘春灵 宋文刚 李惠翔
肺癌是严重危害人类健康的常见恶性肿瘤之一,有关肺癌的发病机制目前尚未彻底阐明,但已经逐步认识到肺癌的发生是涉及多基因、多步骤的互相协同、互相作用的癌变过程。癌基因的异常激活和过度表达在肺癌发生发展中的作用越来越受到人们的重视。
Bmi-1(B-cell specific moloney leukemia virus inserti on site 1, Bmi-1)是PCG (polycomb of genes)成员,其最初发现是作为一种原癌基因,与另一种癌基因c-myc协同作用引起细胞转化和肿瘤形成,导致转基因鼠B细胞淋巴瘤的发病[1]。研究发现,Bmi-1在多种恶性肿瘤组织中呈现过表达[2-4],被认为是一种癌基因。目前国内鲜见Bmi-1与非小细胞肺癌(non-smallcell lung cancer,NSCLC)相关性的报道。本文对42例非小细胞肺癌及其癌旁正常肺组织标本中Bmi-1的表达情况进行了初步的研究和分析,以探讨Bmi-1在NSCLC进展中的作用及其潜在的临床应用价值。
1 材料与方法
1.1 临床资料
收集漯河市中心医院2007~2010年手术切除的非小细胞肺癌石蜡标本42例。其中男性29例,女性13例,平均年龄59.4岁;病理诊断为鳞癌26例,腺癌16例;中、高分化29例,低分化13例;TNM分期Ⅰ~Ⅱ期27例,Ⅲ~Ⅳ期15例。术前未放疗或化疗。所有标本均经10%中性甲醛溶液固定,石蜡包埋。
1.2 试剂与方法
每个蜡块4μm厚连续切片进行免疫组化染色。鼠抗Bmi-1单克隆抗体,SP免疫组化试剂盒购自北京中杉公司。PBS代替一抗做阴性对照。
1.3 免疫组化染色
(1)石蜡包埋组织切片,脱蜡水化,磷酸盐缓冲液(PBS)冲洗5min×3次;(2)将切片置于新鲜配制的3%H2O2中浸泡30min,PBS洗5min×3次;(3)抗原修复。高压锅加热,加热至喷气时开始计时,2min后端离热源,冷却至室温,PBS洗5min×3次;(4)吸去片上的PBS,滴加10%正常血清,室温下置湿盒内30min;(5)弃去多余的血清,滴加用PBS液稀释的一抗(1∶500),置湿盒4℃冰箱中过夜;以PBS液代替一抗作阴性对照;(6)第2天取出置室温1h后,PBS漂洗5min×3次;(7)滴加第二抗体,室温孵育20min,PBS漂洗5min×3次;(8)滴加辣根过氧化物酶标记链霉卵白素工作液,室温孵育20min,PBS漂洗5min×3次;(9)二氨基联苯胺(DAB)显色1~2min,显微镜下控制显色时间,自来水终止显色反应,苏木精复染,脱水,中性树胶封片。
1.4 结果判断
Bmi-1蛋白表达结果判定参照冯艳等[5]计分方法。光学显微镜下观察组织标本的着色程度,高倍镜下(400×)随机取4个不同的视野,计数细胞总数及核阳性细胞数,根据染色的强弱程度计分:阴性染色1分,弱染色2分,中等强度染色3分,强染色4分,按阳性细胞所占的百分比计分:≤10%为1分,>10%且≤50%为2分,>50%且≤75%为3分,>75%为4分;同时,根据二者的乘积判断结果:≤4分为阴性表达,>4为阳性表达。免疫组化结果判定由两位病理医师采用盲法进行观察及评估。
1.5 统计学分析
所有数据均采用SPSS15.0统计学软件进行统计学处理,阳性率之间的比较采用x2检验,α=0.05为检验水准。
2 结果
2.1 Bmi-1在非小细胞肺癌及其相应癌旁正常肺组织中的表达
Bmi-1蛋白阳性表达呈棕黄色颗粒,主要分布在癌细胞胞核中,仅少量表达见于胞浆。见图1、图2。肺癌组织中Bmi-1阳性表达率为73.8%(31/42)。在癌旁肺组织中Bmi-1表达率为11.9%(5/42),肺癌与相应癌旁正常肺组织中Bmi-1蛋白的表达,差异有统计学意义(P<0.05)。见表1。

表1 肺癌及癌旁正常肺组织中Bmi-1蛋白的表达

图1 Bmi-1在鳞癌中的阳性表达(SP×400)

图2 Bmi-1在腺癌中的阳性表达(SP×400)
2.2 Bmi-1蛋白与肺癌临床病理因素的关系
Bmi-1的表达水平与肺癌的组织学类型无关;低分化肺癌Bmi-1的阳性表达率高于中高分化肺癌,但差异无统计学意义(P>0.05);而与TNM分期有关,即Ⅲ~Ⅳ期的癌组织组中Bmi-1的阳性表达率高于Ⅰ~Ⅱ期组,差异有统计学意义(P<0.05)。见表2。
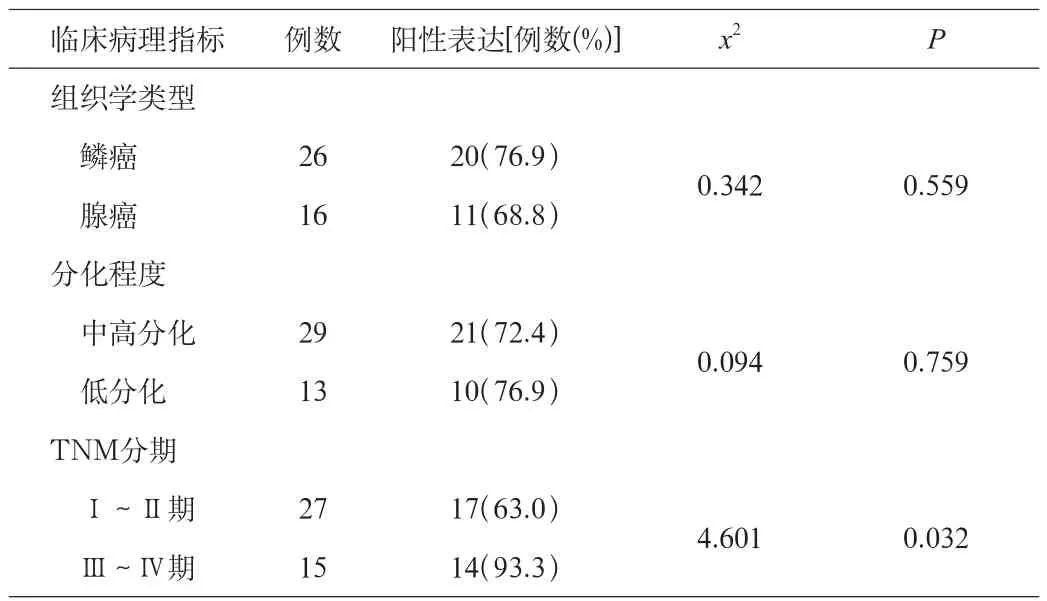
表2 Bmi-1蛋白与肺癌临床病理因素的关系
3 讨论
机体在正常发育和分化过程中,肿瘤抑制基因和原癌基因作用的平衡性具有重要的意义,肿瘤抑制基因激活后通过促进细胞死亡或干细胞老化而抑制再生,原癌基因则具有转化细胞及维持干细胞自我更新的能力,进而促进增生,任何一方面出现基因表达调控失常都有可能导致肿瘤的发生,Bmi-1基因属于多梳基因家族(polycomb of genes,PCG)成员之一,是一种广泛表达的核蛋白,调节HOX基因的转录,参与细胞的增殖调控[6]。人Bmi-1基因定位于10P13,含10个外显子编码一个含326个氨基酸的蛋白质,该蛋白质含有一个位于N末端的环指结构域(ring finger domain,RF)和位于中心的保守DNA结合模序螺旋-转角-螺旋-转角(H-T-H-T),起转录抑制作用,正是这个结构域对细胞的增殖和肿瘤形成有着重要作用[7]。
本研究结果发现,非小细胞肺癌组织中Bmi-1的表达比癌旁正常肺组织中明显升高,且与患者临床分期密切相关,而Bmi-1的表达与组织学类型无关,低分化癌组织中Bmi-1的表达稍高于分化较好的癌组织,但差异无统计学意义。黄开红等[8]研究认为在胃癌组织中Bmi-1基因的表达状态与胃癌的生长和浸润转移关系密切,Bmi-1基因阳性表达者生存率明显低于阴性者,Bmi-1基因表达的测定有助于肿瘤预后的判断。本研究的结果也显示Bmi-1基因可能在非小细胞肺癌的发生发展中起着重要作用,并有望成为一个新的预测肿瘤预后的标志物。
[1]Haupt Y,AlexanderWS,Barri G,et al.Novel zinc finger gene implicated as myc collaborator by retrovirally accelerated lym-phomagenesis in E mu- myc transgenic mice[J].Cell,1991,65(5):753-763.
[2]Van- Leender s GJ,Dukers D,Hesse l s D,et al.Poly-comb-group oncogenes EZH2,BM I1,and RI NG1 are overexpressed in prostate cancer with adverse pathologic and clinical feature[J].EurUroL,2007,52(2):455-463 .
[3]Wang H,Pan K,ZhangHK,et al.Increased poly comb- group oncogene Bmi-1 expression correlates with poor prognos is in hepatocellular carcinoma[J].CancerRes Oncol,2008,134(5):535-541.
[4]Arnes JB,Collett K,Akslen LA. Independent prognostic value of the basal-like phenotype of breast cancer and as sociations with EGFR and candidate stem cellmarker BMI-1[J].Histopathology,2008,52(3):370-380.
[5]冯艳,宋立兵,郭宝红,等.Bmi-1在乳腺癌组织中的表达及意义[J].癌症,2007,26(2):154-157.
[6]AriasAM.Ep ithelial mesenchymal interactions in cancer and development[J].Cell,2001,105(4):425-431.
[7]A lexander GM,James EC,Norris SW,et al.Genomescans provide evidence forkeloid susceptibility locion chromosomes 2q23 and 7p11 [J].J Invest Demato l,2004,122(5):1126-1133.
[8] 黄开红,刘建华,李学先,等.Bmi-1在胃癌组织中的表达及相关性研究[J].中国肿瘤临床,2006,34(17):961-965.