山西省玉米穗腐病病原镰孢菌的分离与鉴定
2012-04-25李新凤王建明张作刚高俊明郝晓娟贺运春
李新凤,王建明,张作刚,高俊明,郝晓娟,贺运春
(山西农业大学 农学院,山西 太谷030801)
玉米是全世界广泛分布的粮食作物之一,同时也是重要的饲料来源。在其生长过程中不可避免地要受到多种病原物的侵染。玉米穗腐病又称玉米穗粒腐病,是玉米生长后期最常见的病害之一。近年来,由于玉米品种不断更新,栽培管理措施不当,以及气候因素等的影响,导致该病呈逐年加重的趋势,严重影响着我国的玉米生产。引起玉米穗腐病的病原菌有多种,其中镰孢菌是引起该病的主要病原菌,该菌不仅可以直接侵染玉米对玉米造成危害,其分泌的毒素还可以引起人畜中毒,严重影响玉米的安全性。
近年来,有关玉米穗腐病病原镰孢菌的研究很多。据文献报道,不同地理区域的玉米种植区,玉米穗腐病病原镰孢菌的种群结构不同[1],其中欧洲、非洲等地的研究表明,该病的主要致病菌为轮枝镰刀菌(Fusarium verticillioides;异名串珠镰刀菌F.moniforme)、层出镰刀菌(F.proliferatum)和胶孢镰刀菌(F.subglutinans)[2~4]。我国的研究普遍认为,引起该病的优势病原菌为轮枝镰刀菌(F.verticillioide),其次是禾谷镰刀菌(F.gram inearum)[5~7]。明确玉米穗腐病的病原菌的种群结构对于玉米穗腐病的有效防控具有重要的指导意义。
玉米也是山西省的主要栽培作物之一,近年来玉米穗腐病的发生很普遍,但未见有关山西省玉米穗腐病病原鉴定的报道。为明确山西省该病的病原菌种类,从2010年开始对山西省不同地区的玉米穗腐病进行了调查,并对该病的病原菌进行了分离、纯化与鉴定,旨在为该病的流行规律、抗病育种及相关领域的研究提供可靠的理论依据。
1 材料与方法
1.1 试验材料
1.1.1 供试品种
供试玉米品种为M26,该品种易感穗腐病。
1.1.2 培养基
Armstrong液体培养基:
葡萄糖20.0g,MgSO4·7H2O 0.4g,KCl 1.6g,KH2PO41.1g,Ca(NO3)25.9g,FeSO40.2 mg·L-1,MnSO40.2mg·L-1,ZnSO40.2mg·L-1,去离子水1000mL。
康乃馨叶片培养基(CLA)[8,9]:
琼脂20g,水1L,康乃馨叶片适量。将3~5 mm2大小的无菌康乃馨叶片,放入冷却到45℃的灭菌水琼脂平板表面,一般情况下,9cm大的培养皿内加入10~12块即可。接种时,菌块要靠近康乃馨叶片。
Spezieller N¨ahrstoffarmer 琼 脂 培 养 基(SNA)[10]:
KCl 0.5g,MgSO4·7H2O 0.5g,KNO31g,KH2PO41g,蔗糖0.2g,葡萄糖0.2g,琼脂20g,蒸馏水1L。将灭菌培养基倒平板,待平板冷却后,在平板表面,放入1~2片滤纸条。
2%水琼脂培养基(WA):
琼脂20g,自来水1L。
1.2 试验方法
1.2.1 病株采集与病原菌分离
2010年9月,于山西省晋城市与太谷县两地选取玉米穗腐病发病重的病株,采集玉米穗腐病病穗20余份,利用常规组织分离法,对采集病样的病粒和穗轴上的病原菌进行了分离纯化:将玉米病粒置于70%酒精中浸泡几秒钟,取出后用无菌水冲洗干净,灭菌滤纸吸干表面的水份,然后用无菌刀片将其切成小块,置于2%的水琼脂平板表面,每平板4~5块,之后置于25℃的恒温培养箱内培养。穗轴上的病原菌分离,则无需进行表面消毒,可切开穗轴,直接切取穗轴里面的小块组织,置于2%的水琼脂平板中培养,待长出菌落后,用稀释平板法进行单孢分离。然后利用形态学分类方法对单孢分离物进行初步鉴定、编号,并记录不同种镰孢菌的分离频率。
镰孢菌的分离频率=(所得菌种株数/分离组织块数)×100%。
1.2.2 病原菌的形态鉴定
经单孢分离后的培养物,接种到CLA、SNA、PDA培养基上,依据菌株生长速率的差异,在适宜的培养条件下培养4~10天后,依次记录各项试验数据,用于该镰孢菌种的鉴定。
培养性状观察:
包括在PDA培养基上菌落的质地、颜色,基质颜色。色泽名称根据《色谱》一书进行描述[11]。并记录菌落在PDA培养基上的生长速度。
整体显微形态观察:
将在CLA或SNA平板培养好的菌体置于10倍或20倍目镜下,观察菌株特征:看是否有小孢子形成,小孢子的形成方式,小孢子是否链生等特点。观察在PDA、SNA培养基上,及CLA平板中的康乃馨叶片上是否有分生孢子座形成,如果有,记录其颜色。同时要注意观察产孢细胞或瓶梗的特点。
显微形态观察:
用灭菌的挑针在CLA、SNA、WA平板上挑取少量培养物,置于载玻片上的水滴中,制成临时玻片,然后在40倍目镜下观察菌体的形态特点,主要是大、小孢子,厚垣孢子及子实体形态。包括大孢子的整体形态、大小、分隔数、基孢和顶孢形态;产孢细胞及产孢梗的形态;小孢子和厚垣孢子的形态大小等。
最后参考Leslie、Nelson、Booth的分类系统,对分离到的镰孢菌菌株进行形态学鉴定[12~14]。
1.2.3 致病性测定
按照柯赫氏法则,在山西农业大学农作站试验基地进行玉米穗腐病的致病性回接试验。
供试玉米植株的培育:于2011年春,将供试玉米种子播种于连续5年内未种植玉米的地块内,备用。
玉米基质的制备:将预先准备好的玉米用自来水泡软,与适量牙签混匀,装入可进行高压灭菌的聚丙烯食用菌菌袋内,装入量为袋容量的2/3,用线绳封口后,经高压蒸汽灭菌30min后,备用。
菌种的制备:将单孢分离物接种于PDA平板上,25℃培养5d后,自菌落边缘打取4mm大的菌碟,接入Armstrong培养液中,震荡培养4~5 d,用双层纱布滤掉菌丝,将滤液离心后收集孢子,再用无菌水配成浓度为1×106个·mL-1的孢子悬浮液,然后将该孢子悬浮液接种到装有无菌玉米培养基的三角瓶内,室温下培养一周后,作为菌种进一步扩大培养的种子。然后将培养好的种子接种到已制备好的玉米基质内,于室温下发酵10天后,备用。
致病性回接与病原物的再分离:于玉米乳熟期,选取健壮玉米苗上的雌穗为接种对象,从以上各菌种发酵的产物内,分别挑选长满各种菌的牙签,将其单独或以两两组合的方法,插入供试的玉米雌穗组织内。然后照常管理,于收获前10天调查发病情况,取发病明显的病穗,按照1.2.1的方法对其上的病原菌进行重新分离、纯化,并经形态学鉴定后,看是否与原接种菌种相同。
2 试验结果
2.1 病样分离、纯化结果
由表1可看出,从山西省两县市采集的20余份玉米穗腐病样品中共分离到53株镰孢菌,其中28株为轮枝镰孢菌,分离频率为46.7%,15株为禾谷镰孢菌,分类频率为24.9%,10株半裸镰孢菌,分离频率为16.7%。
2.2 病原菌形态特点
2.2.1 轮枝镰孢菌(Fusarium verticillioides)(图1)

表1 玉米穗腐病镰孢菌的分离结果Table 1 Isolation result of Fusarium species from maize ear rot

图1 轮枝镰孢菌Fig.1 F.verticillioides(×400)注:A.小型分生孢子;B.单瓶梗产孢;C.大型分生孢子;D.串状着生string,假头状着生Note:A:microconidium;B:monophialidespore;C:macroconidium;D:microconidium,psudocapitata
轮枝镰孢蓖:气生菌丝羊毛状至粉状,粉色至紫色,后产生深紫色色素,基物表面及基物为暗紫色。在PDA平板上于25℃培养4d后,菌落直径为3.5~4.6cm。产孢细胞单瓶梗,瓶形,分枝或不分枝。小型分生孢子多,呈链状,分生孢子链较长,一般都大于50μm,有时聚集形成假头状。小孢子一端平截,为典型的棒槌形,没有或有1分隔,量度为4.1~8.2μm×1.7~3.9μm。菌体培养后期可产生桔黄色分生孢子座。大型分生孢子细长,较直,孢子的背腹两侧近似平行,两端微收缩。顶细胞为渐细的锥形,略弯曲,基细胞为不明显的足跟状。大孢子壁较薄,分隔明显,一般为3~5个分隔。量度为24.3~41.4μm×3.7~4.9μm。
2.2.2 禾谷镰孢菌(Fusarium graminearum)(图2)
禾谷镰孢菌:在PDA培养基上生长迅速,菌落生长初期,呈放射状。气生菌丝呈羊毛状旺盛生长,白色至紫红色,菌落中央常呈浅驼色至黄褐色,菌落背面为紫红色。在25℃下培养4d后,菌落直径为2.6~3.3cm。产孢细胞单瓶梗。小型分生孢子缺乏。在SNA或CLA上产生桔黄色分生孢子座。大型分生孢子较直或镰刀形,顶细胞略弯曲,渐尖,短喙状,基部足跟明显。一般3~6分隔,多为5隔,量度为39.13~78.73μm×3.99~6.37 μm。在培养后期大孢子数量明显减少。厚垣孢子聚生或串生,间生或顶生,球形或近球形,浅褐色。

图2 禾谷镰孢菌Fig.2 F.graminearum (×400)注:A.大型分生孢子;B.单瓶梗产孢;C.厚垣孢子 ,图3同。Note:A.macroconidium;B.monophialidespore;C.chlamydosporem,The same as in Fig.3.
2.2.3 半裸镰孢菌(Fusarium semitectum)(图3)
半裸镰孢菌:在PDA培养基上25℃培养4d后,菌落直径为4.2~5.6cm。气生菌丝羊毛状或羊绒状,初期白色至淡粉红,菌落背面粉色,后期菌落变为浅驼色至褐色,基物表面茶褐色,菌落背面深褐色。产孢细胞单瓶梗、复瓶梗和多芽产孢共存。气生菌丝上产生的大小孢子之间没有明显的界限,存在大量的中型分生孢子。分生孢子多数为倒卵形或纺锤形,稍弯或直。分生孢子座上产生的孢子镰状,稍弯,顶细胞楔形,基细胞突起,足跟有或无,多为3~5个分隔,量度为28.72~39.99μm×4.61~5.93μm。厚垣孢子极少,球形,单顶生或串生于菌丝中间,褐色。
2.3 分离物致病性试验结果
致病性测定结果表明(表2),与对照相比,除接种半裸镰孢菌的雌穗没有表现明显的症状外,其余接种方式的雌穗都表现出了不同程度的穗腐病症状。在单一菌种接种试验中,接种禾谷镰孢菌的雌穗发病最重,发病率为84%,田间症状表现为,被害果穗顶部或中部明显变色,局部或大片果穗腐烂,病粒皱缩,并出现粉红色霉层。接种轮枝镰孢菌的雌穗发病相对较轻,发病率为70%,多数发病雌穗表现为个别或局部籽粒变色、腐烂,并出现乳白色、粉色霉层;在3种菌的两两随机组合接种试验中,禾谷镰孢菌与轮枝镰孢菌组合接种的雌穗发病最重,其发病率明显高于单独接种轮枝镰孢菌与其他两种组合的接种试验,为86%。田间症状表现为,多数果穗大片或整个腐烂,果穗病部苞叶还常被密集的菌丝贯穿,黏在一起贴在果穗上很难剥离。
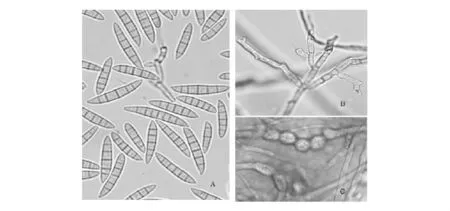
图3 半裸镰孢菌Fig.3 F.semitectum(×400)
对接种后再次发病的植株进行的病原菌分离纯化结果表明(表2),单独接种轮枝镰孢菌的病穗上再分离得到的病菌与原接种菌株相同,仍为轮枝镰孢菌。在单独接种禾谷镰孢菌的病穗上不仅可以分离到禾谷镰孢菌,而且还可以分离到轮枝镰孢菌;在3种菌两两组合的接种试验中,轮枝镰孢菌与半裸镰孢菌混合接种的病穗上,及轮枝镰孢菌与禾谷镰孢菌混合接种的病穗上,再分离得到的菌株也与原菌株相同。而在禾谷镰孢菌与半裸镰孢菌混合接种的病穗上,除分离到与原菌株相同的菌株外,还分离到了轮枝镰孢菌。可见,自接种轮枝镰孢菌的病穗上再分离只能得到与原菌种一致的菌种,而接种禾谷镰孢菌的病穗上除可以分离到原接种的菌种,即禾谷镰孢菌外,还可以分离到未接种的轮枝镰孢菌。

表2 镰孢菌在玉米上的致病性测定Table 2 Virulence test of Fusarium isolates to cucumber
由此可见,原接种菌种中的禾谷镰孢菌与轮枝镰孢菌均为山西省玉米穗腐病的致病菌,禾谷镰孢菌侵染的植株也会受到轮枝镰孢菌的侵染,但轮枝镰孢菌侵染的植株不一定会受到禾谷镰孢菌的侵染,而且两种菌复合侵染时,玉米穗腐病发病最严重。
3 结论与讨论
通过对玉米穗腐病致病菌的分离、纯化、鉴定及致病性回接试验,确定了山西省晋城市和太谷县玉米穗腐病的病原镰孢菌为轮枝镰孢菌和禾谷镰孢菌,其中轮枝镰孢菌为优势种,且两种菌复合侵染要比单独侵染对玉米造成的为害更严重。这一结果为进一步研究山西省玉米穗腐病的流行规律,发病机制、抗病育种等方面提供了可靠的理论依据。
据文献报道,引起玉米穗腐病的病原菌有二十多种,但各地报道的优势种不完全一致。国内多数研究表明,轮枝镰刀菌为吉林、陕西、河北各玉米产区玉米穗腐病的优势种群[15~17],与本研究结果一致。而云南玉溪地区则以禾谷镰刀菌F.graminearum为优势种[18]。本研究结果表明,虽然轮枝镰孢菌的分离频率最高,为引起该病的优势病原菌种群,但是,在接种禾谷镰孢菌的病穗上同时还可以分离到未接种的轮枝镰孢菌,而接种轮枝镰孢菌的病穗上分离不到禾谷镰孢菌,且两种菌复合侵染比单独一种菌侵染发病更严重。可见,禾谷镰孢菌的侵染有助于轮枝镰孢菌的侵染,加重了该病的发生,其原因还有待于进一步探讨。
[1]陈捷.我国玉米穗、茎腐病病害研究现状与展望[J].沈阳农业大学学报,2000,31(5):393-401.
[2]Fandohan P,Hell K,Marasas W F O,et al.Infection of maize by Fusarium species and contamination with fumonisin in Africa[J].African Journal of Biotechnology,2003,2(12):570-579.
[3]Visentin I,Tamietti G,Valentino D,et al.The ITS region as ataxonomic discrminator between Fusarium verticillioides and Fusarium proliferatum[J].Mycological Research,2009,113:1137-1145.
[4]Cumagun C J R,Ramos J S,Dmiaano A O,et al.Genetic characteristics of Fusarium verticillioides from corn in the Philippines[J].Journal of General Plant Pahtology,2009,75:405-412.
[5]李洪连,张新,袁红霞,等.玉米杂交种穗粒腐病原鉴定[J].植物保护学报,1999,26(4):305-308.
[6]邹庆道,陈捷,张子君.玉米镰孢菌穗、茎腐病侵染循环的相互关系[J].植物保护学报,2003,30(4):435-436.
[7]Xu S F,Chen J,Gao Z G,et al.Maize stalk rot and ear rot in China[J].Acta Phytopathologica Sinica,2006,36(3):193-203.
[8]Fisher N L,L W Burgess,T A Toussoun,et al.Carnation leaves as a substrate and for preserving cultures of Fusarium species[J].Phytopathology,1982,72:151-153.
[9]Snyder W C,H N Hansen.Advantages of natural media and environments in the culture of fungi[J].Phytopathology,1947,37:420-421.
[10]Nirenberg H I.Untersuchungenüber die morphologische und biologische Differenzierung in der Fusarium Sektion Liseola[J].Mitteilungen aus der Biologischen Bundesanstalt Für Land-und Forstwirtschaft(Berlin-Dahlem),1976,169:1-117.
[11]中国科学院编译出版委员会名词室.色谱[M].北京:科学出版社,1957:23-68.
[12]Leslie J F,Summerell B A.The Fusarium laboratory manual[M].USA:Blackwell Publishing,2006:1-388.
[13]Nelson P E,Toussoun T A,Marasas W F O.Fusarium species:Anillustrated manual for identification[M].London:The Pennsylvania State University Park,1983:1-193.
[14]Booth C.The genus Fusarium [M].London:Commonwealth Mycological Institute,1971:1-237.
[15]孔令晓,罗畔池.玉米穗粒腐病病原菌鉴定及致病性[J].玉米科学,1995,3(增刊):29-31.
[16]马秉元,龙书生,李亚玲,等.玉米穗粒腐病的病原鉴定及致病性测试[J].植物保护学报,1998,25(4):300-304.
[17]任金平,吴新兰,孙秀华.吉林省玉米镰刀菌穗腐病和茎腐病病原菌传染循环研究[J].玉米科学,1995,3(增刊):25-28.
[18]李顺德,黄业修.玉溪地区玉米穗粒腐病发生与危害调查[J].植物保护,1998,24(5):20-21.
