利用合适的启动子提高外源基因在Jurkat细胞中的表达
2012-04-13袁娟牟宗春游佳马维骏
袁娟,牟宗春,游佳,马维骏
·论著·
利用合适的启动子提高外源基因在Jurkat细胞中的表达
袁娟,牟宗春,游佳,马维骏
目的通过选择合适的启动子来实现外源基因在 Jurkat 细胞中的高效表达。
Jurkat 细胞; 启动区(遗传学); 基因,报告; 萤光素酶类
www.cmbp.net.cn 中国医药生物技术, 2012, 7(4):281-285
Jurkat 细胞是一种分离自白血病患者外周血T 淋巴细胞的细胞系[1],通常用于细胞因子受体表达、T 淋巴细胞信号通路、T 淋巴细胞激活、癌症对药物和放射耐受差异的机制、急性 T 淋巴细胞白血病发病机制以及治疗方法等方面的研究[2-3]。该细胞在植物血凝素(phytohemagglutinin,PHA)或者刀豆蛋白 A(concanavalin A,ConA)刺激下能够产生大量的 IL-2,且其产生的 IL-2 能够促进已被抗原激活的效应 T 淋巴细胞的增殖[2]。因此,Jurkat 细胞是一种研究哺乳动物 T 淋巴细胞以及免疫相关功能的良好工具。哺乳动物细胞中这些功能的研究,常常需要有效的启动子过表达相关基因。启动子是基因表达的“开关”之一,其对基因的表达起着重要的调控作用。在真核生物中,不同的转录因子可以与相应的启动子序列结合,从而精确地调控基因表达的时间和水平[4]。因此,选择具有高表达活性的启动子对驱动基因高效表达是非常关键的。在大多数哺乳动物细胞中,一般选择表达活性较强的病毒启动子[5-7],如猿猴病毒 40 (simian virus 40,SV40)早期启动子、巨细胞病毒(cytomegalovirus,CMV)即刻早期启动子。但是在有些哺乳动物细胞中,例如 Jurkat 细胞系中,SV40 和 CMV 启动子的活性并不高[8-9]。而一些细胞启动子,如人源的延长因子 1α(elongation factor-1,EF1α)启动子、人源的泛素 C(ubiquitin C,UbC)启动子也是能高效表达外源基因的启动子[10-11]。基于以上因素,我们利用荧光素酶双报告基因系统检测 SV40、CMV 启动子与 EF1α、UbC启动子在 Jurkat 细胞中的相对活性,通过高活性启动子来实现外源基因在 Jurkat 细胞中的高效表达,以利于 Jurkat 细胞系在哺乳动物 T 淋巴细胞以及免疫相关功能研究中的应用。
1 材料与方法
1.1 材料
1.1.1细胞及质粒 人 T 淋巴细胞白血病细胞株 Jurkat(Clone E6-1)来自中国科学院典型培养物保藏委员会细胞库/中国科学院上海生命科学研究院细胞资源中心。美国 Promega 公司的 pGL3 control 质粒含有 SV40 启动子驱动的萤火虫荧光素酶(firefly luciferase,Fluc)报告基因。本实验室构建的 pGL3-MCS 质粒含有 pGL3-control 质粒的全长序列和位于 Fluc 编码区下游的一段多克隆位点(multiple cloning site,MCS)序列。美国Invitrogen 公司的 pcDNA3.1/myc-His(-) 质粒含有CMV 启动子。中国科学院上海生命科学研究院健康科学研究所杨黄恬研究组构建的 pEF1α-EGFP质粒含有人源 EF1α 启动子[11]。美国加州理工学院David Baltimore 实验室构建的 FUGW 质粒含有人源 UbC 启动子[12]。美国 Promega 公司的pRL-TK 质粒含有单纯胞疹病毒胸苷激酶(herpes simplex virus thymidine kinase,HSV-TK)启动子驱动的海肾荧光素酶(renilla luciferase,Rluc)报告基因。
1.1.2试剂及仪器 特级胎牛血清、OPTI-MEM培养基购自美国 Gibco 公司;Lipofectamine-2000购自美国 Invitrogen 公司;RPMI-1640 液体培养基购自美国 Hyclone 公司;Dual-Luciferase®Reporter Assay System 购自美国 Promega 公司;限制性内切酶 Ase I 和 Pac I 购自美国 NEB 公司;其他限制性内切酶、T4 DNA 聚合酶和 T4 DNA连接酶购自日本 TaKaRa 公司;Lumat LB 9507 型化学发光检测仪购自德国 Berthold Technologies公司。
1.2 方法
1.2.1质粒载体片段和 DNA 片段的制备 利用Bgl II 和 Hind III 酶切位点,将 CMV 启动子克隆到 pGL3-MCS 中 Fluc 编码区的上游,构建出质粒 pGL3-CMV。用 Bgl II 和 Hind III 分别对pcDNA3.1/myc-His(-) 和 pGL3-MCS 进行双酶切。
利用 Ase I、Bgl II 和 Hind III 酶切位点,将EF1α 启动子克隆到 pGL3-MCS 中 Fluc 编码区的上游构建出质粒 pGL3-EF1α。将质粒 pEF1α-EGFP 用 Ase I 酶切后用 T4 DNA 聚合酶补平粘性末端,然后用 Hind III 酶切。将质粒 pGL3-MCS 用 Bgl II 酶切后用 T4 DNA 聚合酶补平粘性末端,然后用 Hind III 酶切。
利用 Pac I、Sma I 和 Nco I 酶切位点,将UbC 启动子克隆到 pGL3-MCS 中 Fluc 编码区的上游,构建出质粒 pGL3-UbC。将质粒 FUGW 用 Pac I 酶切后用 T4 DNA 聚合酶补平粘性末端,然后用 Nco I 酶切。将质粒 pGL3-MCS 用Sma I 和 Nco I 进行双酶切。
酶切反应、粘性末端补平反应、连接反应均按相应公司提供的说明书进行操作。
1.2.2重组质粒的构建及鉴定 用 T4 DNA 连接酶连接载体片段与相应的 DNA 片段。转化 E. coli DH5α 感受态细胞后将挑取的单菌落进行培养,提取菌体中的质粒,并进行酶切验证。各个重组质粒酶切验证所用的限制性内切酶分别如下:pGL3-CMV 用 Bgl II 与 Hind III,pGL3-EF1α 用Hind III 与 Kpn I,pGL3-UbC 用 Nco I 与 Kpn I。
1.2.3细胞的传代培养 细胞以 2 × 105个/ml的起始密度培养于完全培养基,该完全培养基为含10% 特级胎牛血清的 RPMI-1640。细胞置于含5% CO2的 37 ℃ 恒温培养箱中培养,每 48 h 传代一次。
1.2.4细胞转染 将培养的 Jurkat 细胞低速离心后去净上清,加入新鲜的完全培养基后调整细胞密度为 4 × 105个/ml 并分至 24 孔板中,每孔500 μl,置于含 5% CO2的 37 ℃ 恒温培养箱中培养 24 h。将 400 ng Fluc 质粒和 400 ng Rluc 质粒一起加入 50 μl 37 ℃ 预热的 OPTI-MEM 培养基中混匀。将 2 μl Lipofectamine-2000 加入 50 μl 37 ℃预热的 OPTI-MEM 培养基中并轻轻混匀,室温静置 5 min。将混有双报告基因质粒的 OPTI-MEM培养基加入到混有 Lipofectamine-2000 的 OPTIMEM 培养基中,轻轻混匀,室温静置 20 min。将混合液逐滴加入 24 孔板中的 Jurkat 细胞中,轻轻晃动培养板混匀,37 ℃ 继续培养 24 h。
1.2.5细胞裂解物的制备、报告基因荧光素酶活性的测定和数据分析 收集转染了双报告基因的Jurkat 细胞,600 × g 离心 3 min,去净上清培养基。加入 1 ml PBS 重悬细胞后 600 × g离心 3 min,去净上清。按照 Dual-Luciferase®Reporter Assay System说明书用裂解液处理收集的 Jurkat 细胞。取 10 μl 细胞裂解物并用化学发光检测仪分别检测其中 Fluc 和 Rluc 与相应底物反应后所产生的荧光强度。细胞裂解物中 Fluc 与相应底物反应所产生的荧光强度与 Fluc 的酶活成正比。以 Rluc的荧光强度作为内参照对 Fluc 的荧光强度进行归一化处理即计算细胞裂解物中 Fluc 荧光强度与Rluc 荧光强度的比值,该比值即为 Fluc的相对酶活。
2 结果
2.1 不同启动子驱动 Fluc 报告基因表达的重组质粒的构建及酶切鉴定
不同启动子驱动 Fluc 报告基因表达的重组质粒的结构简图如图 1。所构建的重组质粒均具有相同的 Fluc 报告基因,不同重组质粒之间的区别仅在于驱动报告基因的启动子部分。用相应的限制性内切酶对重组质粒进行酶切验证后得到的片段大小分别约为 1 与 5.1 kb、1.25 与 5.1 kb、1.25 与5.1 kb。酶切产物的电泳结果显示的片段大小与预期结果相吻合(图 2)。初步证明了重组质粒构建的正确性。将各个重组质粒所插入的 DNA 片段进行测序,测序结果与 NCBI Genbank 上所公布的相应启动子的序列一致。
2.2 Jurkat 细胞中不同启动子驱动的 Fluc 报告基因相对酶活的检测
将不同启动子驱动的 Fluc 报告基因与内参Rluc 报告基因共同转入 Jurkat 细胞中。24 h 后检测细胞裂解物中荧光素酶 Fluc 及 Rluc 与相应底物反应所产生的荧光强度。根据Dual-Luciferase®Reporter Assay System 说明书,荧光素酶报告基因酶活检测的线性范围为 0.1 ~ 100 万。研究中TK 启动子驱动的 Rluc 报告基因酶活绝对值在2 万 ~ 3 万,不同启动子驱动的 Fluc 报告基因酶活绝对值在 3 万 ~ 70 万,实验所得结果均在检测线性范围之内。质粒 pGL3-MCS、pGL3-CMV、pGL3-EF1α 和 pGL3-UbC 的 Fluc 相对酶活分别为 1.2 ± 0.1、2.8 ± 0.5、22.2 ± 1.0、35.6 ± 5.1(图 3)。所构建的不同启动子驱动的 Fluc 报告基因均以pGL3-MCS 质粒为载体,各个质粒的区别仅在于启动子部分(图 1)。Fluc 的酶活与 Fluc 的表达量成正比,Fluc 表达量的多少是由驱动其表达的启动子活性的强弱决定的。因此,Fluc 酶活的高低是由启动子表达活性的强弱决定的。由以上分析得出,在 Jurkat 细胞中,4 个启动子的表达活性高低为:UbC > EF1α > CMV > SV40。其中,SV40 和CMV 启动子的表达活性分别只有 UbC 启动子的3.4% 和 7.9% 左右。在 Jurkat 细胞中,我们所比较的这 4 个启动子,UbC 启动子的表达活性是最高的,而 SV40 启动子的表达活性是最低的。

图1 不同启动子驱动 Fluc 报告基因表达的重组质粒的结构简图Figure 1 Structure diagram of recombinant plasmids containing Fluc reporter gene driven by different promoter
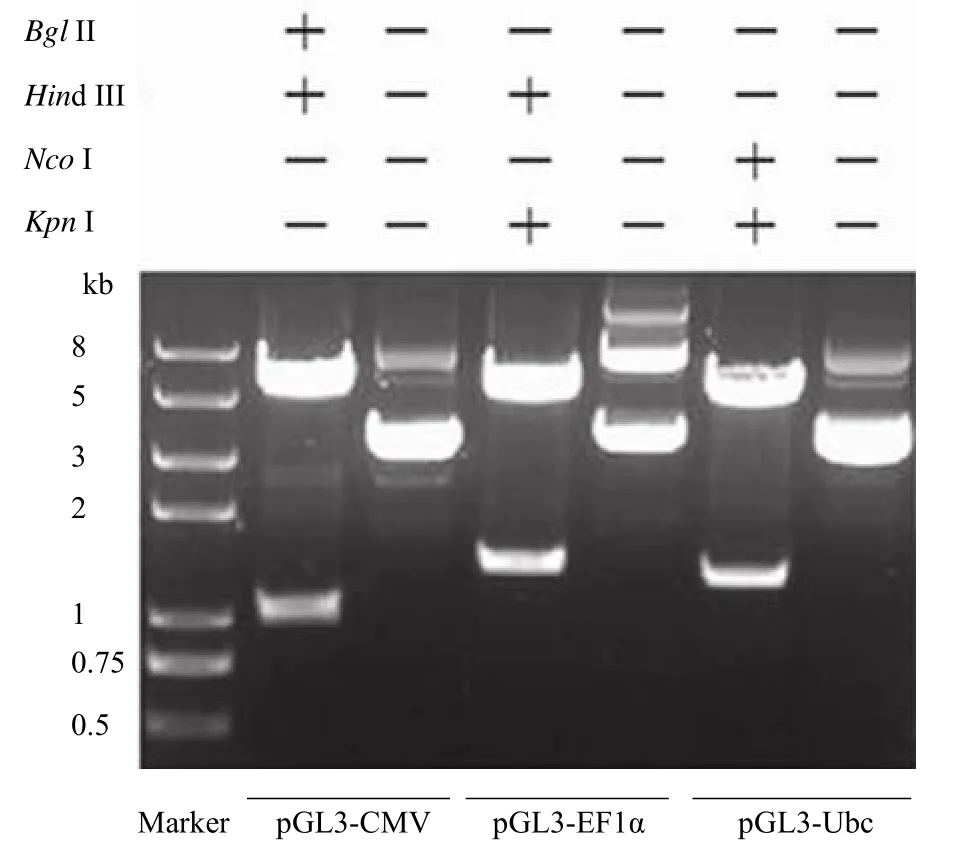
图2 重组质粒双酶切鉴定琼脂糖凝胶电泳图Figure 2 Agarose gel electrophoresis of double digestion of recombinant plasmids
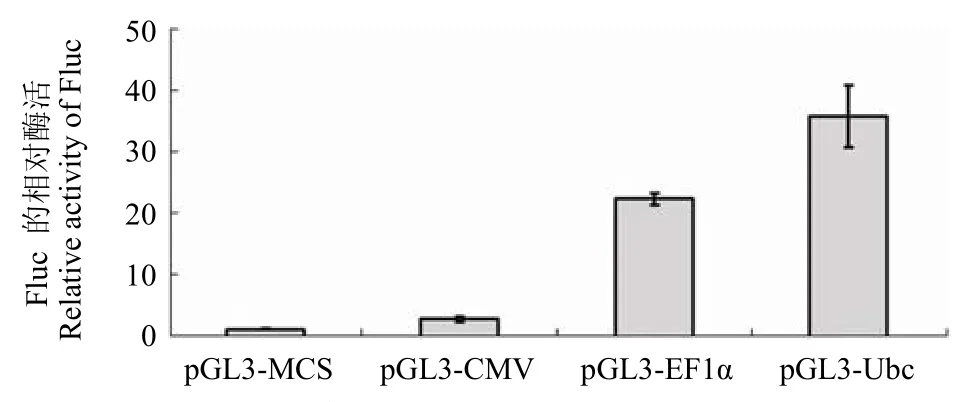
图3 Jurkat 细胞中不同启动子驱动的 Fluc 报告基因相对酶活的检测(结果为 3 次独立实验结果的平均值,误差线表示标准差,P< 0.05)Figure 3 Measurement of relative activity of different promoter-driven Fluc reporter genes in Jurkat cells (Results shown are representative of three independent experiments. Error bars represent the standard deviation.P< 0.05)
3 讨论
双报告基因系统广泛用于研究真核细胞的基因表达和生理特性。应用的范围包括研究受体的活性、转录因子、细胞内的信号、mRNA 加工、蛋白折叠等[13]。双报告基因系统是同时表达和检测单一系统内的两个报告基因。其中,实验报告基因是与实验条件有关的,而内参报告基因则提供一个对内部系统的控制。通过内参报告基因可以校正由移液器的误差和转染效率、细胞活性、细胞裂解效率、细胞检测效率的差异所引起的对实验报告基因的干扰[13]。因此,双报告基因系统可以减少干扰而提供更可靠的实验数据。我们所选择的双报告基因系统中,实验报告基因是 Fluc,内参报告基因是Rluc,该系统中所选用的荧光素酶具有高度的灵敏性和很宽的线性范围,是广泛使用的报告基因[14]。因此,本研究中所采用的双荧光素酶报告基因系统是一种有效、方便和快速的检测方法。
在 Jurkat 细胞中,我们观察到 SV40 和CMV 启动子的表达活性均比较低,而 EF1α 和UbC 启动子的表达活性较高。有文献报道,在不同细胞中,SV40 或 CMV 启动子的活性相差悬殊,这两个启动子并非是驱动哺乳动物细胞中外源基因高效表达的最佳选择[8, 15]。细胞中的一些转录因子和表观遗传修饰,如 NF-κb、DNA 甲基化等,能调控 SV40 和 CMV 启动子的活性[16-17]。如DNA 甲基化可以抑制 Sp1 等转录因子结合到病毒启动子上从而降低其起始转录活性[17],这些因素都有可能影响 SV40 和 CMV 启动子在不同细胞中的表达活性。组成型表达的人源 EF1α 启动子和UbC 启动子是在哺乳动物细胞中广泛使用的启动子[10-12, 15],与病毒启动子相比,其细胞来源的特性以及组成型表达的特点可能使它们更加适合驱动外源基因在哺乳动物细胞中的高效表达。
许多研究中对于启动子的选择通常取决于实验材料的可利用性,而不是实验材料的合适性。为了能在 Jurkat 细胞中高效表达外源基因以利于我们对其在免疫以及癌症等相关疾病功能基因的研究,我们利用双荧光素酶报告基因系统比较了哺乳动物细胞中常用的病毒启动子和人源启动子在Jurkat 细胞中的活性。我们所做的比较可以为选择高表达活性启动子进行外源基因在 Jurkat 细胞中的高效表达提供依据。这对 Jurkat 细胞系更好地应用在免疫以及癌症等相关疾病的研究具有重要意义。
志谢感谢中国科学院上海巴斯德研究所蓝柯研究组、李斌研究组赠予质粒。感谢中国科学院上海生命科学研究院健康科学研究所杨黄恬研究组赠予质粒。
[1] Schneider U, Schwenk HU, Bornkamm G. Characterization of EBV-genome negative "null" and "T" cell lines derived from children with acute lymphoblastic leukemia and leukemic transformed non-Hodgkin lymphoma. Int J Cancer, 1977, 19(5):621-626.
[2] Gillis S, Watson J. Biochemical and biological characterization of lymphocyte regulatory molecules. V. identification of an interleukin 2-producing human leukemia T cell line. J Exp Med, 1980, 152(6):1709-1719.
[3] Weiss A, Wiskocil RL, Stobo JD. The role of T3 surface molecules in the activation of human T cells: a two-stimulus requirement for IL 2 production reflects events occurring at a pre-translational level. J Immunol, 1984, 133(1):123-128.
[4] Levine M, Tjian R. Transcription regulation and animal diversity. Nature, 2003, 424(6945):147-151.
[5] Ramezani A, Hawley TS, Hawley RG. Lentiviral vectors for enhanced gene expression in human hematopoietic cells. Mol Ther, 2000, 2(5):458-469.
[6] Keating A, Horsfall W, Hawley RG, et al. Effect of different promoters on expression of genes introduced into hematopoietic and marrow stromal cells by electroporation. Exp Hematol, 1990, 18(2):99-102.
[7] Martin-Gallardo A, Montoya-Zavala M, Kelder B, et al. A comparison of bovine growth-hormone gene expression in mouse L cells directed by the Moloney murine-leukemia virus long terminal repeat, simian virus-40 early promoter or cytomegalovirus immediate-early promoter. Gene, 1988, 70(1):51-56.
[8] Zarrin AA, Malkin L, Fong I, et al. Comparison of CMV, RSV, SV40 viral and Vlambda1 cellular promoters in B and T lymphoid and non-lymphoid cell lines. Biochim Biophys Acta, 1999, 1446(1-2): 135-139.
[9] Kay MA, Li Q, Liu TJ, et al. Hepatic gene therapy: persistent expression of human alpha 1-antitrypsin in mice after direct gene delivery in vivo. Hum Gene Ther, 1992, 3(6):641-647.
[10] Gill DR, Smyth SE, Goddard CA, et al. Increased persistence of lung gene expression using plasmids containing the ubiquitin C or elongation factor 1alpha promoter. Gene Ther, 2001, 8(20):1539-1546.
[11] Wang R, Liang J, Jiang H, et al. Promoter-dependent EGFP expression during embryonic stem cell propagation and differentiation. Stem Cells Dev, 2008, 17(2):279-289.
[12] Lois C, Hong EJ, Pease S, et al. Germline transmission and tissue-specific expression of transgenes delivered by lentiviral vectors. Science, 2002, 295(5556):868-872.
[13] Sherf BA, Navarro SL, Hannah RR, et al. Dual-luciferase TM reporter assay: an advanced co-reporter technology integrating firefly and renilla luciferase assays. Promega Notes, 1996, 57:2-9.
[14] Naylor LH. Reporter gene technology: the future looks bright. Biochem Pharmacol, 1999, 58(5):749-757.
[15] Mao G, Marotta F, Yu J, et al. DNA context and promoter activity affect gene expression in lentiviral vectors. Acta Biomed, 2008, 79(3):192-196.
[16] Bryans M, Kass S, Seivwright C, et al. Vector methylation inhibits transcription from the SV40 early promoter. FEBS Lett, 1992, 309(1): 97-102.
[17] Mehta AK, Majumdar SS, Alam P, et al. Epigenetic regulation of cytomegalovirus major immediate-early promoter activity in transgenic mice. Gene, 2009, 428(1-2):20-24.
Enhancement of exogenous gene expression in Jurkat cells by efficient promoter
YUAN Juan, MOU Zong-chun, YOU Jia, MA Wei-jun
ObjectiveTo select promoters to enhance exogenous gene expression in Jurkat cells.MethodsFirefly luciferase (Fluc)-expressing plasmids driven by different promoters (SV40, CMV, EF1α, UbC) were constructed on the basis of pGL3-MCS. Fluc-expressing plasmids were co-transfected into Jurkat cells with renilla luciferase (Rluc)-expressing plasmid serving as an internal control. The fluorescent signal generated from the reaction of the two luciferases with the respective substrates was measured, and the ratio of fluorescent signal of Fluc and Rluc was calculated, which was defined as the relative activity of the Fluc.ResultsUsing CMV, EF1α and UbC promoters, we constructed pGL3-CMV, pGL3-EF1α and pGL3-UbC recombinant plasmids to express Fluc reporter gene. The relative Fluc’s activity driven by different promoters in Jurkat cells is pGL3-UbC > pGL3-EF1α >pGL3-CMV > pGL3-MCS.ConclusionThe human ubiquitin C promoter efficiently enhances the expression of exogenous gene in Jurkat cells, which facilitates the application of Jurkat cells in the study of mammalian T lymphocytes and immune function.
Jurkat cells; Promoter, regions (Genetics); Genes, reporter; Luciferases
MA Wei-jun, Email: wjma@sibs.ac.cn.
10.3969/cmba.j.issn.1673-713X.2012.04.006
200025 上海交通大学医学院/中国科学院上海生命科学研究院健康科学研究所
马维骏,Email:wjma@sibs.ac.cn
2012-04-16
方法以 pGL3-MCS 质粒为基础构建不同启动子(SV40、CMV、EF1α 和 UbC)驱动萤火虫荧光素酶 Fluc 报告基因表达的重组质粒,并将其与作为内参的表达海肾荧光素酶Rluc 报告基因的质粒共转 Jurkat 细胞,检测 Jurkat 细胞中这两种荧光素酶与相应底物反应所产生的荧光强度,计算Fluc 与 Rluc 荧光强度的比值即 Fluc 的相对酶活,通过比较 Fluc 相对酶活的大小来选取在 Jurkat 细胞中具有高表达活性的启动子。
结果以 pGL3-MCS 质粒为基础成功构建了不同启动子驱动 Fluc 报告基因表达的重组质粒 pGL3-CMV、pGL3-EF1α 和 pGL3-UbC。在 Jurkat 细胞中,不同启动子驱动的 Fluc 报告基因的相对酶活的强弱关系为pGL3-UbC > pGL3-EF1α > pGL3-CMV > pGL3-MCS。
结论可以选择高活性的人源泛素 C 启动子实现外源基因在 Jurkat 细胞中的高效表达,以利于 Jurkat 细胞系在哺乳动物 T 淋巴细胞以及免疫相关功能研究中的应用。
Author Affiliat ions:Institute of Health Sciences, Shanghai Jiaotong University School of Medicine & Shanghai Institutes for Biological Sciences Chinese Academy of Sciences, Shanghai 200025, China (YUAN Juan); Institute of Health Sciences, Shanghai Institutes for Biological Sciences Chinese Academy of Sciences & Shanghai Jiaotong University School of Medicine, Shanghai 200025, China (MOU Zong-chun, YOU Jia, MA Wei-jun)
www.cmbp.net.cn Chin Med Biotechnol, 2012, 7(4):281-285
