IEC 60601-1:2005(通标3.0)在应用于欧盟医疗器械监管时48个常见问题和解答(续)
2012-02-06孙卓惠陈蓓金晶
孙卓惠 陈蓓 金晶
1 通用电气医疗集团(北京 100176)
2 北京怡和嘉业医疗科技有限公司(北京 100043)
1.4 协调标准的作用
问:EN 60601-1-1 和 EN 60601-1-4 将处于什么状态?
如果必须遵守通标3.0(2012年6月1日以后),像EN 60601-1-1 或 EN 60601-1-4 这样的并列标准怎么办?他们不再是独立的标准或者它们必须全部与通标3.0 结合吗?
答:首先,通标3.0 不是必须遵守的,2012年6月1日后不会,以后也不会。所有的协调标准都是自愿性的标准。2012年6月1日,通标2.0不再作为满足其覆盖的MDD 基本要求的推定符合性依据,除非有适用的专用标准,该专用标准中引用通标2.0 作为规范性参考文件。2012年6月1日以后,作为独立的协调标准,通标2.0 将在官方公报的列表上取消。
注意,如果你愿意,并列标准可以看作通用标准的延伸和附加部分。通标3.0 的1.3 条清楚地说明“并列标准…应与本标准一起使用”。在官方公报中单独公布并列标准并不意味着这些标准可以作为独立的、单独的标准使用。
EN 60601-1-1 和 EN 60601-1-4 是参照通标2.0 的并列标准。他们的内容已经完全被并入到通标3.0 中。当通标2.0 不能用于符合性验证时,这些并列标准也就不能再用于符合性验证。
问:对于与通标2.0 无关的并列标准会怎样呢?
有些涉及某一类特定的医用电气设备和医用电气系统的并列标准,这些标准的第一版与EN 60601-1:2006 对应,它们正在编制进程之中或已经出版。这些并列标准没有与通标2.0 相应的版本,比如:
EN606010-1-10:是医用电气设备和医用电气系统的有关于生理闭环控制器研发的并列标准(2008年11月27日在官方公告中发布);
EN60601-1-11:是应用于家庭医疗环境的医用电气设备和医用电气系统并列标准(2011年1月18日在官方公告中发布);
EN60601-1-12:是MEE 和MES 应用于急救环境的医用电气设备和医用电气系统并列标准(2011年3月18日批准的IEC 工作项目);
有什么指导性文件,它不是一般性建议,而是与NB 讨论使用这些新的并列标准的特殊问题和使用风险管理的问题吗?这些并列标准将有多长的过渡期?
答:根据通标3.0 的1.3 条,如果一个新的并列标准发布并在官方公告中列出,没有指明过渡期,则自该并列标准发布之日起即成为了规范的标准且应与通用标准一起使用。但是立即就对现有产品实施新的标准是不可能的,因此,如果没有专用标准,我们建议公告机构把自标准被批准为EN 标准日期之后的3年作为过渡期。被批准日期在CENELEC 的网站上(www.cenelec.eu)可以找到。
如果医疗器械有适用的专标,且该专标与通标2.0 兼容,那么新的并列标准不适用于这些器械。
如果器械的专用标准与通标3.0 兼容,且比新的并列标准发布早,那么该并列标准也不适用,因为较早发布的专标不会考虑该新版并列标准。
如果专用标准的修订在新并列标准之后,那么过渡期以专用标准为准。
典型的过渡期是3年。
1.5 专用标准的作用(多重的或后发布的专标)
问:关于X-射线设备有许多标准,请解释一下EN 60601-2-28,EN 60601-2-43,EN 60601-2-44,EN 60601-2-45,EN 60601-2-54,EN 60601-2-63,EN 60601-2-65,和 EN 60601-1-3 如何实施。
答:首先,EN 60601-2-7 和 EN 60601-2-32的内容已经并入通标3.0 或与通标3.0 相应的专用标准中。
EN 60601-2-43,EN 60601-2-44,EN 60601-2-45,EN 60601-2-54,EN 60601-2-63, 和EN 60601 -2-65 标准是各种X-射线系统所用的产品标准,它们不能互相引用。这些标准都引用EN 60601-1-3,它是对所有诊断用X 射线设备的通用要求。当产品的专用标准不足时,可以使用EN 60601-2-28 来做补充。但是,当X 射线球管需要贴CE 标识时,EN 60601-2-28 是个关键的标准。
关于这些标准中哪些标准应适用于哪些设备及其过渡期的详细的讨论,请参考本文件的附录1。
问:如果一个X 射线设备可以用于介入和非介入的过程,有必要同时满足EN 60601-2-43 和EN 60601-2-54 这两个标准吗?
答:首先,EN 60601-2-43 适用,该标准采用了60601-2-54 之中的一些条款。这些相关的条款适用于非介入过程。对于60601-2-54 其他的条款,应基于风险管理过程考虑非介入方面的条款。
问:截至2011年10月,仍然有一些专用标准对应通标2.0,EN 或IEC 没有将这些标准更新适用通标3.0 的计划,是否有专用标准更新的最后期限?如果2012年6月1日后才完成专标的更新,会有什么情况发生呢?
答:不,没有规定专用标准必须更新完成的最后期限。
数量有限的一些标准不再更新以适用通标3.0,或更新过程比较晚。只要官方公告中列出的专用标准对应通标2.0,那么这个“旧版”专标就可以用来做符合性验证。如果IEC 撤销了“旧版”专标而没有新标准代替,那么该标准也会被及时地从官方公告中撤销而没有替代标准。之后,仅有通标3.0和相关的并列标准可以用做推定符合性验证。
因此,建议制造商最好与标准委员会联系,以获得专用标准对应通标3.0 更新的详细信息。
问:2012年6月1日过渡期截止后,即使新版的专用标准(例如EN60601-2-24)没有发布,也要用通标3.0 来做符合性验证吗?
答:专用标准定义了过渡期,只要用于此设备的那个专用标准的过渡期没有到期,作为该专用标准的规范性引用标准,在2012年6月1日之后通标2.0 仍然可以使用。只要涉及通标2.0 的专用标准还在官方公告的列表中,通标2.0 就可以用来作为符合性验证。
问:专用标准EN 13544-1:2007 + A1:2009(呼吸治疗设备-第一部分:雾化系统及其部件)没有修订成与通标3.0 对应,这是欧洲标准, 是“对通过呼吸系统向人体输送气溶胶式药物的雾化系统的详细要求”。该标准以通标2.0 为基础且为专用标准。EN 13544-1:2007 + A1:2009 或通标3.0 哪个更有优先权呢?2012.06.01 后该类产品必须符合通标3.0 吗?
答:目前EN 13544-1:2007 + A1:2009 在官方公告的协调标准列表中,因此根据附录ZA 对所有适用的产品都可以用该标准来推定符合MDD指令中基本要求。该标准是呼吸治疗设备的专标,并参考了其他的标准,尤其参考了通标2.0。简单地说,即使通标2.0 不再是协调标准,也不影响使用EN 13544-1:2007 + A1:2009 推定符合基本要求时引用通标2.0。
只要EN 13544-1(例如:基于通标2.0 的EN 13544-1)没有修订,且只要基于通标2.0 的EN 13544-1 作为符合性验证截止期没过,就没有必要使用通标3.0。将来,当下一版的EN 13544-1是以通标3.0 为基础且老版本的EN 13544-1 符合性验证截止期后,将会适用通标3.0。
问:每一种IEC 或 ISO 的标准都可以作为专用标准从而否决通标3.0 的过渡截止日期2012年6月1日吗?
答:在MDD 范围内,一个标准如果符合以下条件就成为专用标准:
• 在官方公告中列出了那个标准的EN 版本,并
• 规范性引用了通标3.0,并
• 规范性引用通标3.0 或其他相关并列标准,说明通标3.0 或其并列标准的条款X、Y、Z,用以下方式引用:
• 适用,或
• 除…之外适用,或
• 不适用,或
• 被以下要求所代替……
1.6 通标3.0 的过渡期
问:对于一个MEE 来讲,没有涉及通标2.0的专用标准。但是,涉及到该MEE 的与通标3.0关联的新专用标准正在编制过程中。例如
• EN 60601-2-63:牙科口腔外科X-射线设备,
• EN 60601-2-66:助听器和助听系统。
这样的专用标准(EN60601-2-XY)从作为EN 版本的专标发布起,过渡期也是3年吗?
答:如果一个全新的专标发布且列入官方公告中,这样的专用标准没有过渡期的说明。但是,我们推荐公告机构采用自该标准被批准为EN 标准之后的3年作为过渡期。该日期可以在CENELEC 的网站(www.cenelec.eu )中找到。
通常,就像以前说明的那样,专用标准是优先采用的标准。这个原则也适用于过渡期。
如果新的专标在2012年6月1日之前被批准为协调标准,那么在与公告机构商议之后可选择3年作为过渡期。
如果专标在2012年6月1日后被批准为协调标准,那么原则上2012年6月1日后只有通标3.0 及其相关的并列标准才能做符合基本要求验证。但是,新版专标中的信息也可能被使用,见后面回答中提供的表格。
问:有过渡期在2012年6月1日后的专用标准的例子吗?
答:有一些这样的标准,参见欧盟官方公告列表。例如EN60601-2-34(介入过程中使用的X射线设备,过渡截止期是2013年6月1日)。一些专用标准像EN 60601-2-33(用于诊断的磁共振设备)已经发布了基于通标3.0 的版本,但是没有在欧盟官方公告列表列出,可以认为该标准的过渡截止期在2012年6月1日以后。
问:EN 60601-2-49 的过渡期已经公布了吗?
答:目前(2011-09-30)还没有。有很多服务型网站,CENELEC 或EU 委员会向它们提供专用标准在欧洲使用状态或用于MDD 指令的协调标准列表变化的通知。我们建议你订阅这样一个网站。
问:某产品适用EN 60601-2-43,该标准的过渡期截止于2013年6月1日。当通标和并列标准过渡期截止后,该产品能被认为符合通标3.0 及其并列标准吗?
答:不能。当有专用标准时,以专用标注的过渡期为准。请注意,如果打算通过符合性声明的途径获得CE,不能将基于EN 60601-1 不同版本的标准混用。因此,如果2012年6月1日后(2013年6月1日前)使用EN 60601-2-43:2000 来出具符合性声明,应使用通标2.0。
问:某产品符合EN 60601-2-2(高频发生器)和 EN 60601-2-10(神经和肌肉刺激仪)。EN 60601-2-2:2009 已经发布,它符合通标3.0,而目前的EN 60601-2-10 不符合。可以将“旧”的-2-10与参考通标3.0 的-2-2 一起使用吗?
答:原则上,不可能同时宣称符合-2-10 和-2-2,因为那将混用不同版本的通标。但是,制造商可以使用基于通标3.0 的-2-2:2009 和EN 60601-2-10 适用的要素来证明符合MDD 的基本要求。
1.7 公告机构的职责
问:ZLG 文件3.5 A1 对欧盟的公告机构 和MEE 制造商有法律约束力吗?
ZLG 文件3.5A1 用非常清晰的方式表明了有效关系:“过渡截止期结束后制造商没做新的评估或不知道有新的协调标准或专业科学知识的,都是实质没有达到符合性要求的。如果不对这些不符合规定的地方做充分纠正的话,证书必须暂停或撤销。”
这是具有法律约束力的文件吗?企业可以不考虑它吗?确切地说,如果在过渡期结束后,不提供关于通标3.0 的一个逐点详述的协议格式要求的客观证据,NB 会强制暂停或撤销CE 证书吗?在过去的10年间,根据通标2.0 批准的设备没有事故被报告过。根据MDD,遵守协调标准不是强制性的,企业为什么要满足通标3.0 的要求?
答:ZLG*文件3.5 A1 是对ZLG*监督公告机构的指令,公告机构必须遵守。
MDD 的附录1 是基本要求,而MDD 是具有法律约束力的,制造商需要证明符合基本要求的客观证据。
过去10年没有报告过任何事故并不是符合基本要求的客观证据,无法推定符合。请记住,通标2.0的要求反映的是1995年(修订件2)的技术水准。
*ZLG:负责与医药产品和医疗器械有关的卫生防护的德国联邦中央机关。
问:如果使用通标3.0 系列的协调标准不能完全证明符合基本要求,公告机构该如何处理?
答:根据等效原则,除了采用通用标准外,可以用其他手段证明作为满足基本要求的客观证据。因此制造商必须评估,验证和确认的其他手段是否能确保达到通标3.0 同等的安全水平。
如果制造商不完全符合通标3.0,按照审核执行时间,建议公告机构按照行表1(见下页)给出审核结论。
1.8 风险管理的应用
问:通标3.0 的 4.2 条要求依据EN ISO14971实施风险管理,检查风险管理文件来确认符合性。然而,根据MDD 附录II 的 4.1 至4.3 以及 附录III 的 4.1,公告机构必须检验和评价(即评估)风险管理文件,不仅仅是检查。公告机构对风险管理文件的检查/评估需要多深入?
答:MDD 是应用的法规框架,EN60601-1 是一个非常有用的支持工具。医疗器械的公告机构组织(NB-MED)是强制执行MDD 的。
风险管理,或者更确切地说,风险管理的实施由制造商负全部责任,但是由公告机构评估。当公告机构评估风险管理文件时,宜采取合理的做法。
首先,公告机构(简称NB)可以评估制造商实施的整个过程是否基于EN ISO14971 标准,同时评价它是否涵盖了所有可能涉及的潜在危险。
第二,NB 评估风险可接受性是基于:
• 相关国际标准,和/或
• 地方性法规,和/或
• 当前社会价值观/先进技术。
第三,对于通标3.0 中有关风险管理要求的所有条款,公告机构应检查其合理性和技术的一致性。
此外,必要时,公告机构将选择一些风险做更深入的评估。通常可能包括的风险:
A)预计为高风险;
B)制造商使用4.5(等效安全)评价的那些风险;
C)创新技术首次应用时产生的风险;
D)经风险/效益分析后判断为可接受的风险(EN ISO14971:2000 的6.5);
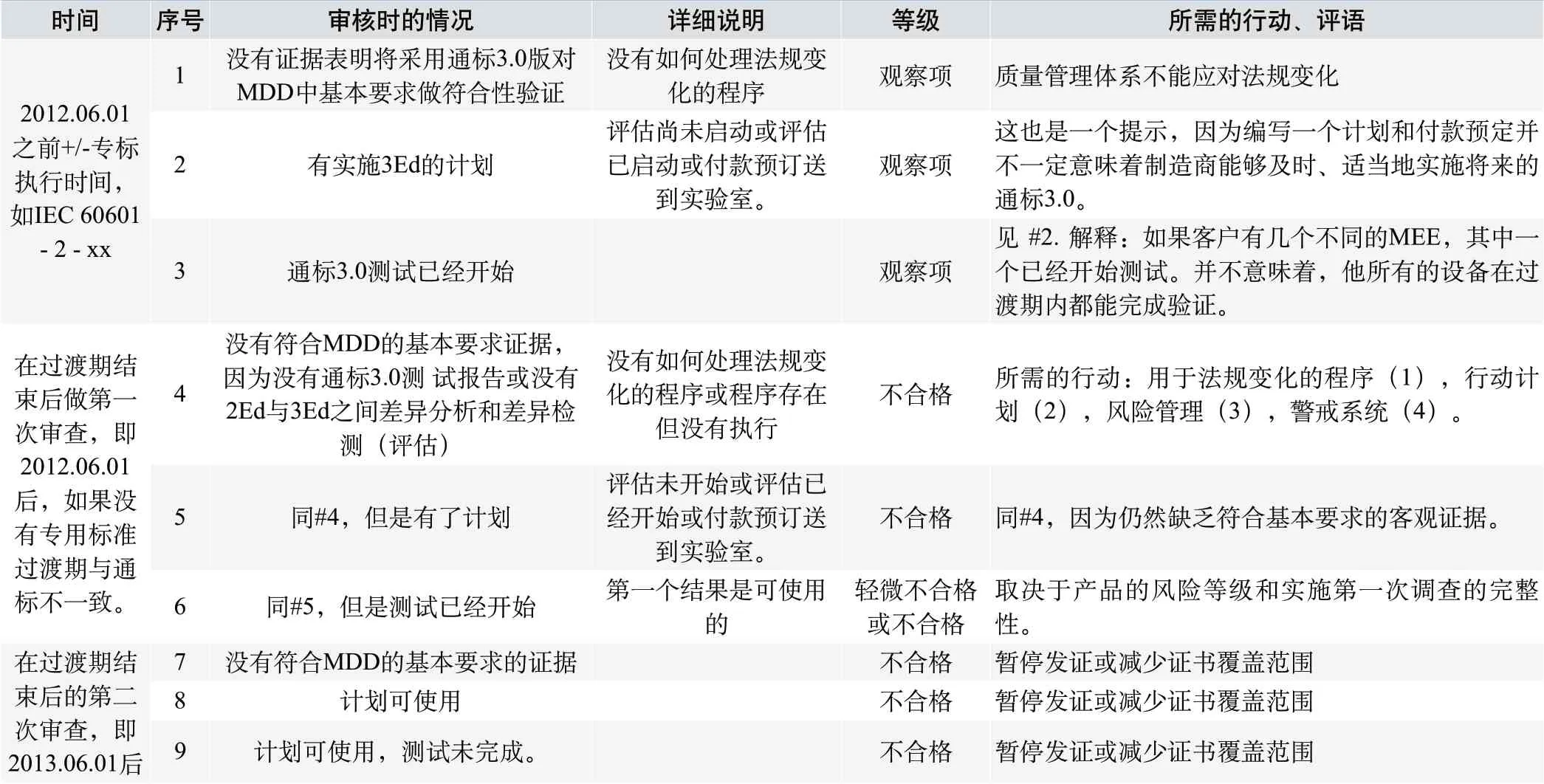
表1.当审核制造商时,推荐公告机构在典型情况下采用的行动和评语
E)根据其损害发生的概率和损害的严重程度判断可接受,但没有实施降低风险措施的风险;
F)公告机构认为需要更深层次评估的风险,例如当对是否采用现有技术发展水平有合理的疑问时。
问:对于风险管理文件检测机构负哪些责任?
答:检查符合通标3.0(包括适用的并列标准和专用标准)的项目,需要100%确认标准的所有适用条款,包括所有风险管理相关的条款。
如果制造商与标准中任何一个可验证的要求有偏差,他必须提供等同安全的证据(见4.5 条款),通常是风险管理过程的结果,这些需要由检测机构验证。
对于新的危害,例如与创新技术相关的危害,制造商有责任将它们纳入到风险管理过程中,同时也要和检测机构一起进行相应的核查。标准的第4.5 条款并不适用于这些危害。
问:如果企业风险管理流程通过EN ISO14971的认证,风险管理文件的评估还需要符合通标3.0吗?
答:是的,既然每一个医疗器械都声称符合通标3.0,那么风险管理文件就需要检查,因为它包含了设备的具体技术信息。根据MDD,附录II的4.1 至4.3 条和附录III 的4.1 条,公告机构必须检查和评估风险管理文件。
注意,对风险管理过程的认证并非通标3.0 和MDD 的要求,它不能取代风险管理文件检查或评估。
问:可以与通标3.0 的要求有偏差吗?
例如:有一个设备符合通标2.0,其报警声不符合最新标准EN60601-1-8。如果这个装置要符合通标3.0 的标准,包括EN60601-1-8:2007,就要有显著不同的报警声。如果设备做了这样一个更新,用在原来的临床环境,那里同时有旧设备,这可能造成一个安全风险,因为对于习惯使用老报警声的临床医生来说,现在使用不同的报警声,而这些报警声具有相同含义,这就会降低使用性。制造商可以证明不改变报警声音是合理的,而设备仍然是符合通标3.0 吗?
答:关于一般问题“可以与通标3.0 的要求有偏差吗”,答案是:是的,即使是通标3.0 也是可以的。然而,大多数通标3.0 的要求并没有与风险管理联系起来,因此如果发生偏差,就需要提供履行条款4.5“同等安全”的客观证据来符合通标3.0。
当通标3.0 被用于证明MDD 的某些需求已经满足,作为满足MDD 要求的结果,该医疗器械可依法加贴CE,并在欧盟市场投放。
当某一个设备放置在一个环境中,由于为了符合报警的要求而产生一个危害处境时,则可以进行修改,以减少这些风险。严格地说,该设备也许不再符合通标3.0 的要求。如果是这样的话,严格地说,仅在这一点上符合性不合格,因此该设备不能加贴CE 标记。然而,如果制造商和用户沟通并共同将这一偏差适当地文件化也是可以接受的。
如果可以预见到上述情况在使用生命周期内会频繁发生而不是偶尔发生,则可以把它放在常规的风险管理中考虑。可以制定一个专门的解决方案,并得到公告机构的同意。这是基于足够的证明文件和进一步安排得出的。例如,公告机构可以要求在所有符合通标2.0 的设备从医院淘汰后,该设备重新编程,以提供新的报警音。
(注:EN60601-1-8:2007 委员会的共同会议召集人指出,与通标3.0 兼容的2007年版允许多个报警方案,因此,可以进行某些适当的改变而仍然保持符合EN60601-1-8:2002。)
问:执行EN14971:2001 版和它的2007 版,风险管理体系会有什么不同结果?
答:2001年首次出版的EN14971 介绍了风险管理的过程,通标3.0 引用的是EN14971 的这个版本。然而,EN14971:2007 是唯一在欧盟的协调版本。但由于标准EN14971 两个版本之间的差异主要集中在其结构上,从技术角度来看其差异是相当微不足道的,因此应该允许实施EN14971:2007 去代替EN14971:2001。
问:医疗器械生产企业原本已经实施了风险管理体系,这些体系许多不是基于通标3.0。在与通标3.0 G 版试验报告模板(下称TRF Rev.G)做对比时已经证明是有问题的。
此时必需使用IEC 60601:2005 TRF Rev.G 做为通标3.0 检测模板吗?
答:公告机构在评估有关符合通标3.0 的风险管理文档时,无论是否使用通标的TRF Rev.G,他们会以适当的深度核实风险管理文件的内容及其相关资料。目前IECEE 的 TRF rev G 是最新可用的TRF。我们推荐使用最新修订的IECEE TRF,因为许多公告机构参与了IECEE CB 方案,并致力于其不断改进。然而,这并不意味着其他形式的关于MDD 的风险管理流程文件不能使用。
1.9 与修改件A1 相关的问题
问:EN 60601-1:2005 有一个修改件正在编制中吗?我们得知,通标3.0 修改件正在筹备中。此修改件A1 将如何适合整个EN60601-1 系列标准,修改件A1 将设3年的过渡期吗?
答:确实是,通标3.0 的第一修改件(A1)在筹备中,这将成为EN60601-1 3.0 的第一修改件。事实上,A1 的CDV(委员会投票稿)2011年8月底已被批准。批准后,预计IEC 将在2012年9月左右公布A1。因为并行的投票,EN 版本最有可能在2012年年底公布。在这种情况下,过渡时期可能会在2015年年底结束。
问:基于通标3.0 的专用标准和并列标准,在有了A1 的情况下,过渡期如何考虑?
答:专用标准是从通标2.0 到通标3.0 过渡期的主要依据。对应EN60601-1 及其并列标准的大部分专用标准都有过渡期。这个日期确定了适用哪一版的通标。如果某个专用标准根据通标3.0的A1 做了改版并且这个专用标准的过渡期已经结束,那么包括A1 的通标3.0 完全适用于该专标所涉及的MEE/ MES。
如果专用标准尚未修订,通常A1 不能用于所涉及的那类MEE / MES。然而,如果A1 能解决存在的技术问题,制造商应该联系他们的公告机构,是否可以采用全部A1 或只是A1 中的那些更正的要求。
问:如何证明对于通标3.0+A1 的符合性?差异分析和风险管理可以证明符合A1 吗?或MEE必须由有资质的检测机构复检?
答:MEE 和MES 声称符合Ed.3 和A1 的需要根据Ed.3 和A1 重新测试。
A1 会修改EN60601-1,通标3.0 和A1 组合起来的新版本3.1 版将公布。随着此修改件的发布,大部分甚至所有并列标准和专用标准将需要修正。因此,A1 将导致一个“新”一代的EN60601-1 系列标准,而这“新”一代的EN60601-1 系列标准不能与通标3.0 混用。
问:通标3.0 的A1 在EU OJ 发布之前,企业可以使用吗?
IEC 公布后,还没有在EU OJ 公布,企业就使用3.1 版,可以吗?A1 引用风险管理和表格较少。在A1 列上协调标准前,企业就直接从通标2.0跳到通标3.0 的A1,可以吗?
答:通标3.0 的修改件A1 尚未公布,因此不能使用。在官方公报上公布之前,它不能用来推定符合MDD 的基本要求。
可是,在跟你的公告机构协商过程中,你可以使用A1 中的解决方案,作为一种例外来证明MDD 的要求已得到满足。正式地说,这种方法不是完全符合3.0 版,但基于A1 是为了解决通标3.0 中的错误和不明确要求,这种特殊的方式可能会被你的公告机构接受。
问:企业可以采用A1 里关于运动过障碍物高度阈值的要求吗?因为这个更容易符合。
9.4.2.4.3 条规定了关于运动过障碍物高度阈值的要求。某企业在修改控制台脚轮使其移动能够超过20mm 的阀值而且没有不可接受的风险时遇到了问题。公告机构通知企业,A1 将降低该阈值,从20mm 至10mm。
答:现有的通标3.0 里的阈值测试有一个技术性错误。2011年8月下旬批准的A1 技术委员会投票稿-CDV 纠正了这个错误。阀值已降至10mm,障碍物边缘有一个半径为2mm 圆角。此外,移动的速度加快了一倍,达到0.8m/s。
也可以参考回答前面一个问题。本问题是可以使用A1 给出的值的一个例子,由于A1 已经添加了附加条件,只有与您的公告机构协商后,才能使用。在2012年9月出版A1 后,修改后的测试条件可能会被接受。
[1]Working Document for NBRG,Frequently asked Questions related to the Implementation of EN 60601-1:2006 with respect to MDD 93/42/EEC
[2]IEC 60601-1:2005 Medical electrical equipment–Part 1:General requirements for basic safety and essential performance
