二磷酸腺苷P2Y12受体阻断剂的进展与临床应用评价
2012-02-02张石革北京积水潭医院北京大学第四临床医学院药剂科北京100035
张石革(北京积水潭医院,北京大学第四临床医学院药剂科,北京 100035)
众所周知,在血管内壁不平滑、血管内皮功能减退的情况下,由冠状动脉粥样硬化所形成的不稳定型斑块栓帽破裂可使血管内皮下胶原组织暴露。血小板通过其细胞膜糖蛋白上Ⅰb、Ⅰa/Ⅱa受体、胶原组织结合,发生血小板黏附,随后在胶原、血栓素 A2、二磷酸腺苷(adenosine diphosphate,ADP)、凝血酶、环氧酶等作用下使血小板变形和释放,使其膜糖蛋白上原来被遮盖的整合素GPⅡb/Ⅲa受体暴露,可与纤维蛋白原相结合。血小板通过纤维蛋白原“桥联”作用黏聚成团,形成血小板聚集的最后共同途径,导致血栓形成。由于阻塞部位、程度、机体代偿的差异,产生了不同的后果。当血栓形成使冠状动脉不全阻塞时,引起不稳定型心绞痛;当使冠状动脉完全阻塞或次全阻塞,表现以血小板血栓为主,导致心内膜下损伤,同时伴有体内早期自动溶栓或充分侧支循环等,引起非ST段抬高型心肌梗死(NSTEMI);当血栓形成使冠状动脉完全阻塞或几乎完全阻塞,形成以纤维蛋白为主血栓,出现透壁性心肌损伤,不伴体内早期自动溶栓或充分的侧支循环等时,引起ST段抬高型心肌梗死(STEMI)。
1 ADP受体与其阻断剂的进展
ADP存在于血小板细胞内的高密度颗粒内,当血小板发生凝聚反应时被释放,ADP通过血小板膜上的ADP受体对血小板的形状以及生物学行为产生影响,进一步加速血小板的凝聚过程。
1.1 ADP受体
血小板膜表面的ADP受体有3种亚型,即P2X1、P2Y1、P2Y12受体。P2X1系配体门控离子通道,P2Y1受体存在于血小板和血管内皮细胞,P2Y12受体存在于血小板膜上,且分布数量多于P2Y1,在ADP所诱导的血小板聚集中发挥重要作用[1]。P2Y1、P2Y12分别耦联 Gq和 Gi蛋白,当 P2Y12与 Gi蛋白耦联后,与其激动剂ADP结合,通过激活Gi信号传导抑制腺苷酸环化酶(adenylate cyclase,AC),使细胞内ATP不能有效地转化为 cAMP,从而使血小板内 cAMP升幅下降,在P2Y12受体的协同下,传导信号被放大,促进血小板分泌大量ADP,形成正反馈加速血小板聚集。此外,通过ADP激动该受体,易化纤维蛋白原绑定膜糖蛋白整合素GPⅡb/Ⅲa受体,导致部分可逆的血小板初次聚集与不可逆的血小板再次聚集。因此,P2Y12受体阻断剂可抑制血小板聚集而不影响ADP介导的血管反应,成为噻吩并吡啶类(或非噻吩并吡啶类)抗血小板药的作用靶点[2]。
1.2 ADP-P2Y12受体阻断剂的进展与药理学评价
20世纪80年代,出于对血小板ADP受体的关注,首个ADP-P2Y12受体阻断剂即第1代的噻氯匹定在法国上市,其对ADP所诱导的血小板聚集(包括Ⅰ期和Ⅱ期聚集)具有较强和持久的抑制作用,增加血小板内cAMP水平,抑制胶原、凝血酶、花生四烯酸、前列腺素内过氧化物等所引起的血小板凝聚,其抑制作用可维持整个血小板的生存期并减少血小板的分泌释放。但其起效缓慢,服后48 h起效,1周后达最大效应,当需迅速发挥抗血小板作用时,噻氯匹定无疑是无效的,因此其临床应用价值上已让位于第2代的氯吡格雷。鉴于氯吡格雷在急性冠状动脉综合征(ACS)、急性心肌梗死(AMI)、缺血性脑卒中(Ischemic stroke)、短暂性脑缺血发作(TIA)、经皮冠脉介入(PCI)及外周动脉病的一、二级预防中,具有不可替代、举足轻重的作用,使全球对ADP-P2Y12受体阻断剂的研发速度增快,一系列新药已上市和处于2、3期临床研究中,详见表1。
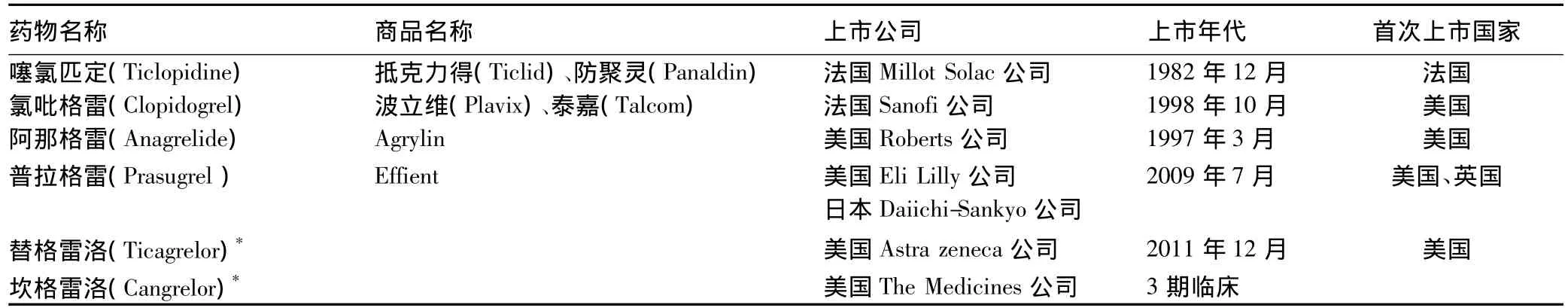
表1 ADP-P2Y12受体阻断剂的上市概况Tab 1 Sales of the adenosine diphosphate P2Y12 receptor antagonists
第2代氯吡格雷为噻氯匹定的类似物,单剂量300 mg顿服后3 h血药浓度既可达峰值。在体内可选择性、不可逆抑制ADP与其他血小板受体的结合及继发的ADP介导的血小板膜蛋白GPⅡb/Ⅲa受体活化,抑制抗血小板的聚集;另氯吡格雷可通过阻断活化血小板释放的ADP引起的血小板激活而进一步抑制血小板聚集。其活性比噻氯匹定强50倍,在体内体外试验均具类似阿司匹林的抑制血小板黏附、聚集和释放作用,可减少猝死和心肌梗死的复发率,作用持续10 h。但其有严重缺陷:(1)作用不够强大。(2)起效较慢,一般需历经数小时,这是应用于AMI、急诊PCI时的主要缺陷。(3)不同人群对氯吡格雷的反应不一。一些患者对氯吡格雷无反应或对氯吡格雷低反应或抵抗[3,4]。
普拉格雷作为第3代噻吩并吡啶类第3代抗血小板药兼血液稀释剂,为一种前药,吸收后迅速转化为活性成分 R-138727,后者与血小板P2Y12受体上半胱氨酸97和半胱氨酸175之间的双硫键结合,发挥抗血小板聚集活性,抑制强度与剂量有关,其具有下列优势:(1)作用持久,起效较快,单剂量60 mg顿服30 min后,可抑制血小板达50%以上,持续时间3 d。其活性代谢物在血浆达峰时间为30 min,血小板聚集抑制率(IPA)可达50%,服后1h可充分发挥疗效[5]。(2)与其他抗血小板药比较,尤其是与氯吡格雷相比,更能显著降低ACS的急性PCI的心血管事件。(3)作用强大,疗效显著,剂量也小。体外试验显示:欲达到同样效果,普拉格雷的剂量仅为氯吡格雷的1/10,为噻氯匹定的1/100。在给予同样的负荷剂量时,普拉格雷30 mg可使IPA达到60.7%,而氯吡格雷300 mg的IPA仅为20%~40%[6]。动物研究表明普拉格雷对ADP(10 μmol·L-1)诱导的血小板聚集的半数抑制浓度(IC50)为 1.2 mg·kg-1,而氯吡格雷的 IC50为 16 mg·kg-1。普拉格雷的抗血小板聚集作用强度为氯吡格雷的10倍以上[7]。(4)不受高脂肪和高热量餐的影响,血浆浓度稳定。(5)普拉格雷个体差异小,主要经羧酯酶1代谢,非经CYP代谢,导致不良相互作用和心血管不良事件相对也少。为了解各种ADP-P2Y12受体阻断剂的差异、起效和维持时间,其药动学参数见表2。作为非噻吩并吡啶类的第3代ADP-P2Y12阻断剂的替卡雷洛、坎格雷洛则有别于上述药物,在体内无需代谢,替卡雷洛作用直接且可逆,作用迅速,不需要通过代谢激活,能有效改善ACS者的症状[8]。坎格雷洛给药途径特异,可迅速抑制血小板的聚集,静脉注射迅速溶栓,其作用不同于其他ADP-P2Y12受体阻断剂:(1)本身已是活性药,起效迅速,疗效稳定。(2)可减少ACS患者血液中血小板-白细胞反应。(3)抗血小板作用强于氯吡格雷,与膜糖蛋白整合素GPⅡb/Ⅲa受体阻断剂相当,能更好地控制出血时间,并增强阿普替酶的纤溶效果。(4)与P2Y12为可逆性结合,降低出血风险。
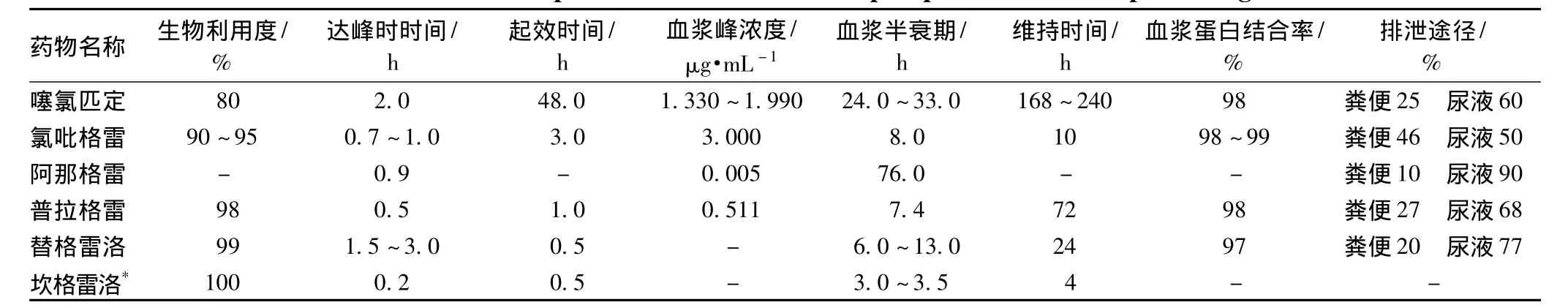
表2 二磷酸腺苷P2Y12受体阻断剂的药动学参数Tab 2 Pharmacokinetic parameters of adenosine diphosphate P2Y12 receptor antagonists
2 ADP-P2Y12受体阻断剂临床应用评价
2.1 氯吡格雷
两项涵盖50 000例患者参与的研究结果提示:氯吡格雷联合阿司匹林的标准治疗可使AMI者显著获益,降低冠状动脉再闭塞率、AMI再发率和死亡率。一项COMMIT/CCS-2试验在中国进行,入选心脏病患者45 652例,于起病24 h内随机接受氯吡格雷75 mg·d-1或安慰剂,平均治疗16 d。主要终点为4周内住院死亡、AMI再发率等指标。与安慰剂组相比,氯吡格雷治疗组主要终点事件减少9%(P=0.002),住院死亡率减少7%(P=0.03),未见有严重出血、脑出血或需输血的大出血病例的增加。同样一项时间跨度为6年的RCT在北美进行,2 116例心血管外(外周动脉病变、脑血管病变者)病变者(ECVD)长期应用氯吡格雷,观察终点为1年的死亡率、AMI、ACS等。结果长期应用氯吡格雷进行干预的终点事件发生的相关危险减少47.9%(95%CI=-4.2% ~73.9%),而非用药者减少18.2%(95%CI=-10.5% ~39.5%)[9]。
2.2 普拉格雷
TRITON-TIMI38试验旨在比较普拉格雷和氯吡格雷用于ACS的疗效和安全性。试验纳入13 608例均为ACS准备作PCI者,其中不稳定型心绞痛、NSTEMI者10 074例,STEMI者3 534例。患者须有缺血症状≥10 min,发生症状须在入选前72 h内,STEMI发生症状须在入选前12 h内。患者随机分为普拉格雷组(n=6 813)和氯吡格雷组(n=6 813),2组基线情况无统计学意义。普拉格雷负荷量为60 mg,随之10 mg·d-1;氯吡格雷负荷量300 mg,随之75 mg·d-1。2组均同时应用阿司匹林75~162 mg·d-1,以心血管死亡、AMI、非致死性卒中为主要终点,随访时间为15个月。结果显示,普拉格雷组有效性终点事件发生率均低于氯吡格雷组(9.9%vs.12.2%,95%CI为0.73~0.90,P<0.01),与氯吡格雷相比,普拉格雷使主要终点发生率降低19%[10]。普拉格雷组AMI发生率显著低于氯吡格雷组(7.3%vs.9.5%,危险性下降24%,P<0.001)。这种差异在术后第3 d即出现并持续至整个随访期,这证实更强抑制ADP介导的血小板激活和聚集确实可进一步减少临床缺血事件的假设。
TRITON-TIMI38还进行了一系列亚组分析。对至少安放1个支架的亚组患者,普拉格雷组(n=6 422)心血管死亡、AMI、需急诊目标血管重建发生率为10.0%,氯吡格雷组(n=6 422)为12.0%(P=0.000 1)。普拉格雷的疗效不受支架类型的影响。对STEMI亚组患者,普拉格雷组的主要终点发生率在早期(30 d内)(6.5%vs.9.5%,P=0.001 7)和整个随访期(10%vs.12.4%,P<0.05)均低于氯吡格雷组;心血管死亡、AMI、需急诊目标血管重建发生率在早期(30 d内)(6.7%vs.8.8%,P=0.02)和整个随访期(9.6%vs.12.0%,P=0.025)亦均低于氯吡格雷组[11]。普拉格雷的不良反应是出血、血小板减少、中性粒细胞减少等。
另一项随机、双盲、交叉研究(PRINCIPLE-TIMI44)证实,普拉格雷组负荷剂量60 mg·d-1比氯吡格雷的负荷剂量600 mg·d-1疗效更佳,IPA分别为74.8%和31.8%。普拉格雷组的维持量10 mg·d-1也比氯吡格雷维持剂量150 mg·d-1疗效更好,IPA分别为61.3%和46.1%[12]。
2.3 替格雷洛
PLATO研究共纳入18 624例ACS患者,比较替格雷洛负荷剂量180 mg,继以1次90 mg,1日2次,维持1年和氯吡格雷负荷剂量300~600 mg,继以75 mg.d-1维持1年,在预防心血管事件发生的疗效。主要疗效终点为第12个月时,由心血管死亡、AMI或脑卒中等心血管事件发生率。次要疗效终点包括:(1)全因死亡、AMI或脑卒中总发生率;(2)心血管死亡。安全性终点为大出血总发生率。研究结果表明,与氯吡格雷相比,替格雷洛治疗12个月后主要终点事件发生率显著降低(9.8%vs.11.17%,HR为0.84,P<0.001)。替格雷洛组无论是心血管病死率还是总体病死率,均明显低于氯吡格雷组,心血管病死率4%vs.5.1%,HR为0.79(P=0.001);总体病死率4.5%vs.5.9%,HR为0.78(P<0.001)。对于安全性,大出血和致死性出血、TIMI大出血、需要输红细胞、致死性出血方面,替格雷洛组和氯吡格雷组之间无统计学意义[13]。
对于拟进行非侵入性治疗的ACS者,入院接受替格雷洛治疗后获益明显要优于氯吡格雷。研究结果提示,ACS者不管接受何种治疗策略的替格雷洛均有广泛获益。
PLATO试验研究中有5 216例(28%)拟进行非侵入性治疗,随机接受替格雷洛(n=2 601)和氯吡格雷(n=2 615)治疗。观察终点包括心血管死亡、心肌梗死、脑卒中和1年内严重出血事件。5 216例患者中,部分患者最终还是接受侵入性治疗,如1 065例(20.4%)进行PCI治疗,208例(4.0%)的患者进行冠脉搭桥术。在随访末期,总共有3 143例(60.3%)患者进行非侵入性治疗。主要终点的发生率上,替格雷洛要低于氯吡格雷(12.0%vs.14.3%,HR为0.85,P=0.04),总死亡率也降低(6.1%vs.8.2%,HR 为 0.75,P=0.01)[14]。几项循证研究的结果见表3[15]。
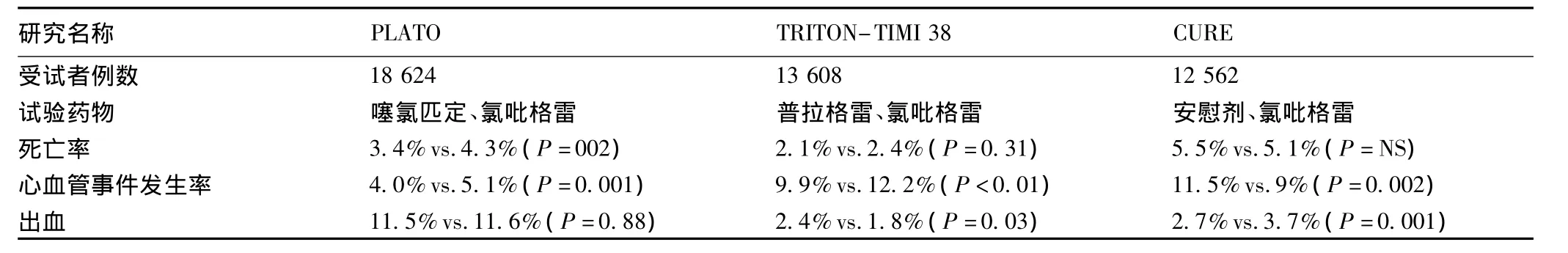
表3 3项循证研究中ADP-P2Y12受体阻断剂治疗急性冠状动脉综合征的疗效Tab 3 Efficacy of adenosine diphosphate P2Y12 receptor antagonists in acute coronary syndromes revealed in three randomized trials
2.4 坎格雷洛
一项多中心、随机、安慰剂对照的2期临床研究评价399例接受PCI患者使用坎格雷洛的安全性及药效学,研究分2部分进行,第一部分研究有200例受试者参加,在术前给予阿司匹林和肝素的基础上随机接受安慰剂或坎格雷洛(1、2、4 μg·kg-1·min-1)治疗,而第二部分研究中的 199例受试者在术前随机接受坎格雷洛(4 μg·kg-1·min-1)或阿昔单抗治疗。结果表明,第一部分研究中使用坎格雷洛的患者出血发生率为13%,安慰剂组为8%,而第二部分研究中使用坎格雷洛的患者出血发生率为7%,阿昔单抗组为10%,均无统计学意义;在第二部分研究中,坎格雷洛组与阿昔单抗组心血管不良反应发生率相当(7.16%vs.5.13%),且2组对ADP诱导的血小板聚集作用的平均稳态抑制率均为100%;停药后与阿昔单抗组相比,坎格雷洛组患者的血小板聚集程度能更快地恢复到用药前水平,出血时间更短。
8 877例ACS接受PCI者分别给予坎格雷洛或氯吡格雷负荷剂量600 mg,比较初始48 h内心血管事件的发生率为7.5%vs.7.1%(95%CI=0.88 ~1.24,P=0.59)[16]。
另一项双盲、安慰剂对照临床研究纳入5 632例接受PCI者,分别给予坎格雷洛或安慰剂,随后给予负荷剂量氯吡格雷600 mg,观察给药后48 h的初始事件和结果[17],见表4。
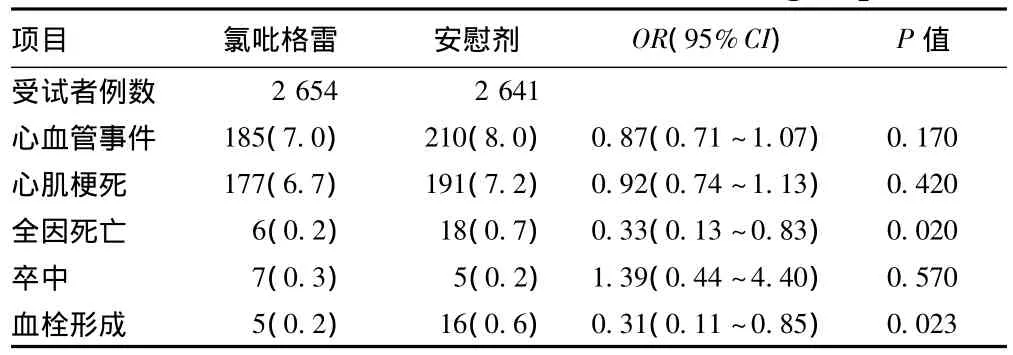
表4 2组初始事件结果Tab 4 Outcome of initial events in two groups
近期还有研究评估在使用阿替普酶同时给予坎格雷洛对冠状动脉开放时间的影响及安全性,92例AMI者随机分为3组,在接受阿司匹林和肝素治疗基础上分别给予坎格雷洛、全量阿替普酶及用药量减为原剂量1/3的坎格雷洛和为原剂量1/2的阿替普酶。结果发现,联用坎格雷洛和阿替普酶与使用全量阿替普酶的效果相当(冠状动脉开放时间为60 min),给药60 min时,联用组中ST段回落大于70%的受试者比例高于单用坎格雷洛组或单用阿替普酶组(28%vs.13%)。
3 ADP-P2Y12受体阻断剂应用中的安全性与监护
3.1 呼吸困难
替格雷洛可致一些新的不良反应,包括呼吸困难、缓慢心律失常、尿酸和肌酐水平升高,且发生率呈剂量依赖性,1次50 mg和100 mg、1日2次组的发生率为10%,200 mg组为16%,400 mg组则为20%,但情况并不严重,亦未发生与心力衰竭、支气管痉挛等相关的症状。在PLATO研究中,仅有0.9%患者因呼吸困难中断替格雷洛治疗,且大多数呼吸困难持续时间<1周。应让患者了解呼吸困难与疾病无关而且是短暂性的,患者会更易耐受。且100例患者中仅1例需要换药,这在任何治疗方案都不少见。总之,PLATO研究显示,不同于以往的噻吩并吡啶类药,替格雷洛是唯一可显著降低ACS者病死率的药物,且在减少心血管事件的同时,无大出血增加,打破了更强抗血小板作用一定伴随出血风险增加的惯性思维。
3.2 出血风险
为减少抗血小板药所致的消化道黏膜损伤,应注意识别高危人群(高龄,有溃疡、出血病史、Hp感染者,联合应用抗血小板药、抗凝血药、非甾体抗炎药、糖皮质激素治疗者)。长期应用抗血小板药阿司匹林、氯吡格雷与华法林时,应将剂量调至最低:阿司匹林 75 ~100 mg·d-1、氯吡格雷 75 mg·d-1,监测抗凝目标值(INR)为2.0左右[18],或同时联合服用胃黏膜保护剂硫糖铝(每日空腹时咀嚼4片)、米索前列醇、雷尼替丁,可有效预防胃肠溃疡、出血和损伤。
3.3 药物抵抗问题
常规剂量的氯吡格雷治疗者有4% ~30%出现氯吡格雷抵抗或称“治疗反应变异”(治疗低反应或无反应性),系指疗效低下、不能达到预期的药效学作用、在治疗任何时间内血小板反应性相对较高(>50%)、心血管事件增加或在接受氯吡格雷治疗中仍有临床事件发生。
各种途径和多因素均对氯吡格雷抵抗产生影响(遗传、内源性、外源性),其中间环节可能是对P2Y12受体的功能状态产生影响,导致血小板对氯吡格雷的反应性降低或抵抗(治疗反应变异)。其中,P2Y12基因多态性是最为主要和密切的原因,基因序列的多态性可影响血小板对ADP的亲和力,包括:(1)H2单倍体,对人体P2Y12基因序列分析发现H1单倍体占86%,H2单倍体仅占14%。但H2与ADP诱导的最大的血小板聚集反应相关。其通过对P2Y12受体的调节,使血小板内的cAMP数量下调,增强该信号传导通路下游事件的级联放大效应。研究发现,H2单倍体携带者更易发生动脉粥样硬化,同时对氯吡格雷的反应性下降。因为氯吡格雷仅对P2Y12受体产生部分抑制作用,这些P2Y12受体活性增强的患者发生氯吡格雷抵抗的几率会显著增加。(2)34C>T突变型等位基因可能会增加个体对冠心病的易感性及个体凝血系统活化水平,因此,ADP介导的血小板反应性下降可能会在治疗过程中因氯吡格雷对P2Y12受体亲和力下降等原因导致其抗血小板能力减弱。此外,34C>T基因突变可能使mRNA的稳定性增加,使得血小板表面P2Y12受体上调,从而因维持剂量的氯吡格雷相对不足而发生“抵抗”现象[19]。(3)CYP3A的基因多态性,CYP3A4活性与个体的遗传因素密切相关。基因变异可使mRNA产生更大的稳定性,导致血小板表面受体密度更大,进一步导致标准剂量的氯吡格雷作用不足,产生氯吡格雷抵抗。(4)肝酶CYP2C19多态性(25个)。此外,CYP2C19*17等位基因携带者与血小板聚集值(P<0.001)和出血的发生率(P=0.006)独立相关,CYP2C19*17等位基因携带者,可显著增加出血风险[20]。(5)胰岛素抵抗和肥胖、血糖控制不达标。(6)联合用药,大环内酯类抗菌药物、三唑类抗真菌药(伊曲康唑)、他汀类调节血脂药(阿托伐他汀)、免疫抑制剂(环孢素)、二氢吡啶类钙通道阻滞剂等能削弱氯吡格雷抗血小板聚集的能力。
应对抵抗的策略有:(1)适当增加剂量,或PCI术前给予600 mg高负荷剂量,继以75 mg·d-1维持剂量。高负荷剂量相对于常规剂量来说,可更为迅速和有效地抑制血小板聚集,降低NSTEMI者终点事件发生率的风险[21]。(2)联合应用黏蛋白整合素受体阻断剂替罗非班、拉米非班、依替巴肽,直接阻断血小板活化、黏附、聚集的最后通路。(3)若与质子泵抑制剂(PPI)联合应用借以保护胃肠黏膜,尽量选用对CYP2C19影响较小的雷贝拉唑、雷尼替丁及胃黏膜保护剂米索前列醇、硫糖铝。同时两类药宜间隔2个血浆半衰期服用,或晨服氯吡格雷,睡前服用PPI。(4)应用极少经CYP2C19代谢的普拉格雷或替格雷洛。
3.4 联合用药的风险
抗血小板药可致消化道损伤风险增加2~4倍,为减少消化道损伤、溃疡和出血,多提倡联合应用质子泵抑制剂(PPI),以保护胃黏膜。但氯吡格雷与PPI长期合用会增加心脏突发事件及死亡率(增加50%),显著降低抗血小板聚集的效果。氯吡格雷和PPI均经肝酶CYP2C19代谢,氯吡格雷为前药,在体内经脂酶(85%)和肝酶(15%)双重代谢;体内2步代谢均经CYP2C19参与,代谢后约2% ~15%的活性成分与血小板P2Y12受体结合,发挥抗血小板作用,即使受到极小干扰,均影响抗血小板疗效和增加心血管不良事件。但肝酶CYP2C19具多态性(25个),常见CYP2C19*2,约有50%中国人、34%黑人、25%白人、19%美裔墨西哥人携带至少一种功能降低的CYP2C19*2等位基因,他们均为慢代谢者,可与抗血小板药相互竞争CYP2C19、降低疗效、增加心血管不良事件;常见CYP2C19*2、CYP2C19*3和CYP2C19*17,约有50%的中国人、34%的黑人、25%的白人携带至少 1种功能降低的CYP2C19*2等位基因,且均为慢代谢者,可与抗血小板药相互竞争CYP2C19、降低疗效、增加心血管不良事件和脑卒中的风险[22]。
[1] RamarajR,MovahedMR,HashemzadehM.Novel antiplatelet agent ticagrelor in the management of acute coronary syndrome[J].J Interv Cardiol,2011,24(3):199.
[2] Michelson AD.P2Y12 antagonism:promises and challenges[J].Arterioscler Thromb Vasc Biol,2008,28(3):s33.
[3] Angiolillo DJ,Fernandez-Ortiz A,Bernardo E,et al.Variability in individual responsiveness to clopidogrel:clinical implications,management,and future perspectives[J].J Am Coll Cardiol,2007,49(14):1505.
[4] Steinhubl SR.Genotyping,clopidogrel metabolism,and the search for the therapeutic window of thienopyridines[J].Circulation,2010,121(4):481.
[5] Farid NA,Kurihara A,Wrighton SA.Metabolism and disposition of the thienopyridine antiplatelet drugs ticlopidine,clopidogrel,and prasugrel in humans[J].J Clin Pharmacol,2010,50(2):126.
[6] Asai F,Jakubowski JA,Naganuma H,et al.Platelet inhibitory activity and pharmacokinetics of prasugrel(CS-747)a novel thienopyridine P2Y12 inhibitor:a single ascending dose study in healthy humans[J].Platelets,2006,17(4):209.
[7] Sugidachi A,Ogawa T,Kurihara A,et al.The greater in vivo antiplatelet effects of prasugrel as compared to clopidogrel reflect more efficient generation of its active metabolite with similar antiplatelet activity to that of clopidogrel’s active metabolite[J].J Thromb Haemost,2007,5(7):1545.
[8] Scirica BM,Cannon CP,Emanuelsson H,et al.The incidence of bradyarrhythmias and clinical bradyarrhythmic events in patients with acute coronary syndromes treated with ticagrelor or clopidogrel in the PLATO(Platelet Inhibition and Patient Outcomes)trial:results of the continuous electrocardiographic assessment substudy[J].J Am Coll Cardiol,2011,57(19):1908.
[9] Mukherjee D,Topol EJ,Moliterno DJ,et al.Extracardiac vascular disease and effectiveness of sustained clopidogrel treatment[J].Heart,2006,92(1):49.
[10] Wiviott SD,Braunwald E,McCabe CH,et al.Prasugrel versus clopidogrelin patients with acute coronary syndromes[J].N Engl J Med,2007,357(20):2001.
[11] Montalescot G,Wiviott SD,Braunwald E,et al.Prasugrel compared with clopidogrel in patients undergoing percutaneous coronary intervention for ST-elevation myocardial infarction(TRITON-TIMI 38):double-blind,randomised controlled trial[J].Lancet,2009,373(9665):723.
[12] Wiviott SD,Trenk D,Frelinger AL,et al.Prasugrel compared with high loading and maintenance-dose clopidogrel in patients with planned percutaneous coronary intervention:the Prasugrel in Comparison to Clopidogrel for Inhibition of Platelet Activation and Aggregation-Thrombolysis in Myocardial Infarction 44 trial[J].Circulation,2007,116(25):2923.
[13] Mahaffey KW,Wojdyla DM,Carroll K,et al.Ticagrelor compared with clopidogrel by geographic region in the Platelet Inhibition and Patient Outcomes(PLATO)trial[J].Circulation,2011,124(5):544.
[14] Gaglia MA Jr,Waksman R.Overview of the 2010 Food and Drug Administration Cardiovascular and Renal Drugs Advisory Committee meeting regarding ticagrelor[J].Circulation,2011,123(4):451.
[15] RamarajR,Movahed MR,Hashemzadeh M.Novel antiplatelet agent ticagrelor in the management of acute coronary syndrome[J].J Interv Cardiol,2011,24(3):199.
[16] Harrington RA,Stone GW,McNulty S,et al.Platelet inhibition with cangrelor in patients undergoing PCI[J].N Engl J Med,2009,361(24):2318.
[17] Bhatt DL,Lincoff AM,Gibson CM,et al.Intravenous platelet blockade with cangrelor during PCI[J].N Engl J Med,2009,361(24):2330.
[18] Hermosillo AJ,Spinler SA.Aspirin,clopidogrel,and warfarin:is the combination appropriate and effective or inappropriate and too dangerous[J]?Ann Pharmacother,2008,42(6):790.
[19] Fontana P,Dupont A,Gandrille S,et al.Adenosine diphosphate-induced platelet aggregation is associated with P2Y12 gene sequence variations in healthy subjects[J].Circulation,2003,108(8):989.
[20] Sibbing D,Koch W,Gebhard D,et al.Cytochrome 2C19*17 allelic variant,platelet aggregation,bleeding events,and stent thrombosis in clopidogrel-treated patients with coronary stent placement[J].Circulation,2010,121(4):512.
[21] Don CW,Roe MT,Li S,et al.Temporal trends and practice variations in clopidogrel loading doses in patients with non-ST-segment elevation myocardial infarction,from the National Cardiovascular Data Registry[J].Am Heart J,2011,161(4):689.
[22] Holmes DR Jr,Dehmer GJ,Kaul S,et al.ACCF/AHA clopidogrel clinical alert:approaches to the FDA“boxed warning”:a report of the American College of Cardiology Foundation Task Force on clinical expert consensus documents and the American Heart Association endorsed by the Society forCardiovascularAngiography and Interventions and the Society of Thoracic Surgeons[J].J Am Coll Cardiol,2010,56(4):321.
