拟南芥体内水杨酸对砷积累的影响*
2011-11-08刘云霞孙国新
刘云霞 张 卫 孙国新
(中国科学院生态环境研究中心,北京,100085)
拟南芥体内水杨酸对砷积累的影响*
刘云霞 张 卫 孙国新**
(中国科学院生态环境研究中心,北京,100085)
采用拟南芥野生型和水杨酸合成缺失突变体sid2,对砷的积累进行了实验研究.发现两种拟南芥地上部对砷的积累都随着砷暴露浓度的提高和暴露时间的延长而增加,但突变体sid2体内的水杨酸含量低于野生型,其体内积累的砷浓度明显低于野生型;并且野生型体内水杨酸含量与砷浓度存在显著的线型关系(R2=0.76).可能是由于水杨酸参与了植物体内砷的转运或参与调节有关重金属转运和积累相关蛋白的合成,从而造成砷的积累.
拟南芥,砷,水杨酸,相关性.
水杨酸(salicylic acid,SA)作为一种小分子酚类信号物质,广泛存在于植物体中,是植物体内普遍存在的内源信号分子之一[1-3].当植物受到环境胁迫,如干旱、寒冷、病毒侵害、盐、重金属等胁迫时,水杨酸就会发挥作用,调节植物生理功能,提高自身对环境胁迫的抗性[4-8].
砷作为一种致癌物质,会导致人类皮肤、肾脏、肺以及膀胱癌的发病率明显提高[9-10].美国毒物和疾病登记署(ATSDR)公布的最具危险性有毒物质中,砷排名第一位.由于砷和含砷矿山的开采、冶炼,含砷农药的使用,砷化合物作为养殖业饲料添加剂的广泛使用,造成土壤中,特别是农田中砷污染[11-13].中国是受砷污染最为严重的国家之一,特别是我国中南部和西南部的湖南、云南、广西、广东等省区.砷化合物被植物吸收,经食物链进入人体,对人类健康造成严重威胁[14-16].
植物(如拟南芥)在重(类)金属如砷、铅、汞、镍、镉等的胁迫下,体内水杨酸含量会升高[1,17-20].一些研究人员用拟南芥对砷的吸收、积累等方面进行了研究[21-22],发现拟南芥暴露在高浓度砷中,体内水杨酸升高[18],对拟南芥的生长也有一定的抑制作用[23-24].但到目前为止,水杨酸对植物砷吸收和积累的影响,以及拟南芥体内水杨酸含量和积累的砷含量之间的关系仍未见报道.本文采用野生型和水杨酸含量减少的突变体的两种拟南芥,对其吸收和积累砷以及与体内水杨酸含量的关系进行了研究.以期为研究植物吸收砷的机制,以及水杨酸在植物吸收重(类)金属中的作用奠定基础.
1 材料与方法
1.1 拟南芥及培养方法
以模式植物拟南芥野生型(Wild Type,WT)和水杨酸含量减少的突变体(SA induction-deficient,sid2)两种类型作为供试材料[25-26].两种拟南芥在蛭石和花土(1∶1混合)的介质上生长.置于平底托盘上,放在光照培养箱中(MLR-351H sanyo,Japan)培养.培养条件如下:温度22℃;相对湿度70%;16 h光/8 h暗;光照强度250 μE·m-2·s-1.
生长1个月后,将拟南芥移入营养液中[27],开始对其进行砷处理.在营养液中五价砷(Na3AsO4)最终浓度分别为 0、75、150、300 μmol·L-1,每3 d 换一次营养液,每2、4、6 d 取地上部,用超纯水清洗干净,放入-80℃冰箱冷冻储存待用.
1.2 总砷样品的制备及检测
将收获已于-80℃冷冻的植物样品分出部分(4棵相同处理条件下的拟南芥混合成1个样品,每个处理3个重复),去离子水洗净,擦干后称量并记录鲜重.将地上部剪下置于烘箱(70℃)中烘至恒重.烘干样品置于50 mL塑料离心管中,每管加2 mL浓硝酸(优级纯),放置过夜;之后在微波消煮炉(MARS,Matthew Inc.,USA)中进行微波辅助消解,消解程序参照文献[28].简述如下:先在10 min内温度缓慢升至55℃,保持10 min;然后在10 min内升至75℃,保持10 min;最后在10 min内温度升到95℃,保持30 min.冷却后取出,用双蒸蒸馏水稀释至50 mL,混匀,等待检测.
标准物质(灌木枝叶,GBW 07603,地矿部物化探研究所)采用相同的方法,与样品同步进行.消解后样品用超纯水稀释至50 mL,待测.
砷含量采用电感耦合等离子体质谱(ICP-MS)(7500cs型,安捷伦科技有限公司)进行检测[28],铟(In)(m/z 114)作为内标检测仪器运行中的稳定性,同时检测m/z 77、78、82,以确认是否存在生成的Ar40Cl35干扰物,干扰砷的测定.在所有检测过程中,未发现存在干扰.
1.3 水杨酸的样品制备及检测
称取0.5 g新鲜植物样品,在研钵中用液氮研磨成匀浆,用1 mL甲醇溶解并转移至1.5 mL离心管中,漩涡混合器振荡1 min.在4℃下离心(10000×g)15 min,取上清液,在氮吹仪上吹干.加入0.25 mL的三氯乙酸(5%)溶解,振荡2 min.加入0.8 mL乙酸乙酯与环己烷的混合液(1∶1,V/V)萃取2次,转移上层有机相至新的离心管中,将上层有机相氮气吹干,溶解在0.6 mL的液相流动相中.下层水相中加入0.3 mL盐酸(8 mol·L-1),摇匀,密闭,80℃恒温水浴加热1 h,使结合态SA转变为游离态SA.加入相同的萃取剂萃取,氮气吹干,溶解在0.6 mL液相流动相中.过0.45 μm滤膜,置于4℃保存,待测.
水杨酸采用高效液相色谱法(HPLC)(Waters 1525)检测[2].色谱柱为Agilent Zorbax SB-C18(250 mm× 4.6 mm,3.5 μm);流动相以90%的乙酸钠(0.2 mol·L-1,pH 5.5)为水相,以HPLC 级甲醇(10%)为有机相,荧光检测器的激发波长为294 nm,发射波长为426 nm,流动相流速为0.5 mL·min-1,进样体积为10 mL.
2 结果与讨论
2.1 不同浓度的砷对拟南芥生长的影响
不同砷浓度下两种拟南芥的鲜重变化见图1,与对照(未加砷)相比,两种类型拟南芥WT、sid2在75和150 μmol·L-1生长都未受到抑制,而 300 μmol·L-1中两种拟南芥鲜重减少了大约 30%,说明高浓度砷(300 μmol·L-1)对两种拟南芥均产生了明显的抑制作用,但品种间没有差别.高浓度砷对植物有一定毒害作用[29].Lee等报道在培养基中添加250 μmol·L-1的As(Ⅴ),野生型拟南芥的生长被抑制了大约20%,与本文的结果一致[4].其它研究也发现,高浓度的As(Ⅴ)对拟南芥的生长和根长都有一定的抑制作用[23-24].
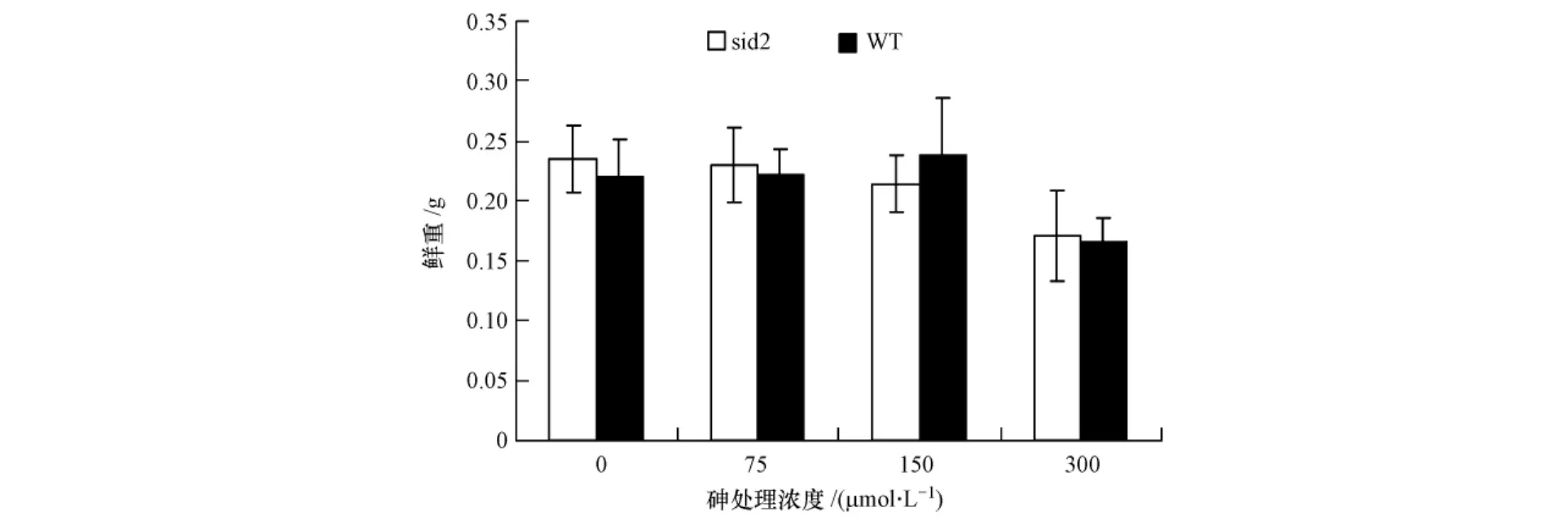
图1 不同砷浓度下两种拟南芥的鲜重(sid2:拟南芥SA突变体;WT:野生型)Fig.1 Fresh weight of two types of Arabidopsis under different As treatment
2.2 拟南芥体内水杨酸的积累
较高浓度的砷对拟南芥来说是一种环境胁迫,而这样的环境胁迫会造成植物的防卫反应,导致水杨酸的合成.因为sid2为水杨酸合成突变体,即水杨酸合成功能缺失,首先检测在砷胁迫下,两种拟南芥体内水杨酸的积累情况.如图2显示,对于野生型(WT),随着培养基砷浓度增加地上部SA的积累量也逐渐增加.Krantev等人观察到,在Cd胁迫下玉米中SA的含量远高于未做任何处理的对照[5],其它研究也发现Cd、Pb的暴露增加了植物中水杨酸的含量[19,17],暗示增加的SA可能与植物降低体内重(类)金属的毒性有关.据Freeman等人报道,在Ni的胁迫下,升高的水杨酸含量可以激发丝氨酸乙酰转移酶的活性,从而提高拟南芥体内谷胱甘肽的含量,进而增加其对Ni的抗性[20].砷作为一种类金属,其造成的胁迫作用与Ni相似,推测由于砷浓度增加,砷对拟南芥的胁迫也增强,植物为了增强其对As的抗性,会合成更多的水杨酸.
但随着砷暴露时间的延长,SA的积累并不是一直增加,与暴露2 d相比,暴露4 d SA的积累相应增加,但暴露6d体内水杨酸含量明显降低.这可能是因为砷暴露时间过长,对植物产生了毒性伤害,从而降低了水杨酸的合成.而sid2体内水杨酸的含量远低于相应的野生型拟南芥.因为该拟南芥为水杨酸合成缺失株,合成水杨酸的能力很差.对于暴露在不同的砷浓度和不同的时间,地上部水杨酸的含量没有明显的差别(图2),在 0.21—0.54 mg·kg-1范围内变化.
2.3 砷浓度和暴露时间对拟南芥地上部砷积累的影响
为了考察不同的拟南芥对砷的积累,检测了拟南芥地上部中的砷含量.无论是WT还是sid2,体内积累的砷都随着营养液中砷浓度的增加和培养时间的延长而增加(图3).在野生型中,当培养基中As达到300 μmol·L-1时,培养2 d As浓度为14.6 mg·kg-1,培养6 d 砷积累达到了53.4 mg·kg-1.Dhankher等人用拟南芥在 100 μmol·L-1As(Ⅴ)的培养基中暴露 3 周,地上部砷积累浓度约为40 mg·kg-1[24].因添加砷的浓度不同,暴露时间也不相同,而这两个因素是造成拟南芥体内砷积累的主要因素,所以不同的文献之间拟南芥对砷的积累也不尽相同.可以肯定,野生型拟南芥对砷有一定的耐受和积累能力.
对于水杨酸合成突变株sid2,与野生型相似,营养液中砷的浓度和暴露时间对其体内的砷浓度有很大影响,随着培养时间的延长和砷浓度的增加而增加.但与野生型相比,sid2地上部积累的砷浓度要低得多(图3).例如在 300 μmol·L-1As(Ⅴ)中暴露6 d,sid2 中砷的积累同样达到最大值23.4 mg·kg-1,但这只是对应的野生型WT中砷积累量的44%,明显低于野生型对砷的积累.因为sid2突变体是由于植物体内产生水杨酸所需基因ics的缺失,导致水杨酸合成路径受阻碍,引起体内水杨酸含量减少的一种突变体[25-26].砷积累减少可能与SA合成有关.但具体原因仍不清楚,需进一步研究.这是首次采用水杨酸合成缺陷的拟南芥研究其对砷的积累,发现其积累能力远低于野生型.
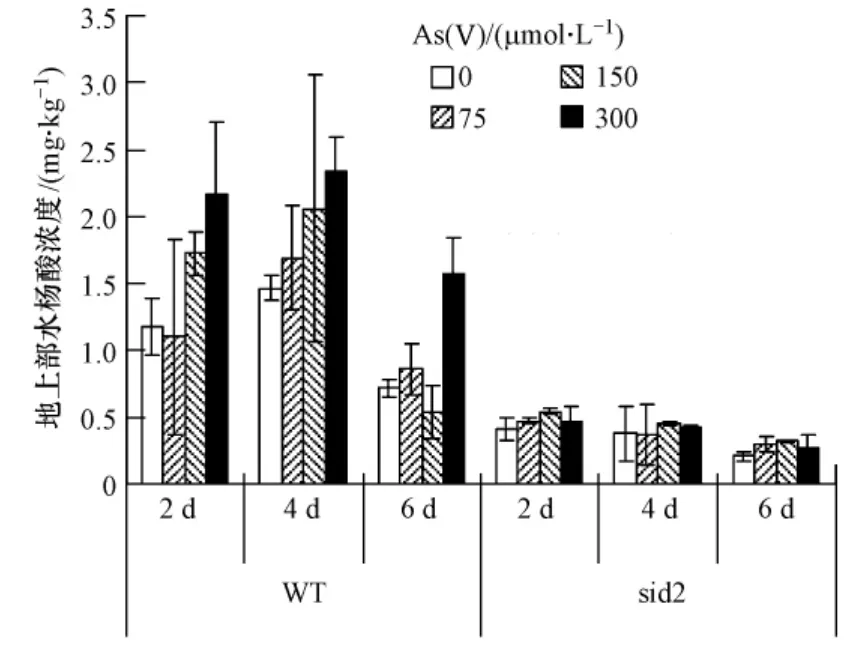
图2 在不同浓度As(Ⅴ)和不同暴露时间下拟南芥地上部水杨酸的积累Fig.2 The accumulation of SA in the shoots of Arabidopsis with the addition of As(Ⅴ)concentration at 0,75,150,300 μmol·L -1in the culture medium
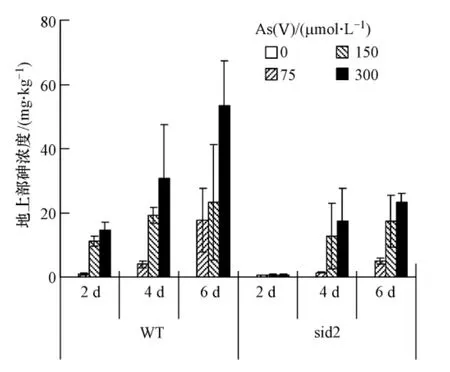
图3 营养液中砷浓度和暴露时间对拟南芥地上部砷积累的影响Fig.3 The effect of As concentration(0,75,150,300 μmol·L -1)in culture medium and exposure time on As accumulation in the shoots of Arabidopsis(WT and sid2)
2.4 水杨酸浓度与积累的砷浓度相关性
在野生型拟南芥的地上部中,砷的积累量与水杨酸浓度呈现较好的线性关系(图4).随着砷积累浓度的提高,体内水杨酸含量也逐渐增加,其相关系数R2达到了0.7567,显示了较好的相关性.据报道,水杨酸与重金属在体外可以形成复杂化合物[27],但这一过程没有在植物体内被证实.可能的原因是,水杨酸参与了植物体内重金属的运输和积累;或者水杨酸作为一种信号分子,参与调节有关重金属转运和积累相关蛋白的合成.体内水杨酸合成增加,合成的相关蛋白也增加,并呈现一定的相关性,从而与地上部砷的积累也呈现相关性.而在水杨酸合成缺失株sid2中,则没有显示出相关性,可能是因为水杨酸合成的缺失,造成体内水杨酸含量的减少,重金属转运或积累相关蛋白合成也降低,从而抑制了拟南芥对砷的吸收和积累,造成拟南芥对砷积累的降低(图2、3).
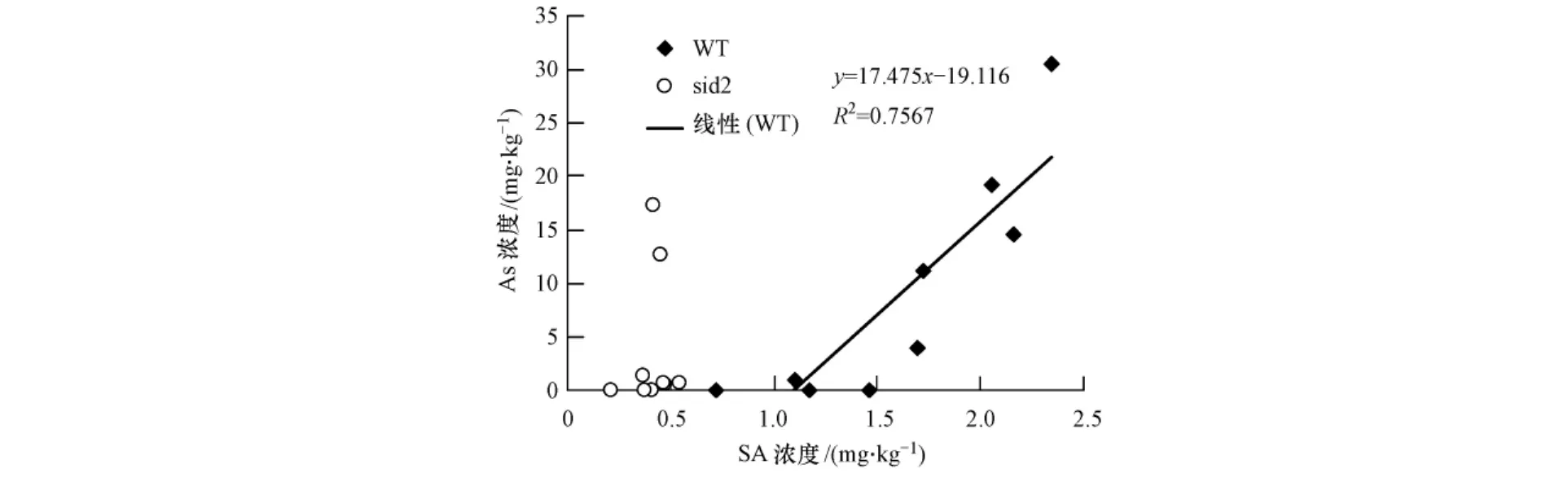
图4 拟南芥地上部水杨酸浓度与积累的砷浓度相关性Fig.4 The relationship between SA concentration and accumulated As in the Arabidopsis shoots
3 结论
拟南芥野生型在As(Ⅴ)胁迫下,地上部体内水杨酸的含量随As(Ⅴ)浓度的提高和暴露时间的延长而增加,但水杨酸合成突变体sid2中水杨酸含量很低,并保持恒定.而二者体内砷含量均随As(Ⅴ)浓度提高和暴露时间的延长而增加,虽然sid2中砷的浓度比野生型中砷浓度低很多.在野生型拟南芥中,砷的浓度与水杨酸含量之间存在明显的线性关系,说明水杨酸可能参与了砷的转运或参与调节有关重金属转运和积累相关蛋白的合成.
[1]陈珍,朱诚.水杨酸在植物抗重金属元素胁迫中的作用[J].植物生理学通讯,2009,45(5):497-502
[2]张卫,孙国新,徐玉新,等.植物体内水杨酸分析方法的探讨及其应用[J].生态毒理学报,2009,4(6):889-897
[3]周莹,寿森炎,贾承国,等.水杨酸信号转导及其在植物抵御生物胁迫中的作用[J].自然科学进展,2007,17(3):305-312
[4]Guo B,Liang Y C,Zhu Y G,et al.Role of salicylic acid in alleviating oxidative damage in rice roots(Oryza sativa)subjected to cadmium stress[J].Environ Pollut,2007,147:743-749
[5]Krantev A,Yordanova R,Janda T,et al.Treatment with salicylic acid decreases the effect of cadmium on photosynthesis in maize plants[J].J Plant Physiol,2008,165:920-931
[6]Loake G,Grant M.Salicylic acid in plant defence-the players and protagonists[J].Curr Opin Plant Biol,2007,10:466-472
[7]Senaratna T,Touchell D,Bunn T,et al.Acetyl salicylic acid(aspirin)and salicylic acid induce multiple stress tolerance in bean and tomato plants[J].Plant Growth Regul,2000,30:157-161
[8]Waldemar Maksymiec.Signaling responses in plants to heavy metal stress[J].Acta Physiol Plant,2007,29:177-187
[9]Lee T C,Tanaka N,Lamb P W,et al.Induction of gene amplification by arsenic[J].Science,1988,241:79-81
[10]Smith A H,Hopenhaynrich C,Bates M N,et al.Cancer risks from arsenic in drinking-water[J].Environ Health Persp,1992,97:259-267
[11]Smith E,Naidu R,Alston A M.Arsenic in the soil environment:a review[J].Adv Agron,1998,64:149-195
[12]Bednar A J,Garbarino J R,Ranville J F,et al.Presence of organoarsenicals used in cotton production in agricultural water and soil of the southern United States[J].J Agric Food Chem,2002,50:7340-7344
[13]Reyes S A,Yenal U,Field J A,et al.Anaerobic biotransformation of organoarsenical pesticides monomethylarsonic acid and dimethylarsinic acid[J].J Agric Food Chem,2006,54:3959-3966
[14]Sun G X,Williams P N,Zhu Y G,et al.Survey of arsenic and its speciation in rice products such as breakfast cereals,rice crackers and Japanese rice condiments[J].Environ Int,2009,35:473-475
[15]Sun G X,Williams P N,Carey A M,et al.Inorganic arsenic in rice bran and its products are an order of magnitude higher than in bulk grain[J].Environ Sci Technol,2008,42:7542-7546
[16]Zhu Y G,Sun G X,Lei M,et al.High percentage inorganic arsenic content of mining impacted and nonimpacted Chinese rice[J].Environ Sci Technol,2008,42:5008-5013
[17]刘素纯,萧浪涛,廖柏寒,等.铅、镉胁迫对黄瓜幼苗内源水杨酸的影响[J].湖南农业科学,2006,3:25-28
[18]Lee D A,Chen A,Schroeder J I.ars1,an Arabidopsis mutant exhibiting increased tolerance to arsenate and increased phosphate uptake[J].The Plant Journal,2003,35(5):637-646
[19]Metwally A,Finkemeier I,Georgi M,et al.Salicylic acid alleviates the cadmium toxicity in barley seedlings[J].Plant Physiol,2003,132:272-281
[20]Freeman J L,Garcia D,Kim D,et al.Constitutively elevated salicylic acid signals glutathione-mediated nickel tolerance in thlaspi nickel hyperaccumulators[J].Plant Physiol,2005,137:1082-1091
[21]Isayenkov S V,Maathuis F J M.The Arabidopsis thaliana aquaglyceroporin AtNIP7;1 is a pathway for arsenite uptake[J].FEBS Letters,2008,582:1625-1628
[22]Catarecha P,Segura M D,Franco-Zorrilla J M,et al.A mutant of the Arabidopsis phosphate transporter PHT1;1 displays enhanced arsenic accumulation[J].The Plant Cell,2007,19:1123-1133
[23]Abercrombie J M,Halfhill M D,Ranjan P,et al.Transcriptional responses of Arabidopsis thaliana plants to As(Ⅴ)stress[J].BMC Plant Biology,2008,8:87-102
[24]Dhankher O P,Rosen B P,McKinney E C,et al.Hyperaccumulation of arsenic in the shoots of Arabidopsis silenced for arsenate reductase(ACR2)[J].PNAS,2006,103(14):5413-5418
[25]Chritiane N,Jean-pierre M.Salicylic acid induction-deficient mutants of Arabidopsis express PR-2 and PR-5 and accumulate high levels of camalexin after pathogen inoculation[J].Plant Cell,1999,1393-1404
[26]Julia D,Lynne R T,Wildermuth M C,et al.Three unique mutants of Arabidopsis identify eds loci required for limiting growth of a biotrophic fungal pathogen[J].The Plant J,2000,24:205-218
[27]Karim M M,Lee H S,Kim Y S,et al.Analysis of salicylic acid based on the fluorescence enhancement of the As(Ⅲ)-salicylic acid system[J].Analytica Chimica Acta,2006,576:136-139
[28]刘文菊,赵方杰.植物砷吸收与代谢的研究进展[J].环境化学,2011,30(1):56-62
[29]丁枫华,刘术新,罗丹,等.基于水培毒性测试的砷对19种常见蔬菜的毒性[J].环境化学,2010,29(3):439-443
THE EFFECT OF SALICYLIC ACID ON ARSENIC ACCUMULATION IN ARABIDOPSIS
LIU Yunxia ZHANG Wei SUN Guoxin
(Research Center for Eco-Environmental Sciences,Chinese Academy of Sciences,Beijing,100085,China)
Salicylic acid plays an important role against metal/metalloid stress to plant.As accumulation in Arabidopsis was investigated by wild type and sid2(salicylic acid induction deficient).Results showed that As accumulation in shoots was increased in both types of Arabidopsis with the increase of exposed As concentration and exposure time.The contents of salicylic acid in sid2 were much lower than those of corresponding wild type and As levels in sid2 were lower than those in the wild type as well.The significant linear relationship(R2=0.76)was observed in this investigation.Probably salicylic acid was involved in the As translocation in plants or in the synthesis of proteins for transferring or accumulating As in plants,which cause As accumulation in the shoots of plants.
Arabidopsis,arsenic,salicylic acid,relationship.
2011年5月13日收稿.
*国家自然科学基金项目(40973058);国家水体污染控制与治理科技重大专项(2009ZX07212-001-05)资助.
**通讯联系人,E-mail:gxsun@rcees.ac.cn
