高浓度葡萄糖条件下罗格列酮对NIT-1细胞增殖、胰岛素分泌水平及IRS-2表达的影响
2011-05-23于冉冉梁瑜祯冯乐平
于冉冉,乔 伟,梁瑜祯,冯乐平*
(1桂林医学院,广西桂林541004;2广西医科大学第一附属医院)
胰岛素抵抗及β细胞凋亡均与胰岛素信号传导障碍有关。近年研究显示,胰岛素受体底物(IRS)-1和IRS-2是胰岛素信号转导途径中的重要活性蛋白,其介导的信号途径是胰岛素发挥生物学作用的必要条件[1],其中IRS-2可调控β细胞生长、调节胰岛素分泌[2]。罗格列酮(噻唑烷二酮类药物)可影响IRS-2表达[3],但葡萄糖浓度对其影响的研究较少。2010年5月~2011年4月,我们观察了不同浓度葡萄糖条件下罗格列酮对胰岛β细胞株NIT-1增殖、胰岛素分泌水平及IRS2表达的影响。现报告如下。
1 材料与方法
1.1 材料 NOD鼠胰岛β细胞株NIT-1(华中科技大学同济医学院馈赠);RPMI1640培养基,10%FBS,无水葡萄糖粉,胰岛素放射免疫分析药盒,鼠尾胶原,二甲基亚砜(DMSO),四甲基偶氮唑蓝(MTT)。
1.2 NIT-1细胞分组与处理 将NIT-1细胞置RPMI1640培养液(含11.1 mmol/L葡萄糖、10%FBS、100 U/L青霉素、100mg/L链霉素)中,至对数生长期后以胰酶消化离心、收集细胞,按5×104个细胞/孔移至24孔培养板,继续培养48 h后分别用葡萄糖浓度为 5.6、11.1、16.7、22.2、27.6 mmol/L 的RPMI1640培养基处理(每组5个复孔),24 h后随机分为对照组、罗格列酮1~3组,分别加入浓度为0、10-7、10-6、10-5mol/L 的罗格列酮培养。
1.3 NIT-1细胞增殖活性、胰岛素分泌水平及IRS-2蛋白表达检测 ①细胞增殖活性:采用MTT法。取1.2各组细胞,用含20%FBS的培养液配成单个细胞悬液,以5 000个/孔接种到96孔板(每孔体积200 μl),培养48 h后每孔加MTT溶液,孵育4 h终止培养,小心吸弃孔内培养上清液,每孔加150 μl DMSO,振荡10min使结晶物充分溶解。选择490 nm波长,在酶联免疫监测仪上测定各孔光吸收值(OD值)。②胰岛素分泌水平:取1.2各组细胞,分别于培养24、48 h后收集细胞上清液,用放射免疫分析方法按试剂盒操作说明检测胰岛素水平。③IRS-2表达:采用Western blot法。细胞至对数生长期后,分别按上述对照组、罗格列酮3组处理方法培养,24 h后提取细胞蛋白;制备SDS-PAGE胶,将蛋白样品经过变性、电泳、转膜和封闭后向PVDF膜上加入抗体孵育,然后用TBST洗涤PVDF膜,在膜上加入Ecl发光显示液,X线片曝光、显影和定影。用一维凝胶电泳分析软件对X线片显影的IRS-2蛋白条带进行Western blot半定量分析,相对表达值=待测定蛋白灰度值/GAPDH灰度值。
1.4 统计学方法 采用SPSS13.0统计学软件进行统计学处理。计量资料以±s表示、行方差分析,检验水准α=0.05。
2 结果
2.1 NIT-1细胞增殖活性 罗格列酮2组和3组细胞增殖活性均显著高于对照组,各组细胞增殖活性在葡萄糖浓度11.1 mmol/L>16.7 mmol/L>22.5 mmol/L >27.6 mmol/L,见表1。
表1 不同葡萄糖浓度下四组NIT-1细胞增殖活性(n=5,OD 值,±s)

表1 不同葡萄糖浓度下四组NIT-1细胞增殖活性(n=5,OD 值,±s)
注:与对照组比较,*P<0.01
葡萄糖浓度(mmol/L) 罗格列酮1组 罗格列酮2组 罗格列酮3组 对照组5.6 0.166±0.023 0.216±0.023*0.212±0.014*0.128±0.002 11.1 0.217±0.032 0.233±0.016*0.229±0.018*0.212±0.025 16.7 0.175±0.049 0.218±0.034*0.233±0.027*0.162±0.012 22.5 0.144±0.032 0.185±0.045*0.193±0.015*0.131±0.014 27.6 0.132±0.081 0.174±0.076*0.188±0.026*0.119±0.035
2.2 NIT-1细胞胰岛素分泌水平 不同葡萄糖浓度下四组细胞胰岛素分泌水平见表2。在各组同一时间点,胰岛素水平在葡萄糖浓度11.1 mmol/L>16.7 mmol/L >22.5 mmol/L >27.6 mmol/L>5.6 mmol/L。
表2 不同葡萄糖浓度下四组细胞胰岛素分泌水平(n=5,mIU/L,±s)

表2 不同葡萄糖浓度下四组细胞胰岛素分泌水平(n=5,mIU/L,±s)
注:与对照组及葡萄糖浓度为11.1 mmol/L比较,#P<0.05,*P<0.01
葡萄糖浓度(mmol/L) 罗格列酮1组 罗格列酮2组 罗格列酮3组 对照组5.6 24 h 147.12±49.22* 174.34±23.18* 164.56±27.54* 112.21±20.35 48 h 283.18±31.61* 218.23±67.37* 255.54±43.62* 123.21±34.28 11.1 24 h 273.53±58.12 320.52±64.23 302.52±59.73 231.43±34.45 48 h 302.30±57.83 318.47±87.34 364.18±84.88 267.89±79.55 16.7 24 h 248.53±29.24# 259.87±58.14# 273.10±47.32 200.45±55.22 48 h 253.84±75.23 283.38±28.84 314.12±73.62 237.12±36.66 22.5 24 h 222.75±65.24* 241.75±66.84* 232.24±68.13* 165.57±13.43 48 h 253.13±61.46 242.14±45.77 312.52±112.03* 212.22±45.77*27.6 24 h 179.56±45.52* 207.84±27.66* 218.58±25.68* 121.33±25.77 48 h 183.44±65.83# 225.62±74.77* 282.55±77.43*148.34±65.30
2.3 NIT-1细胞中IRS-2表达 不同葡萄糖浓度下罗格列酮3组IRS-2表达水平均显著高于对照组,且前者IRS-2表达水平在葡萄糖浓度11.1 mmol/L>16.7 mmol/L>22.5 mmol/L>5.6 mmol/L>27.6 mmol/L,见表3。
表3 不同葡萄糖浓度下罗格列酮3组和对照组IRS-2表达比较(n=5,±s)
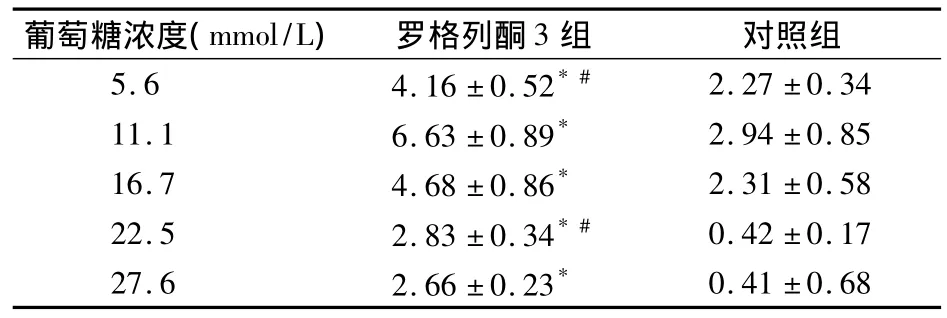
表3 不同葡萄糖浓度下罗格列酮3组和对照组IRS-2表达比较(n=5,±s)
注:与同一葡萄糖浓度对照组比较,*P<0.01;除#标注的两种浓度外,余三种浓度两两比较,P均<0.05
葡萄糖浓度(mmol/L) 罗格列酮3组 对照组5.6 4.16±0.52*#2.27±0.34 11.1 6.63±0.89* 2.94±0.85 16.7 4.68±0.86* 2.31±0.58 22.5 2.83±0.34*# 0.42±0.17 27.6 2.66±0.23*0.41±0.68
3 讨论
长期髙糖毒性将导致胰岛β细胞增殖减弱、胰岛素分泌减少和细胞凋亡增多。以往文献报道,罗格列酮对不同细胞的增殖有不同影响,在肿瘤细胞中可作为过氧化物酶体增殖物激活受体γ(PPARγ)配体从多个方面抑制细胞增殖并诱导细胞凋亡,如上调 p53基因表达、降低 BCL-2表达和激活Caspase-3、Caspase-8 等[4];但其对胰岛 β 细胞的生理作用则众说纷纭[5,6]。本研究显示,四组细胞增殖活性及胰岛素分泌水平均在葡萄糖浓度11.1 mmol/L>16.7 mmol/L >22.5 mmol/L >27.6 mmol/L,其中罗格列酮1~3组细胞增殖活性和胰岛素分泌量均显著高于对照组。提示罗格列酮除可改善胰岛素抵抗外,尚可明显增强NIT-1细胞的增殖和胰岛素分泌功能。本研究还显示,罗格列酮3组在葡萄糖浓度为22.5、27.6 mmol/L培养24 h及葡萄糖浓度为16.7 mmol/L培养48 h时胰岛素分泌水平均显著高于对照组。提示罗格列酮能够在高浓度葡萄糖情况下抑制NIT-1细胞凋亡。
关于罗格列酮抑制高浓度葡萄糖条件下胰岛β细胞凋亡的机制目前尚不完全清楚。有学者认为可能与激活INS/PI3K/PKB(Akt)途径和调节下游信号蛋白表达有关。推测PPARγ受体激动剂除可通过PI3K/AKT信号通路减轻胰岛素抵抗外,尚可调节胰岛细胞增殖和凋亡。有关PPARγ激动剂的研究认为,罗格列酮可通过上调IRS-2表达增强胰岛素敏感性[7]、恢复胰岛素信号传递及细胞正常分化。本研究显示,在不同浓度葡萄糖培养条件下,罗格列酮3组细胞中IRS-2水平均显著高于对照组,且其随葡萄糖浓度变化的趋势与细胞增殖活性、胰岛素分泌水平基本一致。提示罗格列酮保护胰岛β细胞生长和功能的作用与促进IRS-2表达密切相关;机制可能为通过上调细胞PDX-1、NKX6.1、葡萄糖激酶和葡萄糖转运子2表达[8]增加胰岛素分泌、激活INS/PI3K/Akt通路。
综上所述,高浓度葡萄糖条件下罗格列酮可促进NIT-1细胞增殖、胰岛素分泌,机制可能与上调IRS-2表达有关。
[1]Utzschneider KM,Kahn SE.The role of insulin resistance in nonalcoholic fatty liver disease[J].Clin Endocrinol Metab,2006,91(12):4753-4761.
[2]DeFronzo RA,Tripathy D.Skeletal muscle insulin resistance is the primary defect in type 2 diabetes [J].Diabetes Care,2009,32(2):157-163.
[3]Guilherme A,Virbasius JV,Puri V,et al.Adipocyte dysfunctions linking obesity to insulin resistance and type 2 diabetes[J].Nat Rev Mol Cell Biol,2008,9(5):367-377.
[4]Filippatos TD,Derdemezis CS,Kiortsis DN,et al.Increased plasma levels of visfatin/pre-B cell colony-enhancing factor in obese and overweight patients with metabolic syndrome[J].J Endocrinol Invest,2007,30(4):323-326.
[5]Rosen ED,Kulkarni RN,Sarraf P,et al.Targeted elimination of peroxisome proliferator-activated receptorm in β cells leads to abnormalities in islet mass without compromising glucose homeostasis[J].Mol Cell Biol,2003,23(20):7222-7229.
[6]Gurlo T,Haataja LO,Hsueh WA,et al.Activation of peroxisome proliferator-activated receptor-gamma by rosiglitazone protects human islet cells against human islet amyloid polypeptide toxicity by a phosphatidylinositol 3'-kinase-dependent pathway[J].J Clin Endocrinol Metab,2005,90(12):6678-6686.
[7]Lu L,Reiter MJ,Xu Y,et al.Thiazolidinedione drugs block cardiac KATP channels and may increase propensity for ischaemic ventricular fibrillation in pigs[J].Diabetologia,2008,51(4)675-685.
[8]Yamamoto K,Itoh T,Abe D,et al.Identification of putative metabolites of docosahexaenoic acid as potent PPARgamma agonists and antidiabetic agents[J].Bioorg Med Chem Lett,2005,15(3):517-522.
