“红地球”葡萄叶片光合特性对镁素用量的响应
2011-04-16韩艳婷杨国顺石雪晖刘昆玉熊兴耀
韩艳婷,杨国顺,石雪晖,刘昆玉,熊兴耀
(湖南农业大学园艺园林学院,湖南长沙410128)
镁是植物正常生长发育所必须的营养元素之一,对植物具有重要的生理代谢功能,在植物体的光合作用、酶活化、离子平衡、细胞膨压作用、细胞膜稳定以及活性氧代谢等方面均有重要影响[1]。有很多研究表明缺镁严重地影响植物光合作用[2-8],缺镁对叶片光合作用及各分过程的影响被认为是降低植物生长、致使作物产量减少和品质下降的重要原因[9]。缺镁导致叶片光合作用下降在大豆[3]、菜薹[4]、黄瓜[5]、玉米[6]及多年生果树龙眼[7]、锦橙[8]已有研究,但对葡萄光合特性的影响尚未见报道。
白由路等的研究表明,我国土壤有效镁处于严重缺乏或缺乏状态的土壤面积占21%,镁含量较低的区域主要有福建、江西、广东、广西、贵州、湖南和湖北等省份[10]。据雷平对我国南方葡萄设施栽培营养障碍调查表明,葡萄膨大后期常出现中微量元素缺乏症,缺镁尤其严重[11],2009年本实验室对湖南省葡萄种植园调查结果也表明50%以上有缺镁现象。南方葡萄园缺镁的原因主要是镁离子的吸附强度不如其他阳离子,受南方地区高温、多雨及土壤酸性较强等因素的影响,土壤中的镁容易因迁移和淋溶而损失[12],而且葡萄园普遍偏重施用 N、P、K 肥料,有机肥的施用量不足,加上 K+、Ca2+、H+、NH4+、Al3+等离子与镁有拮抗作用[8],每年有大量的镁从土壤中提取而得不到相应的补充,从而使土壤中的镁营养消耗不断扩大,最终导致葡萄缺镁现象在南方各地出现。
“红地球”(Vitis vinifera L.“Red Globe”)是湖南近几年引种成功的欧亚种葡萄优良新品种,随着“红地球”葡萄栽培面积和栽培群体的扩大,镁素需求与供应不足的矛盾在湖南“红地球”设施栽培中日趋明显,致使其生长及果实品质难以提高。本研究以南方广泛种植的主要鲜食品种“红地球”葡萄幼苗为试材,通过测定不同镁素水平对葡萄叶片叶绿体超微结构、叶绿素含量、净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)、胞间CO2浓度(Ci)的影响,探讨葡萄光合作用对镁素水平的响应规律,为明确南方葡萄镁素施用量和进一步弄清镁素对葡萄光合生理的影响提供理论依据。
1 材料与方法
1.1 试验设计与方法
试验于2010年在湖南农业大学葡萄教学基地进行,以长势一致的一年生“红地球”葡萄(Vitis vinifera L.“Red Globe”)幼苗为试材,定植前试材均留6个芽,其它按设施栽培常规管理。于2010年3月10日(萌芽期)定植后进行温室盆栽砂培试验,定植盆盆口直径36cm、盆底直径28cm、盆高34cm,盆底钻四个直径0.5cm的孔,每盆1株,盆内共装23.5 kg洗净消毒的河砂。定植后的植株用不同镁素水平的改良Hoagland营养液浇灌[13]。试验设6个镁素(MgSO4·7H2O)水平,其 浓 度 分 别 为 0 mmol/L、1 mmol/L、2 mmol/L、3 mmol/L、4 mmol/L、5mmol/L,单株区组,重复6次。每3d定量每株浇灌1L营养液,为防止砂培中盐分积累,每次浇灌营养液前用去离子水淋洗1次,每次2L,直到0mmol/L处理的叶片出现明显缺镁症状(约培养90d)后,再进行各项指标的测定,实验各处理均为6次重复。
1.2 测定方法
叶片超微结构:选光合作用测定后的第7片成熟叶切取叶片中部主脉两侧大小0.5mm2~1mm2小块,用2.5%戊二醛前固定,pH7.2磷酸缓冲液冲洗,1%锇酸后固定,梯度乙醇脱水,Epon-812环氧树脂包埋,升温聚合,利用LKBV型超薄切片机切片,醋酸双氧铀、柠檬酸铅双染色,JEM1230 EX透射电镜下观察叶绿体超微结构、形态和分布,测量大小并拍照。每处理观测20~40个视野,取平均值。
叶绿素含量:取植株自生长点之下的第6、8片新鲜叶片,采用乙醇与丙酮1∶1混合冷浸法测定。用UV-1600紫外分光光度计测定645 nm、663 nm处消光值,计算叶绿素a(Chla)、叶绿素 b(Chlb)的含量。
光合参数:取植株自生长点之下的第7片新鲜叶片,选取2个晴朗日,利用 LI-6400型(Li-Cor Inc.,Lincoln,NE,USA)便携式光合作用测定仪在上午10:00左右测定叶片的光合参数,测定时选取葡萄植株的中上部叶片。使用红蓝光源测定,光强恒定为1400μmol/m2·s,叶室温度为28℃,CO2浓度为空气中的浓度,湿度为大气中的湿度。测定参数包括叶片净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)、胞间 CO2浓度(Ci)。
所获数据均采用SPSS软件进行显著性检验和相关性分析。
2 结果与分析
2.1 叶绿体超微结构对镁素用量的响应
叶绿体是植物进行光合作用的场所,完整的叶绿体结构是保证植物进行正常光合作用的前提[14]。表1表明,镁素水平对“红地球”葡萄叶片叶绿体结构影响较大,叶绿体数目、体膜完整度、大小、基粒数和片层数均随镁素处理浓度增加而显著增加,之后又稍有下降或持平,且镁浓度为3mmol/L和4mmol/L时,差异不显著,其它处理间差异显著。在几个不同镁素水平处理中,镁浓度为3mmol/L时,叶肉细胞中的叶绿体数最多,比镁浓度为0mmol/L时多34.58%;镁浓度为5 mmol/L时叶绿体最大,长和宽分别为12.12μm、6.84μm。镁素还影响葡萄叶片叶绿体膜的完整度,按判定标准镁浓度为2mmol/L、3mmol/L、4mmol/L时叶片叶绿体双层膜清晰可见(图1A1),完整度在90%以上,镁浓度为0mmol/L、1mmol/L时叶绿体膜受到破坏,出现双层膜局部解体的现象(图1A2),特别是0mmol/L处理下叶绿体膜被破坏程度达40%左右。基粒数和基粒片层数在镁浓度为3mmol/L、4mmol/L时最多,且基粒片层结构排列紧密整齐(图1B1),1mmol/L处理下开始出现弯曲松散解体的现象,镁浓度为0mmol/L时叶片叶绿体几乎无片层结构(图1 B2),说明缺镁导致叶片类囊体垛叠程度显著降低。
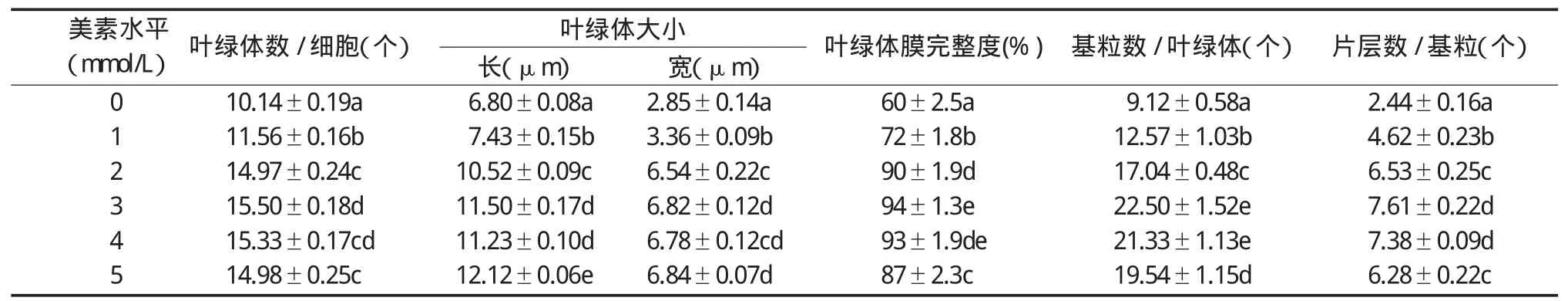
表1 不同镁素水平对“红地球”葡萄叶片叶绿体超微结构的影响
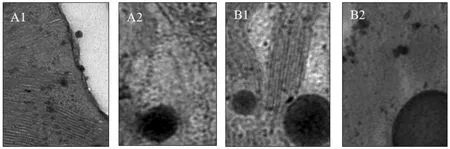
图1 叶绿体膜及基粒片层观察分级标准
2.2 Chla和Chlb对镁素用量的响应
叶绿素是光合作用中重要的和最有效的光能吸收色素,在光合作用过程中起到接受和转换能量的作用[4],叶绿体的破坏也导致叶绿素含量降低[14]。由图2可以看出,不同镁素水平处理下“红地球”葡萄幼苗叶片Chla和Chlb含量整体趋势均表现为单峰曲线,在处理浓度为3mmol/L时达到高峰,镁浓度在0~3mmol/L范围内Chla和Chlb含量随镁浓度增大而增大,差异较大,而后随镁浓度的增加又稍有降低。在镁浓度为0mmol/L时,叶绿体破坏较严重,Chla和Chlb分别比叶绿体结构完整度最高的镁浓度为3mmol/L时低38.31%、45.00%。
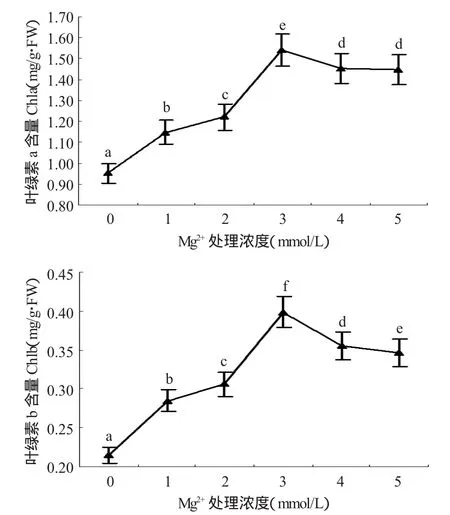
图2 不同镁素水平对“红地球”葡萄叶片Chla和Chlb含量的影响
2.3 Pn和Tr对镁素用量的响应
植物光合作用是植物生产过程中物质积累与生理代谢的基本过程,植物能否正常生长最终取决于光合性能的好坏[6]。不同镁素水平下“红地球”葡萄幼苗叶片Pn和Tr发生了明显的变化,由图3可知,Pn与Tr的变化趋势基本相同,在镁浓度为0mmol/L、1mmol/L、2mmol/L处理时,Pn与Tr随着镁素处理浓度增加而显著增加,之后又逐渐下降。在3mmol/L时达到高峰,Pn与Tr值分别为12.08μmol/m2·s和10.16mmol/m2·s,镁浓度为 0mmol/L、1mmol/L、2mmol/L、4 mmol/L、5mmol/L 处理下Pn和Tr均比镁浓度为3mmol/L处理时低,Pn分别低31.71%、24.34%、13.41%、2.6%和14.57%,Tr分别低 52.85%、42.52%、23.33%、9.74%和10.53%。
2.4 Gs和Ci对镁素用量的响应

图3 不同镁素水平对“红地球”葡萄叶片Pn和Tr的影响
植物叶片气孔是影响植物蒸腾作用的主要因素,Gs、Ci是与气孔开度密切相关的2个值[7]。图4所示,Gs与Pn有相似的变化趋势,即二者均呈先升后降趋势。在镁浓度为0mmol/L~3mmol/L处理范围内,Gs上升较为明显,但镁浓度在3mmol/L~5mmol/L处理时,Gs又开始缓慢下降,其中在镁浓度为3mmol/L时Gs最大,显著高于其它处理,分别比镁浓度为 0mmol/L、1mmol/L、2mmol/L、4mmol/L、5mmol/L 处理时高:56.4%、38.72%、27.44%、4.27%、9.45%。Ci变化趋势也是先升后降,但变化幅度不大,镁浓度为0mmol/L与其它施镁处理的Ci差异显著,处理间差异最大的是镁浓度为0mmol/L、3mmol/L时的Ci,且Ci在镁浓度为3mmol/L时比镁浓度为0mmol/L时高12.29%。
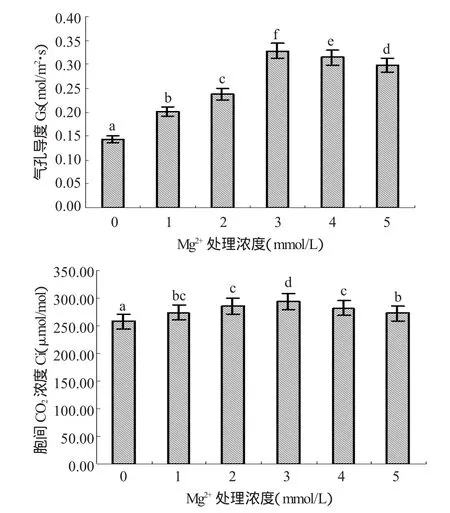
图4 不同镁素水平对“红地球”葡萄叶片Gs和Ci的影响
2.5 光合特性与镁素用量的关系
表2为不同镁素水平处理下“红地球”葡萄叶片气体交换参数、叶绿素的相关系数。分析表明,不同镁素水平同Chl(a+b)、Tr、Ci达到显著正相关性水平;Chl(a+b)同 Pn、Tr、Ci达到极显著正相关水平;Pn同Tr达到极显著正相关水平,同Gs、Ci显著正相关;Tr与Ci达极显著正相关水平。通过不同镁素水平与Chl(a+b)、Pn、Tr、Gs和Ci之间的关系进一步做回归分析可知,镁素用量与Chl(a+b)的非线性关系式为:y=-0.0413x2+0.4231x+0.7573;镁素用量与Pn y=-0.3244x2+2.8381x+5.3257;镁素用量与Tr的非线性关系式为:y=-0.3104x2+3.1398x+1.5273;镁素用量与Gs的非线性关系式为:y=-0.0104x2+0.1071x+0.0363;镁素用量与Ci的非线性关系式为:y=-3.9382x2+30.602x+230.08。
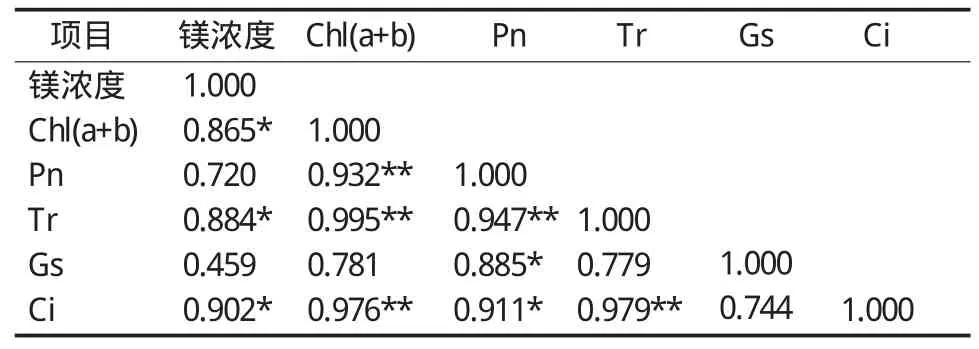
表2 不同镁素水平下“红地球”葡萄叶片光合特性指标的相关分析
3 结论与讨论
3.1 结论
本试验研究表明,镁素用量对葡萄叶片叶绿体结构影响显著,当镁素水平为0mmol/L和1mmol/L时,叶绿体结构受损,基粒片层减少,而其他处理条件下无此现象;葡萄幼苗叶片的 Chla 和 Chlb 含量、Pn、Tr、Gs、Ci均在镁素水平为 3 mmol/L时显著高于其它处理水平;同光合特性指标呈正相关关系。这些结果说明南方缺镁地区适量(约为3mmol/L)施镁可稳定细胞结构、提高叶绿素含量和增强光合作用。
3.2 讨论
叶绿体中基粒片层和基质片层结构的完整有序是保证植物进行正常光合的前提,缺镁对植物叶片细胞超微结构的影响已有报道[16],通过对叶片细胞超微结构的观察发现,0mmol/L~1 mmol/L处理下缺镁症状明显,2mmol/L~5 mmol/L处理下缺镁症状不明显。缺镁症状不明显时与正常叶片在解剖结构上无多大差别,缺镁症状明显时叶绿体是比较敏感的部位。已有研究表明,叶绿素酶存在于叶绿体膜上,而叶绿素蛋白质复合物存在于类囊体上;完整叶绿体的叶绿素酶与叶绿素单独分布,叶绿体受到损伤时叶绿素酶与叶绿素接触,从而使叶绿素降解加速[17]。本试验结果也表明,镁不足导致葡萄叶片叶绿体受到破坏,数目减少,叶绿体膜损伤,基粒片层松散、模糊不清,致使Chla、Chlb的含量降低,从而推断,叶绿体结构变化引起叶绿素合成减少或受阻,促使叶绿素降解,而高镁下Chla、Chlb的含量也降低,可能是高镁打破了葡萄体内离子间的平衡状态,从而影响了植物正常代谢活动。
光合作用是植物生长的重要能量来源和物质基础,叶绿素的多少对光合速率有直接的影响,有研究者指出,叶绿素含量与光合之间一般呈正相关[18],本试验中Chla+Chlb与Pn相关系数为0.932,达到了极显著正相关水平,Chla、Chlb随着供镁浓度增大呈先升后降的趋势,Pn、Tr、Gs和Ci的变化也响应了这一变化趋势,表明镁素调控确对葡萄的光合作用有着重要的影响。
蒸腾是植物重要的生理过程,植物通过蒸腾作用运输矿物质、调节叶面温度、供应光合作用所需要的水分等,与植物Pn关系密切,气孔是植物叶片中最重要的气体交换通道,控制着CO2从叶片的进入和叶片的蒸腾作用,从而间接影响叶片光合作用的进行[19]。本研究表明,在不同镁素水平下,葡萄叶片Pn同Tr、Ci呈显著正相关,说明Pn的变化引起了Tr的变化,而Pn和Tr变化的主要原因是气孔限制引起的。Wong等研究表明[20],Pn与Gs之间有相互关系,Gs影响Pn,Pn对Gs具有反馈调节作用,即在有利于叶肉细胞光合时,Gs增加,不利于光合作用时,Gs减小,本试验结果符合此规律。
[1]Cakmak I,Kirkby EA.Roleofmagnesium in carbon partitioningand alleviating photooxidative damage[J].Physiol Plantarum,2008,133(4):692-704.
[2] Tewari R K,Kumar P,Sharma PN.Magnesium deficiency induced oxidative stress and antioxidant responses in mulberry plants[J].ScientiaHorticulturae,2006(108):7-14.
[3] 王芳,刘鹏,史锋,等.镁对大豆叶片抗氧化代谢的影响[J].中国油料作物学报,2006,28(l):32-38.
[4] 刘厚诚,陈细明,陈日远,等.缺镁对菜薹光合作用特性的影[J].园艺学报,2006,33(2):311-316.
[5] 谢小玉,刘晓建,刘海涛.不同温度下镁胁迫对黄瓜光合特性和活性氧清除系统的影响[J].植物营养与肥料学报,2009,15(5):1231-1235.
[6] 熊英杰,赵立群,钟韬韬,等.外源NO对缺镁胁迫下玉米幼苗生长和离子平衡的影响[J].植物生理学通讯,2010,46(7):707-713.
[7] 李延,刘星辉.缺镁对龙眼光合作用的影响[J].园艺学报,2001,28(2):101-106.
[8] 凌丽俐,彭良志,曹立,等.缺镁对北碚447锦橙光合作用特性的影响[J].果树学报,2009,26(3):275-280.
[9] 杨文,王强盛,王绍华,等.镁肥对水稻镁吸收与分配及稻米食味品质的影响[J].西北植物学报,2006,26(12):247-247.
[10]朱永兴,陈福兴.南方丘陵红壤茶园的镁营养[J].茶叶科学,2000,20(2):95-100.
[11]白由路,金继运,杨俐苹.我国土壤有效镁含量及分布状况与含镁肥料的应用前景研究[J].土壤肥料,2004(2):3-4.
[12]雷平.我国南方葡萄设施栽培营养障碍诊断及优质施肥技术研究[D].浙江:浙江大学,2010:28-30.
[13]Hoagland D R,Arnon D I.The water culture method for prowling plants without soil California Agriculture Experimental Station(Circular347)[M],Berkeley,CA,USA,1950:1-32.
[14]孟凡娟,庞洪影,王建中,等.NaCl和Na2SO4胁迫下两种刺槐叶肉细胞叶绿体超微结构[J].生态学报,2011,31(3):734-741.
[15]汪洪,褚天铎,刘新保.缺镁与正常供镁的菜豆组织结构比较研究[J].中国农业科学,1999,32(4):63-67.
[16]Matile P,Schellenberg M,Vicentini F.Locatization ochlorophyllase in thechloroplastenvelope[J].Planta,1997(201):96-99.
[17]LaingW,Greer D,Sun O,etal.Physiological impactsofMgdeficiency in Pinus radiata growth and photosynthesis[J].New Phytol,2000(146):47-57.
[18]邵玺文,韩梅,韩忠明,等.不同生境条件下黄芩光合日变化与环境因子的关系[J].生态学报,2009(29):1470-1477.
[19]陈家宙,陈明亮,何圆球.土壤水分状况及环境条件对水稻蒸腾的影响[J].应用生态学报,2001,12(1):63-67.
[20]Wong SC,Cowan IR,FarquharGR.Stomatalconductance correlates with photosynthetic capacity[J].Nature,1994(282):424-426.
