HER2基因RNA干扰质粒对SK-BR-3细胞增殖及凋亡的影响
2011-02-24李文浩张成文
韩 冬,徐 煌,李文浩,张成文
(嘉兴学院医学院,浙江 嘉兴 314001)
HER2是一种肿瘤表面抗原,正常成年人的组织中不表达而在多种肿瘤组织中表达[1]。而且HER2的表达与肿瘤的恶性程度及肿瘤患者的预后密切相关。目前已有针对HER2蛋白的单克隆抗体药物上市,用作HER2过表达的乳腺癌的治疗手段,并展现出良好的临床疗效。人们意识到抑制HER2蛋白,可以抑制其下游的细胞信号转导途径,起到控制肿瘤的发生发展的作用,将成为理想的肿瘤治疗策略[2]。由于RNAi技术在实现基因沉默的过程中简便易行,给人们操纵基因提供了强有力的工具,大大地提升了基因治疗的可行性[3]。运用 RNAi技术,在既往的研究中我们构建了三个针对HER2基因的 RNA干扰质粒,通过实时定量PCR技术和western blot方法筛选出了HER2基因沉默效率最高的干扰质粒HER2-shRNA2。在本研究中我们将进一步研究干扰质粒HER2-shRNA2对乳腺癌细胞SKBR-3的HER2基因干扰的生物学效应,主要探讨其对肿瘤细胞增殖和凋亡是否存在影响,为进一步研究乳腺癌的基因治疗提供实验资料。
1 材料与方法
1.1 材料 乳腺癌细胞系SK-BR-3购自中科院上海细胞库,RNAi干扰质粒HER2-shRNA2由本室构建并保存,Lipofectamine2000购自invitrogen公司,RPMI1640细胞培养液购自GIBCO公司,RNase购自TAKARA公司,MTT、胰酶、PBS购自碧云天生物技术研究所。
1.2 方法
1.2.1 转染 人乳腺癌细胞SK-BR-3在RPMI1640 37℃5%CO2条件下培养,在细胞长满80%时进行转染,实验分三组HER2-shRNA2组(转染高效干扰质粒HER2-shRNA2)、RNAi阴性对照组(negative control,转染不针对任何基因的干扰质粒)、空白对照组(blank control,不采取任何措施,直接培养)。转染使用Lipofectam ine2000,具体操作步骤按试剂说明书进行。
1.2.2 绘制细胞增殖曲线 分别取生长良好的HER2-shRNA2组、RNAi阴性对照组和空白对照组的三组细胞,用胰酶消化,用细胞培养液悬浮细胞并调整细胞的数量为1.0×104/ml,均匀接种于63个培养瓶中;每隔24 h每组进行一次细胞计数,每次每组取三瓶细胞分别计数取平均值。根据计数结果以时间为横坐标,以单位细胞数为纵坐标绘制生长曲线。
1.2.3 MTT比色法测定转染后细胞的生长抑制率取对数生长期的乳腺癌细胞SK-BR-3采用胰酶消化后,调整细胞的浓度为1×105/ml,接种于96孔板中,细胞分为三组,分别为HER2-shRNA2组、RNAi阴性对照组和空白对照组,三组质粒各0.2μg分别加Lipofectamine 500μl。各孔加入浓度为5 g/LMTT 20μl,继续培养 4 h,吸去上清,每孔加入 DMSO 100 μl,缓慢震荡10min。每组设三个复孔,分别测定24 h、48 h、72 h、96 h 4个时间点。用酶标仪检测各孔的吸光度值(OD490),按照公式细胞生长抑制率(%)=(1-实验组/对照组)×100%,计算细胞的生长抑制率。
1.2.4 流式细胞仪检测凋亡细胞 分别收集各组转染后的细胞1×106个,离心后用PBS悬浮细胞,1 000 rpm离心10min,再清洗两遍去上清,用70%冷乙醇迅速固定,4℃放置12 h以上后用PBS洗2次,调整细胞浓度为1×106/ml,用 RNase消化,加入1.5m l PI(5 mg/100 ml)对DNA进行染色。混匀后在流式细胞仪分析,G1期峰之前出现的亚峰为凋亡细胞峰,结果以凋亡细胞的百分率表示。
1.2.5 western blot检测乳腺癌细胞SK-BR-3中PCNA的表达量 将转染48小时后的HER2-shRNA 2组 、negative control、blank control组分别用 PBS 洗三次,用细胞裂解液裂解细胞提取总蛋白,取100μg上样进行SDS-PAGE电泳,电泳结束后,将胶上的蛋白用电转化的方法转移至PVDF膜上,封闭过夜,依次加入PCNA单克隆抗体、β-actin抗体为一抗和辣根过氧化酶标二抗,用DAB显色,拍照。
1.2.6 统计分析 实验结果应用SPSS 11.0统计学软件处理数据。
2 结果
2.1 荧光显微镜下观察细胞转染状态 HER2-shRNA2和Negative control组质粒中含有的绿色荧光蛋白基因与干扰序列共表达,可作为转染成功的报告蛋白。在转染24小时后观察到HER2-shRNA2和Negative control组中可见绿色荧光蛋白的表达,说明干扰质粒已经成功的转到细胞当中。而空白对照组,由于不转染含有表达GFP绿色荧光蛋白的质粒,在荧光显微镜下没有观察到绿色荧光。见图1。

图1 培养48 h后各组细胞荧光显微镜下形态(×100)
2.2 计数法绘制细胞增殖曲线 HER2-shRNA2组细胞增殖速度明显比RNAi阴性对照组和空白对照组的增殖速度慢,抑制细胞增殖的现象出现的比较早。在培养的第3天出现了显著差异(P<0.05)。见图2 、3。
2.3 MTT检测细胞生长抑制率 MTT结果显示HER2-shRNA2组在490 nm处的吸光度显著降低,而RNAi阴性对照组和空白对照组吸光度没有明显改变,说明沉默HER2基因后在一定程度上抑制了SKBR-3细胞的增殖。由表1中可以看出HER2-shRNA2转染后48 h、72 h、96 h细胞生长抑制率分别为 16.53%、39.03%、65.47%。
2.4 流式细胞仪检测细胞凋亡 以空白对照组作为对照HER2-shRNA2组在72 h和96 h的凋亡率分别为10.29%,17.36%,HER2-shRNA2组在72h后出现了明显的细胞凋亡峰。而blank control组和negative control组相比无显著性差异。见表2。
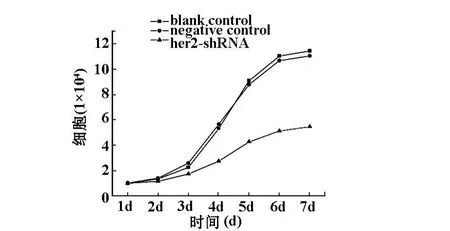
图2 各组细胞增殖曲线

图3 各组细胞增殖第96h细胞形态(×100)

表1 MTT法检测HER2-shRNA2对SK-BR-3细胞增殖的抑制作用

表2 流式细胞检测细胞凋亡
2.5 western b lot检测PCNA的表达 增殖细胞核抗原(PCNA)是反映细胞增殖状态的良好指标。当细胞增殖旺盛时,细胞中的PCNA表达量会很高;而当细胞增殖受到抑制的时候,PCNA的表达量也会相应下降。western blot的结果可知HER2-shRNA 2干扰质粒组的PCNA表达量下降,表明干扰质粒抑制了肿瘤细胞的增殖。见图4。
3 讨论
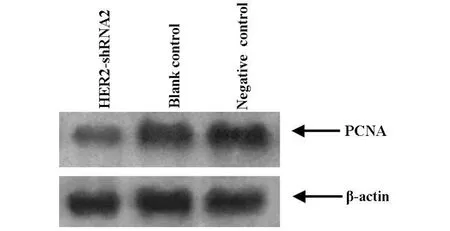
图4 western blot检测不同实验组PCNA的表达
原癌基因HER2其编码产物是具有受体酪氨酸激酶活性的跨膜蛋白,属于表皮生长因子受体家族的成员。HER2激活后会引起一系列细胞信号转导反应,促进肿瘤细胞的增殖,抑制肿瘤细胞的凋亡以及对多种化疗药物产生耐药性[4,5]。HER2的过表达常常提示肿瘤的恶性度高及其预后不良[6]。目前已有针对HER2蛋白的单克隆抗体药物上市,用作HER2过表达的乳腺癌的治疗手段,并展现出良好的临床疗效[7,8]。人们意识到抑制HER2在肿瘤发生发展过程中的作用,将成为理想的肿瘤治疗策略。我们设想如果能通过RNAi的方法降低HER2在乳腺癌中的表达,将会控制肿瘤细胞的生长及其浸润速度,为乳腺癌的治疗提供新方法。
根据RNAi技术特点[9],shRNA和siRNA相比,shRNA在生物体内的稳定性大大提高。siRNA在体内的半衰期只有数天,而shRNA的半衰期可以达到数周甚至数月。因此研究RNAi的长期生物学效应,必须构建可在体内长期发挥作用的干扰质粒。我们在既往的研究中构建了三个针对HER2基因的RNA干扰质粒,并通过实时定量PCR技术和western blot方法筛选出了基因沉默效率最高的干扰质粒HER2-shRNA2。前期的实验只是对shRNA干扰HER2基因的直接效果进行测试,将HER2-shRNA2转染入SKBR-3乳腺癌细胞中出现了HER2mRNA和HER2蛋白表达水平的下降。而HER2基因被抑制后,会产生一系列的生物学反应,其中对细胞增殖和凋亡的影响则是我们关心的焦点。
在本次实验中我们首先对细胞增殖速度进行了定量测定,采用了直接计数法和MTT比色测定两种方法。通过直接计数的方法,我们可以直观的看到shRNA的细胞增殖速度明显比阴性对照和空白对照组慢。而通过MTT比色测定法计算的生长抑制率和直接计数法绘制生长曲线的结果是一致的。进一步的流式细胞仪检测中我们发现,转染HER2-shRNA2干扰质粒组的SK-BR-3细胞大多会停留在G0/G1期,我们知道停留在G0/G1期的细胞会进一步走向凋亡的途径[10],所以最终检测结果中HER2-shRNA2质粒干扰组的细胞凋亡率大大提高。增殖细胞核抗原(PCNA)是DNA聚合酶δ的辅助蛋白,它是反映细胞增殖状态的良好指标。当细胞增殖旺盛时,细胞中的PCNA表达量会很;而当细胞增殖受到抑制的时候,PCNA的表达量也会一定程度的下降。本实验对PCNA进行了western blot检测,western blot的结果可知HER2-shRNA2干扰质粒组的PCNA表达量下降,而在生长旺盛的阴性对照和空白对照组的细胞中PCNA的表达大大增强。PCNA的测定结果解释了,为什么干扰质粒组的细胞生长速度比较慢,而RNAi阴性对照和空白对照组肿瘤细胞生长速度较快。
HER2是一系列信号转导途径的起始分子,它会发动一系列的生物学反应促进肿瘤的生长。本研究结果显示HER2-shRNA2干扰质粒在细胞水平可以抑制HER2基因和HER2蛋白的表达,并促进乳腺癌细胞凋亡,最终控制乳腺癌细胞的增殖速度,可以做为活体动物水平抗肿瘤实验的优选载体,有望开发为新一代抗肿瘤基因药物。
[1]Subik K,Lee JF,Baxter L,et al.The Expression Patterns of ER,PP,HER2,CK5/6,EGFR,Ki-67 and AR by immunohistochem ical analysis in BreastCancer Cell Lines[J].BreastCancer,2010,20(4):35.
[2]ScaltritiM,Baselga J.The epidermal growth factor receptor pathway:a model for targeted therapy[J].Clin Cancer Res,2006,12:5268.
[3]Dykxhoorn DM,Palliser D,Lieberman J.The silent treatment:siRNAsas smallmolecule drugs[J].Gene Ther,2006,13:541.
[4]Engelsen IB,Stefansson IM,Beroukhim R,et al.HER-2/neu expression is associated with high tumor cellproliferation and aggressive phenotype in a population based patient seriesofendometrialcarcinomas[J].Int JOncol,2008,32(2):307.
[5]Mittendorf EA,Liu Y,Tucker SL,et al.A novel interaction between HER2/neu and cyclin E in breast cancer[J].Oncogene,2010,29(27):3896.
[6]TsutsuiS,Ohno S,Murakami S,etal.Prognostic value of C-erbB2 expression in breast cancer[J].JSurg Oncol,2002,79(4):216.
[7]Piccart-Gebhart MJ,Proctor M,Leyland-Jones B,Goldhirsch A,et al.Trastuzumab after adjuvant chemotherapy in HER2-positive breast cancer[J].N Engl JMed,2005,353:1659.
[8]ScheueW,Friess T,BurtscherH,et al.Strongly enhanced antitumor activity of trastuzumab and pertuzumab combination treatment on HER2-positive human xenograft tumormodel[J].Cancer Res,2009,69(24):9330.
[9]Aigner A.Application of RNA interference:current state and prospects for siRNA-base strategies in vivo[J].JAppl Microbiol Biotechnol,2007,76(1):9.
[10]Spidlen J,Shooshtari P,Kollmann TR,et al.Flow cytometry data standards[J].BMC Res Notes,2011,4(1):50.
