二氧化氮对樟树幼苗硝酸还原酶活力和氮元素积累的影响
2010-11-24滕士元陈卓梅杜国坚
滕士元,陈卓梅,杜国坚
(1.吴江市苗圃集团公司,江苏 吴江 215200;2.浙江省林业科学研究院,浙江 杭州 310023)
随着全球机动车数量的不断增多,城市二氧化氮(NO2)污染问题日益突出。植物对于一定浓度的大气污染物不仅具有抵抗能力,而且还具有吸收同化能力。Morikawa等[1]研究了217种天然植物同化NO2的情况,发现不同植物同化能力的差异达 600多倍,可筛选“嗜NOx植物”。硝酸还原酶(NR)是植物氮(N)代谢中一个重要的调节酶和限速酶[2]。前人已开展了关于植物暴露于NO2的生长量、叶绿素含量、N含量及与N代谢相关的酶活性,但多在作物间开展,极少针对园林绿化植物开展。樟树(Cinnamomum camphora)是我国亚热带常绿阔叶林的重要树种,是珍贵用材树种、芳香油类树种及重要园林绿化树种。本文的主要目的是研究在NO2影响下樟树幼苗N元素积累和NR活力,对于评价樟树对NO2的吸收能力具有参考价值。
1 材料与方法
1.1 供试材料
植物材料采用1年生樟树幼苗。樟树种子于2007年3月20日播于沙床。5月,当苗木出土且长出两片真叶时移至容器内,每个容器内1株。容器基质配比为蛭石:泥炭:珍珠岩 = 4.5:4.5:1(质量比)。大棚栽培,及时浇水。
1.2 开顶式熏气装置
开顶式熏气装置采用开顶式自动监控气体体积分数熏气装置,由送风系统、熏气罩和监控系统组成。送气系统采用罐装气体和电磁阀、轴流风机相连,由电磁阀控制气体的停送,由轴流风机将供试气体送入气室。熏气罩用有机玻璃制成,六面柱体,横截面对角线长1.16 m,高1.85 m,顶部敞开,略有收口,在距离底部0.30 m处设置栅板。受试气体首先进入气室栅板下的底部空间,再从栅板上均匀分布的1 200多个直径为12 mm的孔眼自下而上通过气室,使气室内试验气体体积分数均匀,上、中、下、左、右各点位气体体积分数差异不超过5%。监测系统中,有害气体体积分数监测采用在线式监测仪(传感器为瑞士生产,精确度为0.01μL/L)将信号传输到计算机,由计算机根据现实体积分数与目标值的差异发出指令控制电磁阀的开关,将熏气室试验气体体积分数控制在目标值,波动幅度不超过5%,数据采集密度1次/s。
1.3 试验设计
试验共设置了3种体积分数NO2熏气处理,分别为0.1、0.5和4.0μL/L(处理1、处理2、处理3),同时以空气为对照(简称ck)。每个处理设置2个重复,每个重复放置生长基本相同的苗木80株。当苗木已基本生长整齐,且长出8片以上真叶,第3片以下真叶已完全成熟时开始熏气,熏气时间为2007年7月12日至9月11日的8:00-17:00,晚上停止熏气。每15 d测定1次N素含量及NR活力,每个指标重复测定8株,至熏气结束时止。熏气开始前(7月11日)对对照的上述各指标进行测定。
1.4 N含量测定
取顶叶以下第3片起没有明显伤害症状的叶片,去除叶柄和叶脉,洗净,70℃烘干至恒重,粉碎后过80目筛,采用H2SO4—H2O2法消煮,奈氏比色法测定全N含量[3]。
1.5 NR活力测定
采用活体法测定[4]。
1.6 数据分析
所有数据均采用 SPSS统计软件进行分析处理。各处理间差异显著性分析采用单因素方差分析(one-way ANOVA)。方差显著的置信区间为P<0.05。
2 结果与分析
2.1 NO2对樟树幼苗叶片N含量的影响
从图1可以看出,随着熏气时间的推移,处理1、处理2和对照樟树幼苗叶片N含量呈总体上升的变化趋势,各处理的最大值分别为23.5、25.1和21.1 g/kg;处理3则呈升—降—升的变化趋势,在熏气第30 d达到峰值(21.8 g/kg)。至熏气结束时,处理1、处理2、处理3和对照 N元素含量分别比熏气前提高了 23.50%、34.97%、20.77%和12.02%。
从各体积分数NO2对樟树幼苗叶片N含量的影响来看,处理1和处理2在熏气过程中始终显著高于对照,而处理3在熏气第15 d和45 d与对照差异不显著,其它熏气时段也显著高于对照。至熏气结束时,3种处理N元素含量依次为 22.6、25.2和 22.1 g/kg,分别比对照提高了10.24%、20.48%和 7.80%。可见,为期 60 d各体积分数NO2均不同程度提高了樟树幼苗叶片N元素的积累。
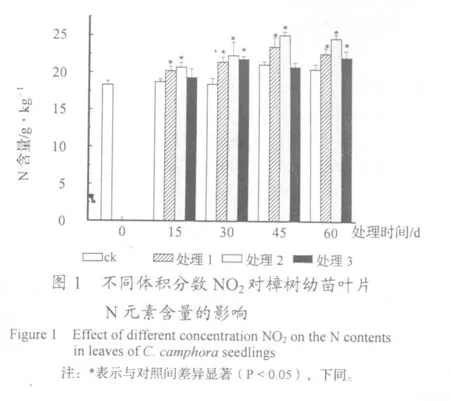
2.2 NO2对樟树幼苗叶片NR活力的影响
从图2可以看出,各处理樟树幼苗叶片的NR活力随熏气时间的推移呈逐步上升的变化趋势,至熏气结束时3种处理和对照分别上升至19.359 9、20.579 1、18.047 1和17.659 8μg/(g·h)。在熏气第15天时,对照较熏气前出现明显下降,降幅达52.83%。
在整个熏气过程中,处理 2樟树幼苗叶片的NR活力始终为各处理中最强,且显著强于对照(第30天未达显著水平);处理1在熏气第15天时显著高于对照,而处理3在熏气第45天时显著低于对照,其它熏气时段则与对照差异不显著(图2)。可见,处理2和处理1中的NO2增强了NR活力,而处理3中的NO2抑制了NR活力。

3 结论与讨论
NR活力随提供的NO3-浓度增加而增强,这已在欧洲赤松(Pinus sylvestris)、欧洲桤木(Alnus cremastogyne)、杉木(Cunninghamia lanceolata)和一些果树上得到证实[5]。本研究中,处理1和处理2中的NO2均增强了NR活力,处理 3中的NO2抑制了NR活力,即NR与NO3-供应量之间的正相关只存在于一定剂量范围内,当NO2-N供应量超过一定范围时反而引起NR活力的下降。秦天才等[6]通过对小白菜的研究认为,当镉超过一定浓度后,促进植株抗坏血酸分解、游离脯氨酸积累,从而抑制NR活力。本研究中,在处理3 NO2影响下,樟树幼苗叶片抗氧化系统活性总体下降、膜脂过氧化产物MDA含量增加[7],说明NR活力降低可能与NO2引发的氧化伤害有关。
NO2通过植物叶片气孔进入叶片后快速溶于细胞间的水相形成NO3-,NO3-被NR还原为NO2-,进一步被亚硝酸还原酶(NiR)还原成NH4+,用于氨基酸和蛋白质合成[2]。据Sabaratnam等[8]研究,为期5 d,每天7 h的0.2和0.3μL/L NO2均使大豆叶片N含量明显高于对照,0.5μL/L NO2使叶片N含量比熏气前提高了41%。本研究中,在整个熏气过程中,处理1和处理2中的NO2均使樟树幼苗叶片N元素含量显著提高,这可能与NR活力提高有关。处理 3中的NO2亦在熏气结束时使N元素含量显著提高,这种与NR活力相反的变化趋势可能是因为外界较高浓度的NO2使NO3--N在叶片过度积累所致。
[1]Morikawa H, Higaki A, Nohno M,et al.More than a 600-fold variation in nitrogen dioxide assimilation among 217 planta taxa[J].Plant, Cell Envir,1998(21):180-190.
[2]李豪喆.大豆叶片硝酸还原酶活力的研究[J].植物生理学通讯,1986(4):30-32.
[3]南京农学院.土壤农化分析[M].北京:农业出版社,1980.36-204.
[4]张志良,瞿伟菁.植物生理学实验指导[M].北京:高等教育出版社,2003.41.
[5]周国璋,苏梦云.树木硝酸还原酶的研究概况与应用前景[J].林业科学研究,1990,3(6):601-607.
[6]秦天才,吴玉树,王焕校.镉、铅及其相互作用对小白菜生理生化特性的影响.生态学报,1994,14(1):46-50.
[7]Chen Zhuo-mei, Chen Ying-xu, Du Guo-jian.Effects of 60-day NO2fumigation on growth, oxidative stress and antioxidative response inCinnamomum camphoraseedlings[J].J Zhejiang Univ Sci B, 2010, 11(3):190-199.
[8]Sabaratnam S, Gupat G, Mulchi C.Effects of nitrogen dioxide on leaf chlorophyll and nitrogen content of soybean[J].Envir Pol, 1988(51):113-120.
