赖诺普利微粒载药量与包封率影响因素研究
2010-11-03吴俊珠王成军
吴俊珠,王成军,金 拓
(1.大理学院药学院,云南大理 671000;2.上海交通大学药学院,上海 200240)
赖诺普利微粒载药量与包封率影响因素研究
吴俊珠1,2,王成军1,金 拓2
(1.大理学院药学院,云南大理 671000;2.上海交通大学药学院,上海 200240)
目的:考察处方因素对赖诺普利聚乙烯醇微粒(LIS-PVA-MP)载药量与包封率的影响。方法:喷雾干燥法制备LIS-PVAMP,单因素考察聚乙烯醇(PVA)的醇解度、分子量、浓度和料液中投料比对载药量与包封率的影响,对结果进行单因素方差分析。结果:PVA醇解度、浓度、料液中投料比三个因素的不同水平组的指标均值存在显著性差异(α=0.05),PVA分子量的不同水平组的指标均值无显著性差异(α=0.05)。结论:PVA醇解度、浓度、料液中投料比对微粒载药量与包封率影响显著。
赖诺普利;微粒;载药量;包封率
赖诺普利(lisinopril,LIS)是口服长效血管紧张素转化酶抑制剂(ACEI),临床常用于高血压和心力衰竭等疾病的治疗。目前,心血管疾病的治疗和二级预防常常需要多种药物联合使用,虽有必要,患者的顺应性会成为一个问题,开发携带、使用方便的复方剂型(Polypill)是一个解决方案〔1-6〕。聚乙烯醇(polyvinyl alcohol,PVA)是药物制剂中常用的一种水溶性辅料,其理化性质稳定,且具有良好的生物相容性,已被美国食品药品监督管理局(FDA)批准用于眼用制剂和口服片剂〔7〕。据LiaoY.H.等〔8〕报导,PVA可提高喷雾干燥法制备蛋白微粒的稳定性。为使LIS与其它活性成分制备复方制剂时有良好的稳定性,现以PVA为载体采用喷雾干燥法〔9〕制备赖诺普利聚乙烯醇微粒(lisinopril-loaded polyvinyl alcohol micro-particles,LIS-PVA-MP)。本研究中采用单因素试验考察PVA的醇解度、分子量、浓度和料液中投药比四个处方因素对LIS-PVA-MP的载药量与包封率的影响,为复方制剂的研究提供实验基础。
1 仪器与试剂
1.1 仪器 OPDT-8喷雾干燥机(上海大川原干燥设备有限公司);岛津高效液相色谱仪(LC-10AT VP泵,SPD-10A VP紫外检测器,Chromato Solution-Light色谱工作站),HT-130柱温箱;pHS-3TC数显pH计(上海天达仪器有限公司);KQ-100DB型数控超声波清洗器(昆山市超声仪器有限公司)。
1.2 试剂 LIS(批号050912,符合USP 28)及LIS精制品(纯度为99.91%,批号050912,符合USP 28),大洋化工有限公司提供。磷酸二氢钾、磷酸、氢氧化钠、盐酸(分析纯),己烷磺酸钠(含量≥98.0),国药集团化学试剂有限公司提供。乙腈(色谱纯),上海方可唯奇生物化学技术有限公司提供。PVA(Mw1 3 000~23 000,醇解度87%~89%),PVA(Mw31 000~5 0 000,醇解度87%~89%),PVA(Mw85 000~124 000,醇解度87%~89%),PVA(Mw13 000~23 000,醇解度98%)购自美国ALDRICH公司。
2 方法及结果
2.1 LIS-PVA-MP的制备工艺 称取PVA加入适量去离子水,水浴加热溶解,冷却后加入LIS搅拌使之溶解配制含药料液,采用进风温度185℃、出风温度95℃,雾化器转速38Hz,旋风分离器压差0.65kPa,喷雾干燥法制备LIS-PVA-MP。
2.2 分析方法的建立
2.2.1 检测波长的选择 以0.1mol·L-1盐酸(简称溶剂)为溶剂,配制浓度为100μg·mL-1的LIS溶液及400μg·mL-1的PVA溶液,以溶剂为空白,在紫外可见分光光度计上200~400nm进行扫描,LIS在215nm附近处有最大吸收峰,而PVA在此波长处几乎无吸收,故选择215nm为检测波长。
2.2.2 色谱条件 色谱柱:Shim-Pack VP-0DS(150mm×4.6mm,5μm);流动相:乙腈-pH2.5磷酸盐缓冲液(含0.005 3mol·L-1己烷磺酸钠)20∶80;流速:0.5mL·min-1;检测波长:215nm;柱温:55℃;进样量:20μL。
2.2.3 系统适应性 在上述色谱条件下,以0.1mol·L-1盐酸为溶剂,配制LIS精制品溶液、供试品溶液,分别取LIS精制品溶液、供试品溶液及空白样品溶液(取微粒处方用量的PVA,按供试品溶液制备方法配制)各20μL进样,记录色谱图,PVA对测定无干扰,色谱图见图1。
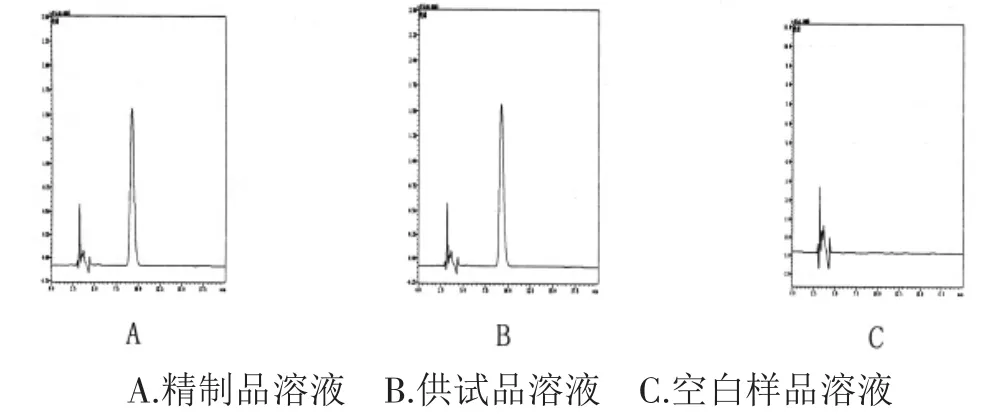
图1 色谱图
2.2.4 线性范围与最低检测限 精密称定LIS精制品10mg,用溶剂约50mL溶解,转移至100mL容量瓶中,溶剂稀释至刻度,摇匀,得精制品储备液1。精密吸取储备液1 50mL于100mL容量瓶中,溶剂稀释至刻度,摇匀,得储备液2。分别精密吸取储备液2 1.0,2.0,3.0,4.0,5.0mL于10mL容量瓶中,溶剂稀释至刻度,摇匀,配制一系列不同浓度的LIS溶液。在上述色谱条件下,分别取20μL进样,每个浓度重复进样3次,以LIS峰面积平均值(A)对其浓度(C)回归,得回归方程:A=30217C+13774,r=0.9998
LIS在5~100μg·mL-1范围内线性良好,最低检测限为8ng(信噪比S/N=3)。
2.2.5 精密度试验 日内精密度:取20μg·mL-1精制品溶液,连续重复进样6次,其峰面积RSD=0.84%。日间精密度:3d内分别配制20μg·mL-1精制品溶液,重复进样6次,其峰面积RSD=1.36%。
2.2.6 回收率试验 分别精密称取LIS精制品10.0,11.0,10.4mg,按1∶3配比,精密称取PVA,加入,混匀,得3份模拟微粒,分别置于烧杯中,加入溶剂约50mL,60℃水浴加热5min,完全溶解,转移至100mL容量瓶中,溶剂稀释至刻度,摇匀。再对每份溶液继续分别精密吸取0.5mL,置于10mL容量瓶中,溶剂稀释至刻度,摇匀,共配制得低、中、高3个浓度的9份溶液,按上述色谱条件进样,记录峰面积,计算回收率,结果见表1。
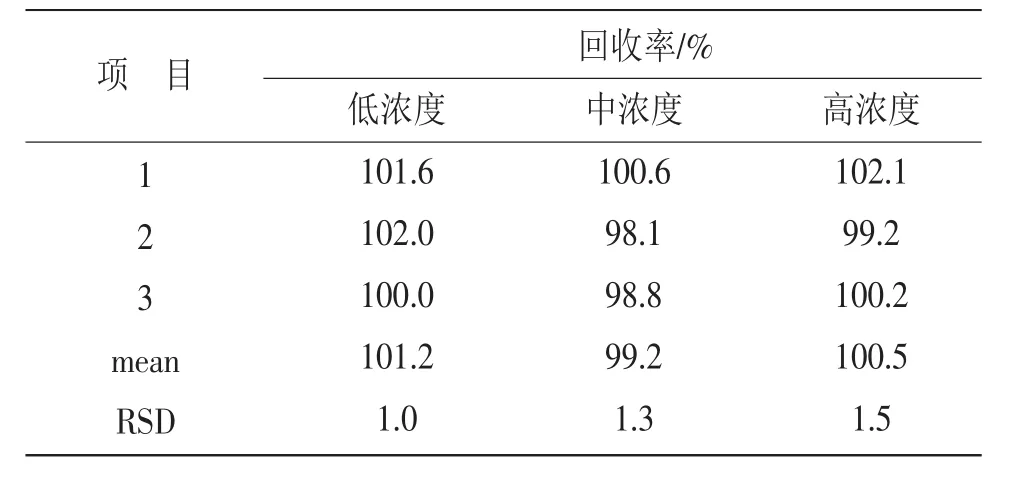
表1 回收率试验结果
样品的平均回收率为100.3%,RSD为1.0%(n= 9),符合含量测定要求。
2.2.7 重复性试验 对同一批号的LIS-PVA-MP,
分别精密称定5份,按“2.3”项下操作配制供试品溶液,并配制对照液,按上述色谱条件进样,记录峰面积,以外标法计算微粒载药量,结果见表2。
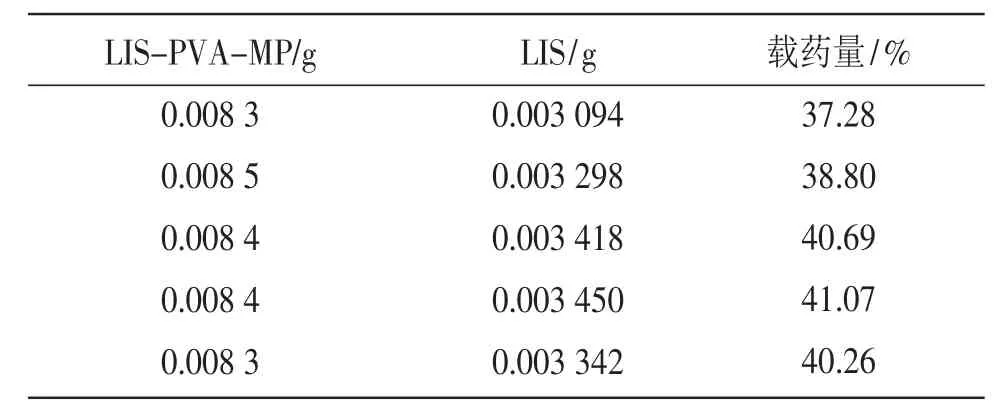
表2 重复性试验结果
微粒中LIS载药量的平均值为39.62%,RSD为1.56%。
2.2.8 稳定性试验 将供试品溶液置于冰箱中4℃保存,于0,2,6,8,12,24h取样,按上述色谱条件进样,6次所得峰面积的RSD为0.66%,表明样品溶液于4℃保存在24h内基本稳定。
2.3 载药量与包封率的测定 取LIS-PVA-MP适量精密称定,置于烧杯中,加入溶剂约50mL,60℃水浴加热5min,完全溶解,放冷,转移至100mL容量瓶中,溶剂稀释至刻度,摇匀,0.45μM滤膜过滤,取续滤液作为供试品溶液;同时以0.1mol·L-1盐酸为溶剂,配制LIS精制品溶液作为对照液,按上述色谱条件,分别取供试品溶液及对照液各20μL进样,记录峰面积,外标法计算含量,按微粒中LIS的百分含量(%,w/w)计算载药量,实际药物含量与理论药物含量比值的百分率计算包封率(Encapsulation efficiency%,EE%)。
2.4 单因素考察影响LIS-PVA-MP载药量与包封率的处方因素
2.4.1 PVA的醇解度 采用分子量为13000~23000、醇解度(hydrolysis,HD)分别为87%~89%和98%的PVA,配制PVA浓度为4%(w/v)、LIS-PVA投料比为1∶2(w/w)的料液,采用“2.1”项下所述工艺喷雾干燥法制备LIS-PVA-MP。
分别取微粒适量,精密称定,置于烧杯中,按“2.3”项下操作配制供试品溶液,并配制对照液,按上述色谱条件进样,记录峰面积,按外标法求含量,计算载药量、包封率,结果见表3。

表3 PVA醇解度对LIS-PVA-MP载药量、包封率的影响(n=3)
PVA醇解度为87%~89%和98%的LIS-PVAMP,载药量分别为(26.84±0.24)%,(28.06±0.40)%,包封率分别为(80.52±0.71)%,(84.18±1.21)%。对结果进行单因素方差分析(One—Way ANOVA),PVA醇解度为87%~89%和98%的两组LIS-PVA-MP载药量均值之间具有显著性差异(α=0.05);两组LISPVA-MP包封率均值之间具有显著性差异(α= 0.05)。
2.4.2 PVA的分子量 采用醇解度为87%~89%、分子量分别为13 000~23 000、31 000~50 000、85 000~124000的PVA,配制PVA浓度为4%(w/v)、LIS-PVA投料比为1∶2(w/w)的料液,采用“2.1”项下所述工艺喷雾干燥法制备LIS-PVA-MP。
分别取微粒适量,精密称定,置于烧杯中,按“2.3”项下操作配制供试品溶液,并配制对照液,按上述色谱条件进样,记录峰面积,按外标法求含量,计算载药量、包封率,结果见表4。
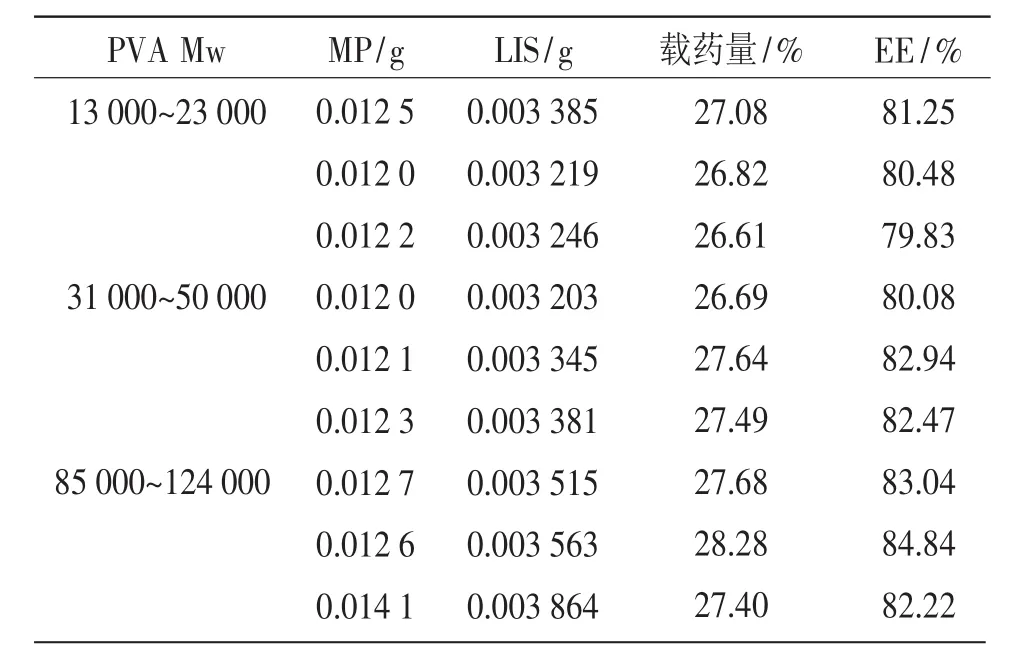
表4 PVA分子量对LIS-PVA-MP载药量、包封率的影响(n=3)
PVA分子量为13000~23000、31000~50000、85 000~124 000的LIS-PVA-MP,载药量分别为(26.84±0.24)%,(27.27±0.51)%,(27.79±0.45)%,包封率分别为(80.52±0.71)%,(81.83±1.53)%,(83.37±1.34)%。对结果进行单因素方差分析,PVA分子量为13 000~23 000、31 000~50 000、85 000~124 000的三组LIS-PVA-MP载药量均值之间无显著性差异(α=0.05);三组LIS-PVA-MP包封率均值之间无显著性差异(α=0.05)。
2.4.3 PVA的浓度 采用醇解度为87%~89%分子量为13 000~23 000的PVA,分别配制PVA浓度为2%、4%、6%(w/v),LIS-PVA投料比为1∶2(w/w)的料液,采用“2.1”所述工艺喷雾干燥法制备LIS-PVAMP。
分别取微粒适量,精密称定,置于烧杯中,按“2.3”项下操作配制供试品溶液,并配制对照液,按上述色谱条件进样,记录峰面积,按外标法求含量,计算载药量、包封率,结果见表5。
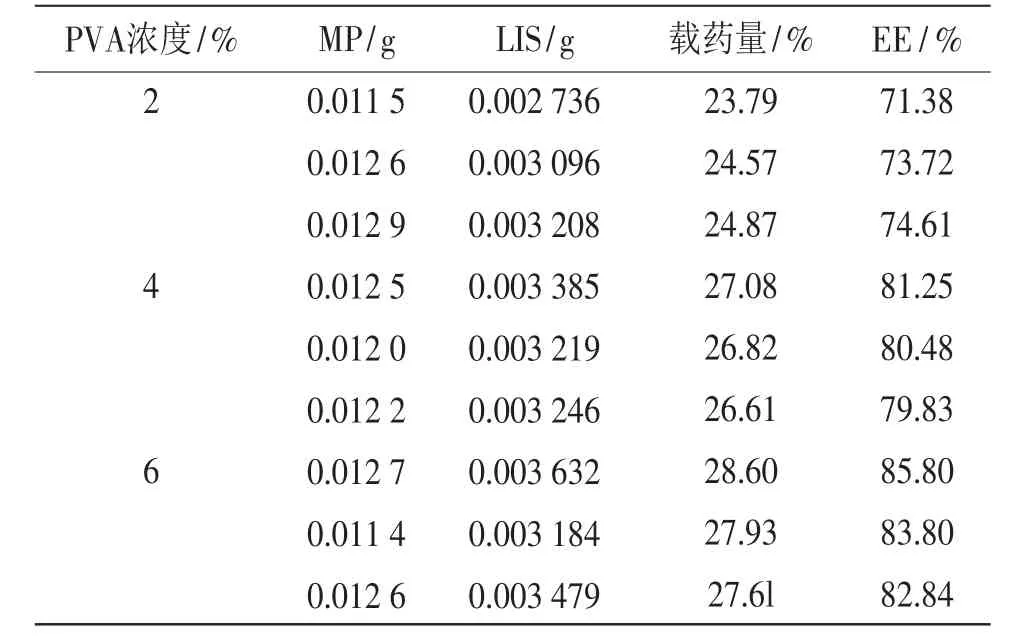
表5 PVA浓度对LIS-PVA-MP载药量、包封率的影响(n=3)
PVA浓度为2%、4%、6%(w/v)的含药料液所制备得到的LIS-PVA-MP,载药量分别为(24.41± 0.56)%,(26.84±0.24)%,(28.05±0.50)%,包封率分别为(73.24±1.67)%,(80.52±0.71)%,(84.15± 1.51)%。对结果进行单因素方差分析,PVA浓度为2%、4%、6%的三组LIS-PVA-MP载药量均值之间具有显著性差异(α=0.05);三组LIS-PVA-MP包封率均值之间具有显著性差异(α=0.05)。
2.4.4 料液中LIS-PVA投料比 采用醇解度为87%~89%分子量为13 000~23 000的PVA,配制PVA浓度为4%(w/v),LIS-PVA投料比分别为2∶1(为混悬液)、1∶2、1∶4、1∶6(w/w)的料液,采用“2.1”所述工艺喷雾干燥法制备LIS-PVA-MP。
分别取微粒适量,精密称定,置于烧杯中,按“2.3”项下操作配制供试品溶液,并配制对照液,按上述色谱条件进样,记录峰面积,按外标法求含量,计算载药量、包封率,结果见表6。
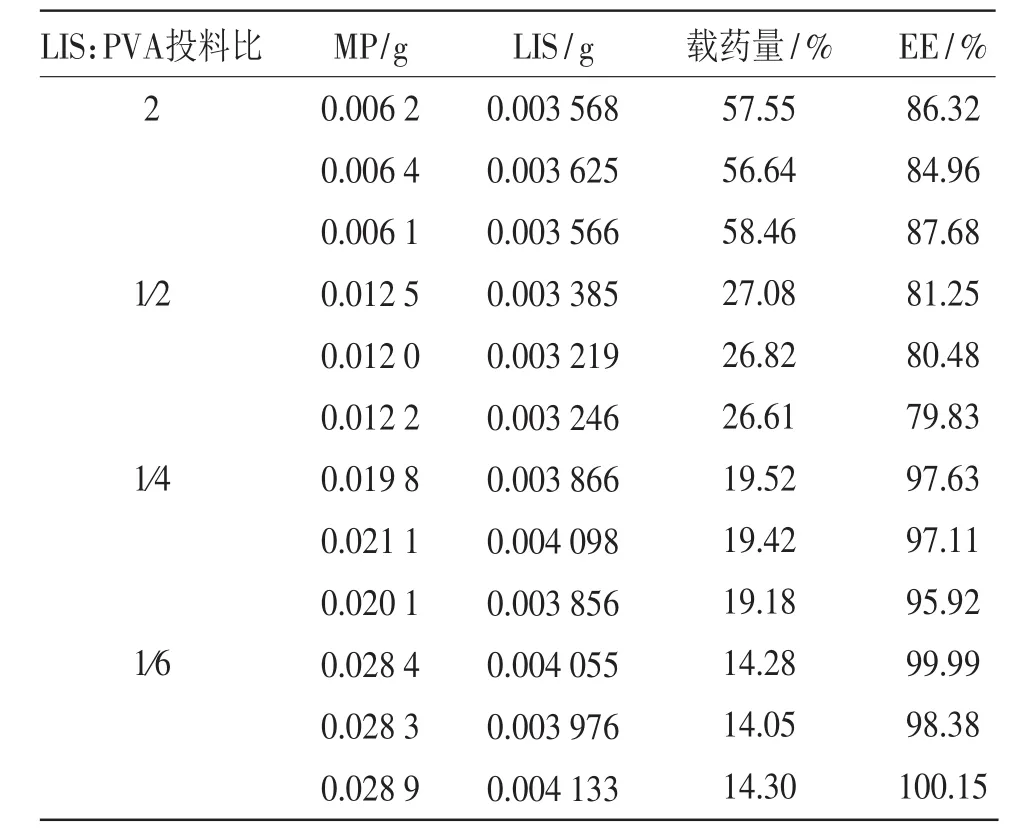
表6 投药比对LIS-PVA-MP载药量、包封率的影响(n=3)
投药比分别为2∶1、1∶2、1∶4、1∶6(w/w)的料液所制备得到的LIS-PVA-MP,载药量分别为(57.55± 0.91)%,(26.84±0.24)%,(19.37±0.17)%,(14.21± 0.14)%,包封率分别为(86.32±1.36)%,(80.52± 0.71)%,(96.89±0.88)%,(99.51±0.97)%。对结果进行单因素方差分析,投药比分别为2∶1、1∶2、1∶4、1∶6的四组LIS-PVA-MP载药量均值之间具有显著性差异(α=0.05);四组LIS-PVA-MP包封率均值之间具有显著性差异(α=0.05)。
3 讨论
3.1 色谱条件的确立 基于USP 28 LIS片含量测定方法〔10〕,以本文所述色谱系统,色谱柱为Shim-Pack VP-0DS(150mm×4.6mm,5um),其它条件按USP 28进行,结果主峰拖尾严重,无法达到其规定的标准。通过调整流动相pH、柱温、流速,可获得适宜保留时间,改善LIS以单峰洗脱时的峰形和拖尾,最终确立了文中的色谱条件,理论塔板数按LIS计算为1903,拖尾因子为1.3,符合USP28对本品的规定。3.2 单因素考察试验 通过单因素试验,在工艺参数相同条件下,PVA的醇解度对微粒载药量、包封率的影响显著,PVA(HD 98%)含药料液制备的LISPVA-MP两项指标均值显著高于PVA(HD 87%~89%)。PVA的分子量对微粒载药量、包封率的影响并不显著。PVA浓度对微粒载药量、包封率的影响显著,随浓度增大,载药量、包封率有所增大。料液中投药比对微粒载药量、包封率均具有显著影响,投药比为1∶2、1∶4、1∶6时,LIS完全溶解,随投药比增大,载药量增大,但包封率降低;当投药比为2∶1时,LIS在料液中以混悬状态存在,包封率的变化不符合LIS溶解状态时的变化趋势。
根据单因素试验结果,对各影响因素的范围做适当调整后,进一步安排正交试验优化处方及制备工艺参数。
〔1〕WALD N J,LAW M R.A strategy to reduce cardiovascular disease by more than 80%〔J〕.BMJ,2003,326(7404):1419-1424.
〔2〕Fahey T,Brindle P,Ebrahim S.The polypill and cardiovascular disease-May be appropriate for secondary,but perhaps not for primary prevention〔J〕.BMJ,2005,330(7499):1035-1036.
〔3〕 Robinson JG,Maheshwari N.A“poly-portfolio”for secondary prevention:A strategy to reduce subsequent events by up to 97%over five years〔J〕.AM J CARDIOL,2005,95(3):373-378.
〔4〕Don Poldermans,Robert Glazes,Stefanos Kargiannis,et al.Tolerability and blood pressure-lowering efficacy of the combination of amlodipine plus calsartan compared with lisinopril plus hydrochlorothiazide in adult patients with stage 2 hypertension〔J〕.Clinical Therapeutics,2007,29(2):279-289.
〔5〕David S Wald,Malcolm Law,Sarah Mills,et al.A 16-week,randomized,double-blind,placebo-controlled,crossover trial to quantify the combined effect of an angiotensin-converting enzyme inhibitor and a β-blocker on blood pressure reduction〔J〕.Clinical Therapeutics,2008,30(11):2030-2039.
〔6〕Vijay Kumar,Bhagwat Prasad,Saranjit Singh. Pharmaceutical issues in the development of a polypill for the treatment of cardiovascular diseases〔J〕.Drug Discovery Today:Therapeutic Strategies,2008,5(1):63-71.
〔7〕Arthur H Kibbe.Handbook of pharmaceutical excipients(3rd Edition)〔M〕.London:Pharmaceutical Press,2000:424-425.
〔8〕Yong-Hong Liao,Marc B.Brown,Stuart A Jones,et al. The effects of polyvinyl alcohol on the in vitro stability and delivery of spray-dried protein particles from surfactant-free HFA 134a-based pressurised metered dose inhalers〔J〕. International Journal of Pharmaceutics,2005,304(1-2):29-39.
〔9〕OZMEN L,LANGRISH T A G,GIPPS E M.Spray drying pharmaceutical products for nasal delivery:The effects of feed solution properties and operating conditions on particle size and density〔C〕//Leonardi E,Madhusudana C V.Heat and Mass Transfer Australasia Proceedings of the Sixth Australasian: Heatand Mass TransferConference,December 9-12,1996,Sydney,Australia.New York:Begell House,1998:427-434.
〔10〕The United States Pharmacopeial Convention.The United States Pharmacopeia〔S〕.Rockville,USA:2005(USP28-NF23):1139-1140.
Investigation on the Formulation Factors Influencing Drug Loading Capacity and Encapsulation Efficiency of Lisinopril Loaded Polyvinyl Alcohol Micro-particles
WU Junzhu1,2,WANG Chengjun1,JIN Tuo2
(1.College of Pharmacy,Dali University,Dali,Yunnan 671000,China; 2.College of Pharmacy,Shanghai Jiaotong University,Shanghai 200240,China)
Objective:To investigate the formulation factors influencing drug loading capacity and encapsulation efficiency(EE)of lisinopril-loaded polyvinyl alcohol(PVA)micro-particles(LIS-PVA-MP).Methods:LIS-PVA-MP was prepared by spray-drying and the formulation factors influencing drug loading capacity and EE such as hydrolysis degree(HD)of PVA,molecular weight(Mw)of PVA,concentration of PVA and weight ratio of lisinopril to PVA in the feed solution were investigated by single factor experiments.Results:Differences were analyzed by one-way analysis of variance(ANOVA).At the 0.05 level,the means are significantly different in the factors such as HD of PVA,concentration of PVA and weight ratio of lisinopril to PVA in the feed solution.However,at the 0.05 level,the means are not significantly different in the factor of Mw of PVA.Conclusion:All of the three factors,HD of PVA,concentration of PVA and weight ratio of lisinopril to PVA in the feed solution,have a significant influence on drug loading capacity and EE of LIS-PVA-MP.
lisinopril;micro-particles;drug loading capacity;encapsulation efficiency
R972[文献标志码]A[文章编号]1672-2345(2010)02-0006-05
大理学院科研基金资助项目(2007X39)
2009-09-25
吴俊珠,讲师,主要从事药剂学研究.
(责任编辑 蒋 康)
