黄鲫(Setipinna taty)蛋白酶解液的抑菌活性及稳定性研究
2010-10-27韦荣编汪东风
宋 茹,韦荣编,谢 超,汪东风*
(1.中国海洋大学食品科学与工程学院,山东 青岛 266003;2.浙江海洋学院食品与药学学院,浙江 舟山 316004;3.中国药科大学生命科学与技术学院,江苏 南京 210018)
黄鲫(Setipinna taty)蛋白酶解液的抑菌活性及稳定性研究
宋 茹1,2,韦荣编2,3,谢 超2,汪东风1,*
(1.中国海洋大学食品科学与工程学院,山东 青岛 266003;2.浙江海洋学院食品与药学学院,浙江 舟山 316004;3.中国药科大学生命科学与技术学院,江苏 南京 210018)
以黄鲫为原料测定其氨基酸组成,比较风味蛋白酶、胰蛋白酶、胃蛋白酶、碱性蛋白酶和木瓜蛋白酶水解黄鲫蛋白所得酶解液对大肠杆菌的抑菌作用,并对抑菌效果最强的蛋白酶酶解液进行抑菌稳定性研究。结果表明:黄鲫蛋白必需氨基酸含量丰富,其中胃蛋白酶的水解液对大肠杆菌抑菌作用强,相对分子质量主要分布在3000~1000;黄鲫胃蛋白酶酶解液对热稳定,酸性低pH值可增强其抑菌效果,可耐受胰蛋白酶和β-内酰胺酶处理,该酶解液有作为天然抗菌剂应用的前景。
黄鲫;蛋白酶解液;抑菌活性;稳定性
在抗生素滥用、耐药菌株不断产生的今天,国内外学者掀起了抗菌肽的研究热潮,人们在不断寻找新的抗菌肽,探索抗菌肽新的作用机制。蛋白酶解法制备抗菌肽有反应条件温和、反应过程容易控制等优点,该方法可能是大批量生产抗菌肽最有前途的方法[1]。通过酶解乳源蛋白、卵白蛋白、牡蛎蛋白,已经从酶解液中分离得到多种新型抗菌肽[2-7]。
黄鲫(Setipinna taty)是我国南海、东海、黄海、渤海海域常年捕获、产量较大的一种小型鱼[8],因为其肉薄、刺多,目前综合加工利用程度低。有关黄鲫蛋白加工利用的研究还未见报道,本实验通过研究黄鲫不同蛋白酶酶解液的抑菌作用及抑菌酶解液的稳定性,旨在为黄鲫蛋白酶解液的抗菌应用提供实验依据。
1 材料与方法
1.1 材料、试剂与仪器
黄鲫购于舟山南珍水产市场。
胃蛋白酶、木瓜蛋白酶 中国医药集团上海化学试剂公司;碱性蛋白酶、风味蛋白酶、胰蛋白酶 广西南宁庞博生物工程有限公司;牛血清白蛋白、抑肽酶、VB12、氧化型谷胱甘肽、β-内酰胺酶、L-肌肽、氨苄青霉素;其余试剂为分析纯。
DS-1型高速组织捣碎机 上海标本模型厂;PP-20型pH计 德国赛多利斯公司;HHS型电热恒温水浴锅上海博迅实业有限公司医疗设备厂;LDZX-40BI型立式自动电热压力蒸汽灭菌器 上海申安医疗器械厂;HWS型智能生化培养箱 宁波江南仪器厂;SW-CJ-1F型单人双面净化工作台 苏州净化设备有限公司;Himae CF 16 RX型多功能离心机、UV-1200型紫外-可见分光光度计、835-50氨基酸自动分析仪 日本日立公司;KTAPurifier 100蛋白纯化系统 瑞典GE公司。
1.2 方法
1.2.1 黄鲫氨基酸组成分析
取黄鲫脱水干样10mg,加入6mol/L HCl溶液,充氮气后,热融密封,110℃烘箱中水解24h,脱酸后,用水定容至适当浓度,用氨基酸自动分析仪测定。
1.2.2 黄鲫蛋白酶解液的制备
-20℃冻藏黄鲫用流动水进行解冻,去头和内脏,去离子水清洗干净,鱼体切成碎块用组织捣碎机捣碎(经测定蛋白质和脂肪含量分别为(72.45±0.60)%和(24.83±1.32)%(干质量),按照鱼糜质量10倍比例加入去离子水,振荡混合,然后用6mol/L HCl溶液和6mol/L NaOH溶液调混合浆液pH值至实验蛋白酶最适pH值,在实验用酶最适酶解温度下保温10min,根据鱼糜质量按1000U/g比例加入蛋白酶,搅拌均匀。反应过程中用酸和碱调节pH值以保持混合浆液pH值在各蛋白用酶最适pH值范围内。酶解时间5h,反应结束后,酶解液经95~100℃加热10min钝化灭酶,再用酸碱调节浆液pH值至中性,酶解液经低温(4℃)7000r/min离心10min,弃去上层油膜和底部残渣,留中间清液,-20℃保藏备用。
1.2.3 黄鲫蛋白酶解液的抑菌作用
根据文献[9]吸光度法略加修改,分别在5mL 肉汤液体培养基中加入各蛋白酶酶解液1mL(预先调节各酶解液蛋白质浓度一致,并用0.22μm滤膜过滤除菌)和0.1mL指示菌——大肠杆菌菌悬液(菌龄为18~24h,菌浓度107CFU/mL),混合均匀,37℃培养24h ,以5mL 肉汤液体培养基和1mL 灭菌生理盐水混合液为空白调零,测定样品在波长570nm处吸光度(A样品),同时测定样品空白和对照的吸光度。样品空白(A样空)不加菌悬液,其余条件相同;对照(A对照)用1mL 灭菌生理盐水代替1mL蛋白酶解液,其余条件相同。每个样品平行测定3次,计算蛋白酶解液抑菌率。

1.2.4 具有抑菌作用的黄鲫蛋白酶解液相对分子质量分布
1.2.5 抑菌圈法
根据文献[10]琼脂扩散法略加改进,培养皿中加入100μL活化好的大肠杆菌菌悬液(菌龄为18~24h,浓度为106~107CFU/mL),然后加入45~50℃左右营养琼脂培养基15mL,充分混合均匀,待琼脂凝固后,用灭菌打孔器(直径4mm)打孔,每孔加入经过滤除菌的酶解液25μL,37℃培养24h,测定抑菌圈直径。
1.2.6 黄鲫蛋白酶解液抑菌稳定性
热稳定性:采用抑菌圈法测定黄鲫胃蛋白酶酶解液经80、90、100、121℃分别加热15、30min后酶解液的抑菌圈直径大小,未经加热处理样品为对照,抑菌效果记作100%。
pH值稳定性:质量相同的黄鲫胃蛋白酶酶解液冻干粉,分别用pH2.4、3.4、4.4、5.4、6.4、7.4、8.4、9.4的甘氨酸-HCl或Tris-HCl缓冲液溶解,室温静置30min,抑菌圈法测定不同pH值下的抑菌圈直径。
对胰蛋白酶稳定性:黄鲫胃蛋白酶酶解液与等体积质量分数为0.25%胰蛋白酶(酶活力2500U/mg)混合,在37℃水浴分别作用1、2、3、4、5h,然后95℃加热灭酶10min,抑菌圈法测定抑菌结果,其中未经胰蛋白酶水解的黄鲫胃蛋白酶酶解液抑菌结果记作100%。
对β-内酰胺酶稳定性:黄鲫胃蛋白酶酶解液与适量β-内酰胺酶混合,室温下作用30min,然后采用抑菌圈法测定菌结果,氨苄青霉素与β-内酰胺酶混合后的抑菌结果为对照。
1.2.7 数据统计分析
实验数据用平均值±标准差表示(n=3),采用SPSS 16.0 统计软处理数据,应用t-test 检验组间差异显著性,P< 0.05表示组间差异显著。
2 结果与分析
2.1 黄鲫蛋白的氨基酸组成分析

表1 黄鲫蛋白氨基酸组成Table 1 Amino acid composition of half-fin anchovy g/ 100g(干质量)
黄鲫蛋白水解液共检测出16种氨基酸(表1),其中必需氨基酸7种。含量最高的氨基酸是与鲜味有关的谷氨酸(13.14%)和天冬氨酸(7.63%),此外赖氨酸含量也较高(6.30%),含量最低氨基酸是组氨酸(1.39%)。黄鲫氨基酸总量为样品质量的74.41%,其中ΣEAA/ΣAA和ΣEAA/ΣNEAA比值分别为0.51和1.04,高于FAO/WHO建议值0.40和0.60[11],说明黄鲫蛋白是一种优质蛋白,以该蛋白质为基物,通过酶解法制备的抗菌酶解液营养均衡,有作为功能型抗菌剂的应用前景。
2.2 黄鲫蛋白酶解液的抑菌结果比较制备抗菌酶解液的实验用酶和酶解条件也不一定相同。实验选用风味蛋白酶、胰蛋白酶、胃蛋白酶、碱性蛋白酶和木瓜蛋白酶为实验用酶,以大肠杆菌为指示菌,吸光度法测定各酶解液的抑菌作用,结果如图1所示。
黄鲫经不同蛋白酶水解后,胃蛋白酶的酶解液对大肠杆菌的抑菌效果最强,其次为胰蛋白酶,而风味蛋白酶、碱性蛋白酶和木瓜蛋白酶的酶解液对大肠杆菌表现出不同程度的促生长作用(图1)。胃蛋白酶和胰蛋白酶均为专一性强的内切酶,胃蛋白酶断裂点两侧的残基要求都是疏水性(或非极性)氨基酸,如:Phe、Leu、
Trp、Tyr等[12]。胰蛋白酶只断裂Arg、Lys羧基参与形成的肽键[12],其中富含精氨酸的肽特有的阳离子和氢键特性有利于与菌体细胞膜上大量的阴离子组分结合,进而生成膜拟态结构达到抑菌效果[13]。具有抗菌作用的肽类一级结构比较相似,N端富含赖氨酸和精氨酸等阳离子型氨基酸,C端富含丙氨酸、缬氨酸、甘氨酸等非极性氨基酸,中间部分则富含脯氨酸[14-15]。抗菌肽的抗菌机理主要分为膜损伤和非膜损伤两大类,但不管哪种抗菌机制,抗菌分子首先要结合到细胞膜上,而酶解液中疏水性残基片段越多,越有利于与细胞膜上的亲脂蛋白结合,而后再通过特定的抗菌方式实现抗菌作用。
2.3 具有抑菌作用的黄鲫蛋白酶解液相对分子质量分布黄鲫胃蛋白酶和胰蛋白酶的酶解液具有抑菌作用,其凝胶分离色谱图和各分离峰所对应的相对分子质量范围分别见图2和表2。

图2 黄鲫胃蛋白酶酶解液(a)和胰蛋白酶酶解液(b)的凝胶分离色谱Fig.2 Gel filtration chromatograms of half-fin anchovy hydrolysatesseparately derived from pepsin and trypsin digestion

图1 黄鲫5种蛋白酶酶解液的抑菌率比较Fig.1 Comparison of antibacterial activities among half-fin anchovy hydrolysates derived from 5 kinds of proteases
据国内外研究报道风味蛋白酶、胰蛋白酶、胃蛋白酶、碱性蛋白酶和木瓜蛋白酶的蛋白酶解液均表现出一定的抑菌作用。不同蛋白质,指示菌不同,酶解法

表2 黄鲫胃蛋白酶和胰蛋白酶酶解液的相对分子质量分布范围Table 2 Relative molecular mass distribution of half-fin anchovy hydrolysates separately derived from pepsin and trypsin
由图2可知,黄鲫胃蛋白酶的酶解液主要有5个分离峰,胰蛋白酶的酶解液有6个分离峰,但从各峰对应的洗脱体积(表2)可以看出胃蛋白酶分离峰1、2、3、4、5分别与胰蛋白酶分离峰1、2、3、4、6的洗脱体积接近,表明具有抑菌作用的黄鲫胃蛋白酶和胰蛋白酶的酶解液在相对分子质量分布方面具有相似性。由表2结果同时可知,黄鲫胃蛋白酶和胰蛋白酶的相对分子质量主要在3000以下,其中胃蛋白酶酶解液相对分子质量3000~1000的含量高于胰蛋白酶酶解液,而1000~500和<500的含量则分别低于胰蛋白酶的酶解液。黄鲫胃蛋白酶和胰蛋白酶酶解液的有效抑菌成分可能属于不同相对分子质量范围,进一步的分离纯化工作正在进行中。
2.4 黄鲫胃蛋白酶酶解液抑菌影响因素研究
通过以上分析,黄鲫胃蛋白酶酶解液抑菌效果高于其胰蛋白酶酶解液效果,且从经济角度来看,胰蛋白酶价格高于黄鲫胃蛋白酶,故选用胃蛋白酶为实验用酶,经过响应面分析(RSM)优化出具有抑菌作用的黄鲫胃蛋白酶酶解液。在此基础上,对优化后的酶解液抑菌稳定性进行了研究。
2.4.1 加热温度和时间对抑菌作用的影响

表3 不同加热温度和时间对黄鲫胃蛋白酶酶解液抑菌效果的影响(n=3)Table 3 Effects of heating temperature and time on antibacterial activity of half-fin anchovy hydrolysate separately derived from pepsin digestion (n=3)%
121℃加热处理对黄鲫胃蛋白酶的酶解液抑菌结果影响最大(表3),其中加热15min和30min后的抑菌率分别为对照的(85.81±3.56)%和(90.32±1.41)%,但与对照抑菌率比较并无显著性差异(P>0.05),表明胃蛋白酶酶解液中抑菌组分对热较稳定。
2.4.2 pH值对抑菌作用的影响
pH值通过影响抗菌肽分子表面所带电荷数进而影响抗菌肽分子构型,会增强或降低抑菌作用。黄鲫胃蛋白酶酶解液在不同pH值条件下的抑菌结果如图3所示。
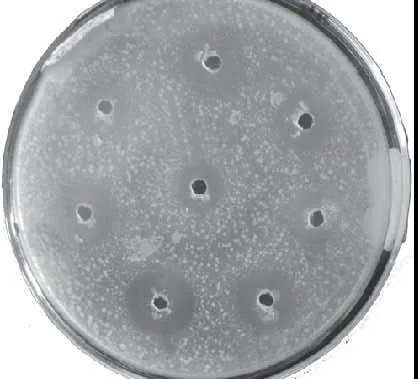
图3 不同pH值对黄鲫胃蛋白酶酶解液抑菌作用的影响Fig.3 Effect of pH on antibacterial activity of pepsin hydrolyzed halffin anchovy
黄鲫胃蛋白酶酶解液在pH2.4~9.4条件下对大肠杆菌均有抑菌作用(图3),对应的pH2.4~9.4缓冲液本身无抑菌作用,其中在弱酸条件下(pH5.4)抑菌性最强。过酸或过碱会改变酶解液中抗菌组分的电荷数,而电荷数的改变不但影响抗菌肽的二级结构和亲水性,同时还改变了抗菌肽的三级结构、在水溶液和细胞膜上的存在形态[16-17],进而会影响到抑菌性。据报道富含组氨酸的阳离子型抗菌肽LAH4在中性条件下抗菌性一般,但在在酸性条件下抗菌性增强[18]。抗菌肽Kappacin在酸性条件下30μmol/L以上即对人造脂质体具有膜溶解性,但在中性pH值下几乎无膜溶解性[19]。
2.4.3 胰蛋白酶对抑菌作用的影响
黄鲫胃蛋白酶酶解液进一步用胰蛋白酶进行二次酶解,以判定对胰蛋白酶的稳定性,结果见表4。

表4 胰蛋白酶对黄鲫胃蛋白酶酶解液抑菌作用的影响(n=3)Table 4 Effect of trypsin on antibacterial activity of pepsin hydrolyzed half-fin anchovy (n=3)
黄鲫胃蛋白酶酶解液经胰蛋白酶水解1~5h后,对大肠杆菌的抑菌结果先增加、再降低、而后又增加(表4)。专一性强的胰蛋白酶会进一步裂解黄鲫胃蛋白酶水解液中Arg、Lys羧基参与形成的肽键,释放不同的肽段。但是,黄鲫胃蛋白酶酶解液经胰蛋白酶作用后的抑菌效果与对照比较无显著性改变(P>0.05),表明具有抗菌作用的黄鲫胃蛋白酶酶解液能耐受胰蛋白酶作用,但是否生成新的抗菌片段还有待于进一步研究。
2.4.4 黄鲫胃蛋白酶酶解液对β-内酰胺酶的稳定性
β-内酰胺酶能专一性断裂β-内酰胺环结构,具有β-内酰胺环结构的抗生素其特有环状结构遭到病原菌的破坏,就会失去抗菌效果产生耐药性。黄鲫胃蛋白酶水解物和抗菌对照药物氨苄青霉素对β-内酰胺酶稳定性结果见图4。

图4 β-内酰胺酶对黄鲫胃蛋白酶酶解液抑菌效果的影响Fig.4 Effect of β-lactamase on antibacterial activity of pepsin hydrolyzed half-fin anchovy
由图4可知,黄鲫胃蛋白酶酶解液经β-内酰胺酶处理后,对大肠杆菌仍然具有较强的抑菌效果,而氨苄青霉素经β-内酰胺酶作用后,抑菌作用完全丧失。说明黄鲫胃蛋白酶酶解液的抗菌组分不含有β-内酰胺环结构,对一些耐药菌可以发挥作用,有进一步开发为耐药菌抗生素的价值。
3 结 论
黄鲫氨基酸总量为样品质量的74.41%,其中ΣEAA/ΣAA和ΣEAA/ΣNEAA比值分别为0.51和1.04,高于FAO/WHO建议值0.40和0.60,是一种优质蛋白质。经风味蛋白酶、胰蛋白酶、胃蛋白酶、碱性蛋白酶和木瓜蛋白酶水解后,其中的胃蛋白酶酶解液对大肠杆菌抑菌作用强,相对分子质量3000~1000,含量接近70%。黄鲫胃蛋白酶的酶解液热稳定性高,弱酸性pH值可以增强其抑菌效果,并且耐受胰蛋白酶和β-内酰胺酶处理,有作为天然抗菌剂的应用前景。
[1] BOLSCHER J G M, van der KRAAN M I A, NAZMI K, et al. A oneenzyme strategy to release an antimicrobial peptide from the LFampindomain of bovine lactoferrin[J]. Peptides, 2006, 27: 1-9.
[2] MALKOSKI M, DASHPER S G, O'BRIEN-SIMPSON N M, et al.Kappacin, a novel antibacterial peptide from bovine milk[J]. Antimicrobial Agents and Chemotherapy, 2001, 45(8): 2309-2315.
[3] MCCANN K B, SHIELL B J, MICHALSKI W P, et al. Isolation and characterisation of antibacterial peptides derived from the f (l64-207)region of bovineαS2-casein[J]. International Dairy Journal, 2005, 15(2):133-143.
[4] 翟青新, 张源淑, 哈惠馨. 乳源抗菌肽的分离纯化及部分性质的研究[J]. 药物生物技术, 2006, 13(6): 422-425.
[5] PELLEGRINI A J, HLSMEIER A, HUNZIKER P, et al. Proteolytic fragments of ovalbumin display antimicrobial activity[J]. Biochimica et Biophysica Acta, 2004, 1672(2): 76-85.
[6] MINE Y, MA F P, LAURIAU S. Antimicrobial peptides released by enzymatic hydrolysis of hen egg white lysozyme[J]. Journal of Agricutural and Food Chemistry, 2004, 52: 1088-1094.
[7] LIU Zunying, DONG Shiyuan, XU Jie, et al. Production of cysteine-rich antimicrobial peptide by digestion of oyster (Crassostrea gigas) with alcalase and bromelin[J]. Food Control, 2008, 19: 231-235.
[8] 孙蜀东, 任一平. 黄海南部黄鲫Setipinna taty(Cuvieret valenciennes)渔业生物学研究[J]. 海洋湖沼通报, 2003(1): 62-65.
[9] DIONYSIUS D A, MILNE J M. Antibacterial peptides of bovine lactoferrin: purification and characterization[J]. Journal of Dairy Science,1997, 80: 667-674.
[10] MURTHY P S, MANONMANI H K. Physico-chemical, antioxidant and antimicrobial properties of Indian monsooned coffee[J]. European Food Research and Technology, 2009, 229: 645-650.
[11] FAO/WHO. Protein quality evaluation[M]. Italy: Food and Agriculture Organization of the United Nations, 1991: 51.
[12] 王镜岩, 朱圣庚, 徐长法. 生物化学: 上册[M]. 北京: 高等教育出版社, 2002: 173-174.
[13] CHAN D I, PRENNER E J, VOGEL H J. Tryptophan- and arginine-rich antimicrobial peptides: structures and mechanisms of action[J].Biochimica et Biophysica Acta, 2006, 1758: 1184-1202.
[14] BOMAN H G, HULTMARK D. Cell-free immunity in insects[J]. Annual Review of Microbiology, 1987, 41(2): 103-126.
[15] JAYNES J M, BURTON C A, BARR S B, et al.In vitrocytocidal effect of novel lytic peptides on plasmodium falciparum and trypanosom a cruzfi[J]. The FASEB Journal, 1989, 2(12): 2878-2883.
[16] van KAN E J, DEMEL R A, van der BEN A, et al. The role of the abundant phenylalanines in the mode of action of the antimicrobial peptide clavanin[J]. Biochimica et Biophysica Acta, 2003,1615(1/2):84-92.
[17] PARK I Y, PARK C B, KIM M S, et al. Parasin I, an antimicrobial peptide derived from histone H2A in the catfish,Parasilurus asotus[J].FEBS Letters, 1998, 437(3): 258-262.
[18] MASON A J, GASNIER C, KICHLER A, et al. Enhanced membrane disruption and antibiotic action against pathogenic bacteria by designed histidine-rich peptides at acidic pH[J]. Antimicrobial Agents and Chemotherapy, 2006, 50(10): 3305-3311.
[19] DASHPER S G,BRIEN-SIMPSON N M, CROSS K J, et al.Divalent metal cations increase the activity of the antimicrobial peptide kappacin[J]. Antimicrobial Agents and Chemotherapy, 2005, 49(6): 2322-2328.
Antibacterial Activity and Stability of Half-Fin Anchovy (Setipinna taty) Protein Hydrolysate
SONG Ru1,2, WEI Rong-bian2,3, XIE Chao2, WANG Dong-feng1,*
(1. College of Food Science and Engineering, Ocean University of China, Qingdao 266003, China;2. School of Food Science and Pharmacy, Zhejiang Ocean University, Zhoushan 316004, China;3. School of Life Sciences and Technology, China Pharmaceutical University, Nanjing 210018, China)
Half-fin anchovy (Setipinna taty) was determine for its amino acid composition. The antibacterial activities of halffin anchovy hydrolysates separately derived from flavor protease, trypsin, pepsin, alkaline protease and papain digestion were evaluated usingEscherichia coli. Half-fin anchovy was rich in essential amino acids. The pepsin hydrolysate exhibited the highest antibacterial activity againstEscherichia coliand its relative molecular mass ranged from 3000 to 1000. In addition, pepsin hydrolyzed half-fin anchovy also exhibited high thermal stability and enhanced antibacterial activity at lower acidic pH values.Moreover, pepsin hydrolyzed half-fin anchovy exhibited high tolerance to trypsin andβ-lactamase. Therefore, pepsin hydrolyzed half-fin anchovy appears to be a promising natural antibacterial agent.
half-fin anchovy;protein hydrolysate;antibacterial activity;stability
TS254.1
A
1002-6630(2010)13-0088-05
2009-11-12
舟山市科技计划项目(Y20082086)
宋茹(1976—),女,博士研究生,主要从事食品化学和食品营养研究。E-mail:happysong545@yahoo.com.cn*通信作者:汪东风(1956—),男,教授,博士,主要从事食品与生物工程研究。E-mail:wangdf@ouc.edu.cn
